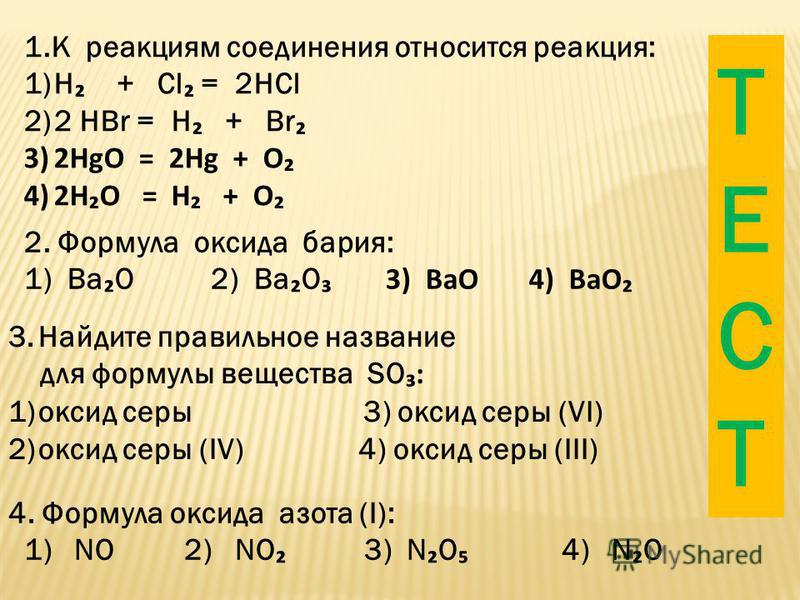
Реакция бария с водой
Мировая экономика
Нефть Brent и WTI
USD/JPY
USD/AUD
USD/CHF
USD/GBP
USD/CAD
Серебро
Палладий
Золото
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 787)
- Экономика Второй индустриализации России (104 831)
- Этилен (этен), получение, свойства, химические реакции (37 592)
- Программа искусственного интеллекта ЭЛИС (31 966)
- Крахмал, свойства, получение и применение (31 662)
- Природный газ, свойства, химический состав, добыча и применение (30 839)
- Метан, получение, свойства, химические реакции (30 220)
- Целлюлоза, свойства, получение и применение (29 982)
- Пропилен (пропен), получение, свойства, химические реакции (28 498)
- Прямоугольный треугольник, свойства, признаки и формулы (28 105)
Еще технологии
Поиск технологий
 Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия
Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия Поиск технологий
Финансирование:Технологии ожидают финансирования
В процессе разработки:Технологии в процессе разработки
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Может быть интересно:
Гидроксид бария цена в Екатеринбурге
Гидроксид бария – вещество высокотоксичное, предрасположенное к коррозийным процессам и имеющее белый оттенок. Оно относится к реагентам второго класса опасности.
При разведении гидроксида бария в воде получается щелочной раствор, именуемый баритовой водой. При соединении с молекулами H2O бариевая щелочь образует не имеющие цвета кристаллогидраты.
Свойства
Вещество легко растворяется в воде, причем растворимость увеличивается по мере нагревания, однако, если сореагент находится в кристаллизационном состоянии, при температуре +78°C продукт склонен к плавлению.
Едкий барий растворим в этаноле и, при соблюдении определенных условий, в ацетоне. Не растворим в жидком аммиаке и диэтиловом эфире.
Получение
В лаборатории гидроксид бария образуется в процессе выполнения следующих химических реакций:
- при взаимодействии металла с водой — при этом дополнительно выделяется h3;
- в результате соединения оксида бария и h3O;
- путем растворения сульфида бария в кипятке, где побочный продукт — h3S.
Химические свойства
Едкий барий – это активное вещество, проявляющее как кислотные, так и общехимические свойства, и являющееся основанием для своих производных.
Гидроксид имеет следующие характеристики:
- токсичность — 0,5 мг/м3;
- растворимость в воде — 3,9 при 20°C;
- молекулярная масса гидроксида бария — 171,35;
- температура кипения — 100°С, при давлении в 760 мм ртутного столба;
- плавление при 78°C;
- плотность — 2,18 г/см3.
Применение
Раствор гидроксида бария используется в следующих процессах:
- при изготовлении лаков и красок;
- в работах по очищению вод;
- в получении радия и обработке его растворов для выделения солей;
- при необходимости выполнения смазочных функций;
- в целях изготовления солей бария и гидроксидов рубидия;
- при добыче сахара из мелиссы;
- для производства присадок к маслам;
- при синтезе фенолформальдегидного связующего;
- при создании садовых инсектицидов.

Помимо этого, едкий барий нашел свое применение в керамической и текстильной промышленности.
Также гидроксид придает пиротехническому пламени зеленый оттенок при горении.
Правила эксплуатации
При работе с препаратом следует соблюдать правила личной гигиены и применять СИЗ. Рабочие помещения должны содержать вытяжную вентиляцию.
Продукт не горюч. В случае разлива его следует аккуратно собрать раствор в специальный контейнер для утилизации.
Жидкие и твердые отходы отправляются на вторичную переработку.
Препарат упаковывают и маркируют в соответствии ГОСТу 3885-73.
Купить гидроксид бария вы можете у нас в компании. Заявку можно оформить, позвонив по указанному номеру телефона либо отправив заполненную форму обратной связи. Для постоянных и оптовых клиентов имеется система скидок. Цена на товар находится в пределах среднерыночной, благодаря отсутствию посредников.
РЕАКЦИИ ЭЛЕМЕНТОВ ГРУППЫ 2 С ВОДОЙ На этой странице рассматриваются реакции элементов 2-й группы — бериллия, магния, кальция, стронция и бария — с водой (или паром). Он использует эти реакции для изучения тенденции реактивности в группе 2. Факты Бериллий Бериллий реагирует с паром при высоких температурах (обычно около 700°C или выше) с образованием белого оксида бериллия и водорода. (Уравнение точно такое же, как для магния ниже.) | ||
Примечание: До ноября 2016 года на этот момент у меня было утверждение: «Бериллий не вступает в реакцию с водой или паром даже при красном калении». Это часто цитировалось в учебниках, и моими источниками были книги по неорганическим наукам на уровне степени, а позже книги по неорганическим наукам на уровне А.  Тем не менее, исследователь в области разработки термоядерного синтеза указал мне, что проводится большая работа по изучению реакции между бериллием и паром, потому что это может быть проблемой безопасности в конструкции реактора, и прислал мне фотографию, показывающую результат подвергание бериллия воздействию пара при 800°С. Однозначно реагирует. Я думаю, проблема в том, что бериллий дорог и опасен для здоровья. Это означает, что немногие учителя когда-либо справились с этим — я, конечно, не справился. Это означает, что заявления об этом в учебниках (или в наши дни в Интернете) никогда не проверяются и просто передаются независимо от их точности. Я извиняюсь за свою роль в этом. | ||
Магний Магний сгорает в паре с образованием белого оксида магния и газообразного водорода.
Очень чистая лента из магниевого сплава слабо реагирует с холодной водой.
| ||
Примечание: Как правило, если металл вступает в реакцию с холодной водой, образуется гидроксид металла. Если он реагирует с паром, образуется оксид металла. Это связано с тем, что гидроксиды металлов термически разлагаются (расщепляются при нагревании) с образованием оксида и воды. | ||
Кальций, стронций и барий Все они реагируют с холодной водой с возрастающей энергией с образованием гидроксида металла и водорода. Стронций и барий имеют реакционную способность, подобную литию в группе 1 периодической таблицы. Кальций, например, довольно энергично реагирует с холодной водой в экзотермической реакции. Выделяются пузырьки газообразного водорода и образуется белый осадок (гидроксида кальция) вместе со щелочным раствором (также гидроксида кальция — гидроксид кальция мало растворим). Уравнение реакции любого из этих металлов будет таким: X(s) + 2H 2 O(l) X(OH) 2 (водный или s) + H 2 (g) Гидроксиды плохо растворимы, но они становятся более растворимыми по мере продвижения вниз по Группе. Образовавшийся гидроксид кальция проявляется в основном в виде белого осадка (хотя некоторые растворяются). Вы получаете меньше осадка по мере продвижения вниз по группе, потому что больше гидроксида растворяется в воде. Сводка динамики реактивности Металлы группы 2 становятся более реактивными по отношению к воде по мере продвижения вниз по группе. Объяснение тренда реактивности Бериллий в особом случае Существует дополнительная причина недостаточной реакционной способности бериллия по сравнению с остальной группой. Изменение энтальпии реакций Изменение энтальпии реакции является мерой количества тепла, поглощаемого или выделяемого при протекании реакции. Изменение энтальпии отрицательно, если тепло выделяется, и положительно, если оно поглощается. Это действительно все, что вам нужно знать об этом разделе! | ||
Примечание: Если вас не устраивают изменения энтальпии, вы можете изучить раздел энергетики Chemguide или мою книгу по химическим расчетам. | ||
Если вы рассчитаете изменение энтальпии возможных реакций между бериллием или магнием и паром, вы получите следующие ответы: Be(т) + H 2 O(г) BeO(т) + H 2 (г) ΔH = -369 кДж моль -1 Mg(s) + H 2 O(g) MgO(s) + H 2 (g) ΔH = -360 кДж моль -1 Обратите внимание, что обе возможные реакции сильно экзотермичны и выделяют почти одинаковое количество тепла. Точно так же, если вы рассчитаете изменения энтальпии для реакций между кальцием, стронцием или барием и холодной водой, вы снова обнаружите, что количество выделяемого тепла в каждом случае почти одинаково — в этом случае около -430 кДж моль -1 . Причина повышения реактивности должна опять быть в другом. Энергии активации реакций Энергия активации реакции – это минимальное количество энергии, необходимое для протекания реакции. Неважно, насколько экзотермической будет реакция, когда она начнется, — если существует высокий энергетический барьер активации, реакция будет происходить очень медленно, если вообще будет происходить. Когда металлы группы 2 реагируют с образованием оксидов или гидроксидов, образуются ионы металлов. | ||
Примечание: Это упрощение в случае бериллия.  Оксид бериллия не является полностью ионным. Между бериллием и кислородом недостаточно разницы в электроотрицательности, чтобы бериллий потерял контроль над связывающей парой электронов и образовал ионы. Подход, который мы используем здесь, соответствует типу ответа, который вы должны были бы дать на уровне A. Думать о бериллии как о совершенно другом случае сделало бы этот аргумент излишне сложным. Оксид бериллия не является полностью ионным. Между бериллием и кислородом недостаточно разницы в электроотрицательности, чтобы бериллий потерял контроль над связывающей парой электронов и образовал ионы. Подход, который мы используем здесь, соответствует типу ответа, который вы должны были бы дать на уровне A. Думать о бериллии как о совершенно другом случае сделало бы этот аргумент излишне сложным. | ||
Образование ионов из исходного металла включает в себя различные стадии, каждая из которых требует затрат энергии, что способствует увеличению энергии активации реакции. Эти этапы предполагают ввод:
После этого будет ряд стадий, которые снова выделяют тепло, что приводит к образованию продуктов и общим экзотермическим реакциям. На графике показано влияние этих важных стадий поглощения энергии по мере того, как вы спускаетесь в группу 2. Обратите внимание, что здесь доминируют энергии ионизации, особенно энергии второй ионизации. Энергии ионизации падают, когда вы спускаетесь по Группе. Поскольку становится легче образовывать ионы, реакции будут происходить быстрее. | ||
Примечание: Если вас не устраивает изменение энергии ионизации при переходе в группу 2, перейдите по этой ссылке. Вы найдете дополнительную ссылку на более широкое обсуждение энергии ионизации, если вам это нужно. | ||
Обобщая причину увеличения реактивности по мере спуска Группа Реакции становятся легче, поскольку энергия, необходимая для образования положительных ионов, падает. Это в основном связано с уменьшением энергии ионизации по мере продвижения вниз по Группе. Это приводит к более низким энергиям активации и, следовательно, более быстрым реакциям.
В меню группы 2 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: декабрь 2021 г.) | ||
Реакции элементов группы 2 с водой
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3676
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются реакции элементов группы 2 (бериллий, магний, кальций, стронций и барий) с водой с использованием этих реакций для описания тенденции реакционной способности в группе 2.
Бериллий
Бериллий вступает в реакцию с паром при высоких температурах (обычно около 700°C или выше) с образованием белого оксида бериллия и водорода.
\[ Be_{(s)} + H_2O_{(g)} \rightarrow BeO_{(s)} + H_{2(g)} \label{0}\]
Дополнительная причина отсутствия реакционной способности бериллия по сравнению с остальной частью группы. Бериллий имеет прочный стойкий слой оксида на своей поверхности, который снижает его реакционную способность при обычных температурах. Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает.
Магний
Магний сгорает в паре с образованием белого оксида магния и газообразного водорода.
\[ Mg_{(s)} + H_2O_{(g)} \rightarrow MgO_{(s)} + H_{2(g)} \label{1}\]
Очень чистая магниевая лента имеет мягкую реакцию с холодной водой, приведенной ниже. Через несколько минут на его поверхности образуются пузырьки газообразного водорода, а виток магниевой ленты обычно всплывает на поверхность. Однако реакция длится недолго, так как образующийся гидроксид магния почти нерастворим в воде и образует барьер для магния, препятствующий дальнейшей реакции.
Через несколько минут на его поверхности образуются пузырьки газообразного водорода, а виток магниевой ленты обычно всплывает на поверхность. Однако реакция длится недолго, так как образующийся гидроксид магния почти нерастворим в воде и образует барьер для магния, препятствующий дальнейшей реакции.
\[ Mg_{(s)} + 2H_2O_{(l)} \rightarrow Mg(OH)_{2(s)} + H_{2(g)} \label{2}\]
Как правило, при взаимодействии металла с холодной водой образуется гидроксид металла. Если он реагирует с паром, образуется оксид металла. Это связано с тем, что гидроксиды металлов термически разлагаются на оксид и воду.
Кальций, стронций и барий
Эти металлы реагируют с холодной водой с возрастающей энергией с образованием гидроксида металла и водорода. Стронций и барий имеют реакционную способность, аналогичную активности лития. Кальций, например, довольно бурно и экзотермически реагирует с холодной водой. Выделяются пузырьки газообразного водорода и образуется белый осадок (гидроксида кальция) вместе со щелочным раствором (также гидроксида кальция, который мало растворим в воде). Уравнение реакции любого из этих металлов было бы следующим:
Уравнение реакции любого из этих металлов было бы следующим:
\[ X_{(s)} + 2H_2O_{(l)} + X(OH) \rightarrow X(OH)_{2 (водн.\, или\, s)} + H_{2(g)} \ label{3}\]
Растворимость гидроксида увеличивается вниз по группе. Гидроксид кальция в основном выпадает в виде белого осадка (хотя некоторые растворяются). Меньше осадка образуется вниз по группе с увеличением растворимости.
Термодинамические свойства реакций
Изменение энтальпии реакции является мерой количества тепла, поглощаемого или выделяемого при протекании реакции. Изменение энтальпии отрицательно, если тепло выделяется, и положительно, если оно поглощается. Расчет изменения энтальпии возможных реакций между бериллием или магнием и паром дает следующие значения:
\[Be_{(s)} + H_2O_{(g)} \rightarrow BeO_{(s)} + H_{2(g)} \;\;\; \Дельта H = -369\; кДж/моль\]
\[Mg_{(тв)} + H_2O_{(г)} \rightarrow MgO_{(тв)} + H_{2(г)} \;\;\; \Дельта H = -360\; кДж/моль \]
Обратите внимание, что обе возможные реакции сильно экзотермичны и выделяют почти одинаковое количество тепла. Однако на самом деле происходит только реакция магния. Объяснение различной реактивности должно лежать где-то еще. Точно так же расчет изменений энтальпии для реакций между кальцием, стронцием или барием и холодной водой показывает, что количество тепла, выделяющегося в каждом случае, почти одинаково — около -430 кДж моль -1 . Причина повышения реактивности должна опять быть в другом.
Однако на самом деле происходит только реакция магния. Объяснение различной реактивности должно лежать где-то еще. Точно так же расчет изменений энтальпии для реакций между кальцием, стронцием или барием и холодной водой показывает, что количество тепла, выделяющегося в каждом случае, почти одинаково — около -430 кДж моль -1 . Причина повышения реактивности должна опять быть в другом.
Кинетические свойства реакций
Энергия активации реакции – это минимальное количество энергии, необходимое для протекания реакции. Неважно, насколько экзотермической будет реакция, когда она начнется, — если существует высокий энергетический барьер активации, реакция будет происходить очень медленно, если вообще будет происходить. Когда металлы группы 2 реагируют с образованием оксидов или гидроксидов, образуются ионы металлов. Образование ионов из исходного металла включает в себя различные стадии, каждая из которых требует затрат энергии, что способствует увеличению энергии активации реакции. Эти этапы включают ввод:
Эти этапы включают ввод:
- энергия атомизации металла. Это энергия, необходимая для разрыва связей, удерживающих атомы вместе в металлической решетке.
- первая + вторая энергии ионизации. Они необходимы для превращения атомов металла в ионы с зарядом 2+.
После этого будет ряд стадий, которые снова выделяют тепло, что приводит к образованию продуктов и общим экзотермическим реакциям. На графике показано влияние этих важных стадий поглощения энергии по мере того, как вы спускаетесь в группу 2.
Обратите внимание, что здесь доминируют энергии ионизации, особенно энергии второй ионизации. Энергии ионизации падают по группе. Поскольку становится легче образовывать ионы, реакции будут происходить быстрее.
Подведение итогов по увеличению реакционной способности
Реакции элементов группы 2 протекают легче, поскольку энергия, необходимая для образования положительных ионов, падает. В основном это связано с уменьшением энергии ионизации вниз по группе.


 Через несколько минут на его поверхности образуются пузырьки водорода, а виток магниевой ленты обычно всплывает на поверхность. Однако реакция вскоре останавливается, так как образующийся гидроксид магния почти нерастворим в воде и образует барьер для магния, препятствующий дальнейшей реакции.
Через несколько минут на его поверхности образуются пузырьки водорода, а виток магниевой ленты обычно всплывает на поверхность. Однако реакция вскоре останавливается, так как образующийся гидроксид магния почти нерастворим в воде и образует барьер для магния, препятствующий дальнейшей реакции.
 Бериллий имеет прочный стойкий слой оксида на своей поверхности, который снижает его реакционную способность при обычных температурах. Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает.
Бериллий имеет прочный стойкий слой оксида на своей поверхности, который снижает его реакционную способность при обычных температурах. Однако оксидный слой разрушается при температуре выше 750 °C и обнажает поверхность металлического бериллия под ним, и поэтому защита не работает. Однако реакция магния протекает намного быстрее. Объяснение различной реактивности должно лежать где-то еще.
Однако реакция магния протекает намного быстрее. Объяснение различной реактивности должно лежать где-то еще.