Урок по химии на тему «Химические свойства щелочей и нерастворимых оснований»
Тема: химические свойства щелочей и нерастворимых оснований
Тип урока: урок-обобщение
Формы урока индивидуально — групповая
Методы проблемного обучения, частично — поисковый
Цель урока: обобщить и систематизировать знания уч-ся о свойствах оснований
Образовательные
1. обобщить знания о свойствах оснований
2. актуализировать ранее полученные знания учащихся о составе и свойствах органических и неорганических оснований;
3. используя метод химического эксперимента, закрепить знания учащихся о свойствах оснований;
Развивающие
1. развивать практические умения и навыки учащихся
2. развивать умение осуществлять деятельность на уроке;
Воспитательные
1. воспитывать умение работать коллективно (в парах), оценивать свои возможности и знания.
Оборудование: компьютер, проектор, презентация, лабораторная посуда,
Реактивы.
ХОД УРОКА.
1. Организационный момент
Определить класс соединений
Каустическая сода
Гашенная известь
Баритовая вода
.
Сегодня на уроке нам предстоит еще раз убедиться, что химия многолика, но прежде обратите внимание на экран перед вами Картина художника Абрама Архипова «Прачки» .Обратите внимание на руки этих женщин-красные, опухшие, с жесткой, нездоровой кожей -результат ежедневного действия горячего раствора мыла. ( Мыло легко гидролизуется водой .особенно горячей при этом выделяется щелочь, вредная для кожи человека)
Что это за вещества и к какому классу они относятся? (Щелочи, класс Основания ).
• Какого плана мы обычно придерживаемся, изучая вещества?
1. Общая формула и строение молекулы
2. классификация
3. физические свойства
4. химические свойства
5. применение
Изучив классификацию, каков цель нашего урока
Тема урока «свойства щелочей и нерастворимых оснований»
Цель урока исследовать свойства щелочи как класса оснований
«Чтобы познать ,нужно научиться наблюдать»
Опыт №1. Каждой группе даны З
неподписанные пробирки с бесцветными жидкостями. При помощи индикатора (лакмус
– 1 группа, фенолфталеин – 2 группа, метилоранж – 3 группа) определите
в какой пробирке вода, в какой раствор щелочи, а в какой кислота? Соблюдая
инструктаж по технике безопасности, проведите эти работы, проанализируйте
результат, используя таблицу окраски индикаторов в зависимости от среды, и
сделайте выводы.
Каждой группе даны З
неподписанные пробирки с бесцветными жидкостями. При помощи индикатора (лакмус
– 1 группа, фенолфталеин – 2 группа, метилоранж – 3 группа) определите
в какой пробирке вода, в какой раствор щелочи, а в какой кислота? Соблюдая
инструктаж по технике безопасности, проведите эти работы, проанализируйте
результат, используя таблицу окраски индикаторов в зависимости от среды, и
сделайте выводы.
Проведя опыт, вы увидели, что растворимые основания изменяют окраску индикаторов. А как вы думаете, нерастворимые основания обладают таким свойством?
У вас на столе есть реактивы, с помощью которых вы можете получить нерастворимое основание. каждой группы реактивы для получения разных нерастворимых оснований. С помощью какой реакции вы будете получать данные основания?
Опыт №2. Получение А(OH)3 ,Cu(OH)2, Fe(OH)2 и изучения их влияния на индикаторы.
Учащиеся делают выводы о том, что
изменения окраски индикаторов не произошло, так как нерастворимые основания не
диссициируют с образованием гидроксид-ионов.
• Взаимодействие с кислотами
Опыт№3
Опытным путем докажите, что все основания взаимодействуют с кислотами. Для этого:
а) к подкрашенному фенолфталеином раствору NaOH добавьте HCl.
б) полученный вами осадок нерастворимого основания разделите на 3 части,
затем к одной добавьте HCl.
Сделайте выводы.
NaOH +2 HCl→ 2NaCl+ H2O
Cu(OH)2 +2HCl→ CuCl2+2H2O
Cu(OH)2 + HCl→ CuOHCl + H2O
Органические основания также взаимодействуют с кислотами.
(Демонстрация видеоролика «Растворение анилина в воде», «Взаимодействие анилина с соляной кислотой»; )
Демонстрация опыт «Дым без огня»
• Взаимодействие с кислотными оксидами
Опытным путем получить углекислый газ из имеющих реактивов пропустить этот газ через известковую воду
Что наблюдаете? (Результат — помутнение раствора, следовательно, основания взаимодействуют с кислотными оксидами , продолжаем пропускать углекислый газ до исчезновения осадка
Ca(OH)2 +CO2→ CaCO3 + H2O
Ca(OH)2 +CO2+H2 O→ Ca(HCO)2
Объясняем понятия «избыток» и
«недостаток» при образовании солей многоосновных кислот. Это
необходимо при решении расчетных задач
Это
необходимо при решении расчетных задач
Опыт Взаимодействие растворимых оснований с амфотерными основаниями
Продукты образуются разные: все зависит от условий
2KOH(тв)+ZnO(тв)cпекан→K2ZnO2 +H2 O
2KOH(р-р)+Zn(OH)2 → K2[Zn(OH)4](комплексная соль)
KOH(тв)+Al(OH)3 спекан→ KAlO2+H2 O
Опыт К нерастворимому основанию прилить щелочи
KOH(р-р) +Al(OH)3→K[Al(OH)4](комплексная соль)
Взаимодействие с солями
Растворимые основания взаимодействуют с солями. Вы уже проводили данный опыт во время урока. Вспомните, где вы использовали данное
• Разложение нерастворимых оснований при нагревании
Опыт №4. Поместите часть нерастворимого
основания в фарфоровую чашку и нагрейте на спиртовке. Сделайте выводы по итогам
наблюдения.
Сделайте выводы по итогам
наблюдения.
Cu(OH)2→CuO+H2O
Органические основания- амины ,гетероциклические соединения
Что такое амины?
Расположите в порядке усиления основных свойств
CH3 NH2 > NH3 > C6H5 NH2
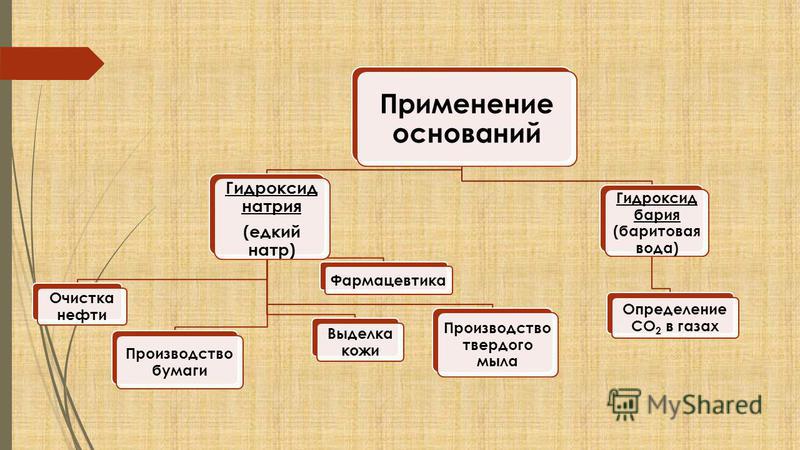
Практическое значение оснований
1) Гидроксид натрия. Что за вещество
скрывается под названиями «алкаль», «едкая щелочная соль»,
«каустик», «каустическая сода»? Так называли в разные
времена в России гидроксид натрия. До сих про сохранилось его старое название –
едкий натр, предложенное еще в 1807 году русским химиком Александром Ивановичем
Шерером.. В быту гидроксид натрия именуют каустической содой, хотя к соде
отношения он не имеет. Уж лучше его просто называть «каустиком» (от
греческого «каустикос» – жгучий, едкий). Раствор и кристаллы очень
опасны в обращении: при попадании в пищевод человека всего 0,01–0,02г наступает
смерть впервые же часы или сутки. На коже он вызывает глубокие и долго
незаживающие ожоги. Также гидроксид натрия применяют в производстве мыла, в
кожевенной промышленности и в фармацевтике, в производстве бумаги.
На коже он вызывает глубокие и долго
незаживающие ожоги. Также гидроксид натрия применяют в производстве мыла, в
кожевенной промышленности и в фармацевтике, в производстве бумаги.
2) Гидроксид калия. Называют «едкое кали» по аналогии с гидроксидом натрия. Используется при «варке» тугоплавкого стекла, производстве бумаги, жидкого мыла.
3) Гидроксид кальция. В технической
литературе и в быту часто встречаются такие названия веществ:
«воздушная», или «негашеная известь», «известковое
молоко», «известковая вода». Негашеная известь – это оксид
кальция, получаемый при обжиге мела; гашеная известь – это гидроксид кальция,
получаемый при обработке оксида кальция водой. Этот процесс протекает с большим
выделением теплоты. Известковое молоко – суспензия гидроксида кальция в воде,
применяемая для побелки потолков, стен, стволов деревьев по весне для защиты от
обморожений и вредных насекомых. Оксид кальция можно использовать для
простейшей химической грелки: два пакетика, один большой, другой – маленький,
из водонепроницаемого и химически стойкого материала. Чтобы грелка заработала,
заполняют негашеной известью маленький пакет и добавляют в него немного воды.
Потом пакет тщательно закрывают, вставляют в большой и еще раз закупоривают.
Грелка готова. Гидроксид кальция входит в состав «бордосской
жидкости» в смеси с медным купоросом для борьбы с возбудителями грибковых
заболеваний плодовых, овощных и декоративных культур. Применяется для
распознавания углекислого газа.
Чтобы грелка заработала,
заполняют негашеной известью маленький пакет и добавляют в него немного воды.
Потом пакет тщательно закрывают, вставляют в большой и еще раз закупоривают.
Грелка готова. Гидроксид кальция входит в состав «бордосской
жидкости» в смеси с медным купоросом для борьбы с возбудителями грибковых
заболеваний плодовых, овощных и декоративных культур. Применяется для
распознавания углекислого газа.
4) Гидроксид бария. Гидроксид бария – «баритовая вода» – применяют для качественного и количественного определения содержания углекислого газа в газах.
5) Раствор аммиака – в медицине
6) Анилин – для производства красок
4. Закрепление. Тестирования , включая задания ЕГЭ
1.Установите
соответствие между реагирующими веществами реакции и продуктами,
которые преимущественно образуются при взаимодействии этих веществ:
к каждой позиции, обозначенной буквой. Подберите соответствующую позицию,
обозначенную цифрой.
Реагирующие вещества продукты реакции
А)Al(OH)3 И
H 2SO4 1)Al2(SO)4 И H2
Б)Al(OH)3 NaOH 2)Al2(SO)4 И H2O
В)Al(OH)3 NaOH 3)NaAlO2 И H2
Г)Al(OH)3 4)NaAlO2 И H2 O
5) Na[Al(OH)4]
6) Al2 O3 И H2O
Запишите в таблицу выбранные цифры под соответствующими буквами
Ответ:
А | Б | В | Г |
|
|
|
|
2. Установите соответствие между реагирующими веществами
реакции и продуктами, которые преимущественно
образуются при взаимодействии этих веществ: к каждой позиции,
обозначенной буквой. Подберите соответствующую позицию, обозначенную
цифрой.
Установите соответствие между реагирующими веществами
реакции и продуктами, которые преимущественно
образуются при взаимодействии этих веществ: к каждой позиции,
обозначенной буквой. Подберите соответствующую позицию, обозначенную
цифрой.
Реагирующие вещества продукты реакции
А) CO2 H2O 1) CaCO3
Б) CO2 CaO 2) CaCO3 H2O
В) CO2 Ca(OH)2 (изб.) 3) Ca(HCO3)2
Г) CO2 (изб.)) Ca(OH)2 4) Ca(HCO3)2 H2O
5) CO2 H2
6) H2CO3
А | Б | В | Г |
|
|
|
|
3. Установите соответствие
между реагирующими веществами реакции и продуктами, которые
преимущественно образуются при взаимодействии этих веществ: к каждой
позиции, обозначенной буквой. Подберите соответствующую позицию,
обозначенную цифрой .
Установите соответствие
между реагирующими веществами реакции и продуктами, которые
преимущественно образуются при взаимодействии этих веществ: к каждой
позиции, обозначенной буквой. Подберите соответствующую позицию,
обозначенную цифрой .
Реагирующие вещества продукты реакции
А)KOH и SO2(изб.) 1)KHSO4
Б)KOH и SO3(изб) 2)K2SO4
В)KOH(изб.) И CO2 3)K2CO3 и H2O
Г)KOH+ CO2(изб) 4)K2SO4 и H2O
5)KHCO
6)KHSO3
Запишите в таблицу выбранные цифры под соответствующими буквами
А | Б | В | Г |
|
|
|
|
4
В раствор с веществом X
добавили раствор щелочи Y. в результате
наблюдали выделение осадка бурого цвета. Из предложенного перечня выберите
вещества X и Y,
могут вступать в описанную реакцию/
в результате
наблюдали выделение осадка бурого цвета. Из предложенного перечня выберите
вещества X и Y,
могут вступать в описанную реакцию/
1) Нитрат железа(2)
2) Гидроксид магния
3) Сульфат железа(2)
4) Гидроксид натрия
5) Серная кислота
5. Из предложенного перечня выберите два оксида, каждый из которых со щелочами не реагирует.
1) SiO2
2) CrO3
3) NO
4) ZnO
5) MgO
6. Из предложенного перечня выберите два вещества, с каждым из которых может взаимодействовать метиламин.
1)метан 4)бензол
2)гидроксид бария 5) хлорноватистая кислота
3)вода
7. Установите
соответствие между реагирующими веществами реакции и продуктами,
которые преимущественно образуются при взаимодействии этих веществ:
к каждой позиции, обозначенной буквой. Подберите соответствующую позицию,
обозначенную цифрой.
Реагирующие вещества Продукты реакции
А) Zn(OH)2 и KOH(сплавление) 1) Zn(NO3)2 и H2
Б) Zn(OH)2 и KOH(р-р) 2) Zn(NO3)2 и H2O
В) Zn(OH)2 и HNO3 3) K2 ZnO2 и H2O
Г) Zn(OH)2(нагревание) 4) K2[Zn(OH)4]
5) ZnO и H2
6) ZnO и H2O
5. Домашнее задание.
• Параграф 21
**(опережающее задание, из сборника ЕГЭ)Задача:
При сжигании 1,4г органического вещества образовалось 1,8г воды, 4,4г оксида
углерода(4). Выведите молекулярную формулу вещества, зная, что его
относительная плотность по воздуху равна 0,97.
Выведите молекулярную формулу вещества, зная, что его
относительная плотность по воздуху равна 0,97.
6.Рефлексия
1.я узнал(а) много нового
2. мне это пригодится в жизни.
3. на уроке было над чем подумать.
4. на уроке я работал(а) добросовестно и цели достиг(ла).
5.на все вопросы, возникшие в ходе урока, я получила ответ.
Основания
Цели:
Обучающие – познакомить с понятием основание, способами получения, классификацией, свойствами и применением, указать связь оснований с другими классами неорганических соединений.
Развивающие – развить умения и навыки работы с лабораторным оборудованием и химическими реактивами, правильно оформлять результаты опытов и делать соответствующие выводы; умение составлять уравнения реакций, подтверждающих свойства оснований; развивать умение наблюдать делать выводы.
Воспитательные – формирование
всесторонне развитой личности. Воспитание
культуры общения в парах “ученик – учитель”,
“ученик – ученик”. Воспитание общечеловеческих
ценностей, соблюдение моральных норм (честность,
порядочность, ответственность).
Воспитание
культуры общения в парах “ученик – учитель”,
“ученик – ученик”. Воспитание общечеловеческих
ценностей, соблюдение моральных норм (честность,
порядочность, ответственность).
Методы и методические приемы. Фронтальная беседа, самостоятельная работа с тестами, химические диктанты, взаимопроверка результатов химических диктантов, работа с карточками, выполнение лабораторной работы в парах, демонстрация опытов, разбор проблемных ситуаций.
Оборудование и реактивы. Кодоскоп, карточки с тестами для самостоятельной работы “Классы неорганических соединений”.
На демонстрационном столе: кристаллизатор, вода, индикаторы (фенолфталеин), спиртовка, спички, кусочки натрия на фильтровальной бумаге, пинцет, держатель пробирки, гидроксид меди (безв.).
На столах учащихся: инструкция по технике
безопасности, учебник “Химия – 8 класс”,
лабораторные штативы с пробирками.
Ход урока.
Ориентировочно – мотивационный.
Графический диктант.
Исторические сведения.
Сообщение ученика (дополнительная работа).
Первым основанием, с которым человек встретился в древности, был гидроксид кальция. Причины тут простые. Использовать огонь люди научились примерно 100 тысяч лет назад. Карбонат кальция в виде мела, известняка или мрамора встречается практически повсеместно. При прокаливании он разлагался, образуя оксид кальция, который весьма энергично соединялся с водой. Составив все эти факты, нетрудно представить, каким образом первобытный человек познакомился с первым основанием. Смесь дробленого камня, песка и извести применялась еще 2000 лет назад в качестве бетона.
Значительно позднее (примерно IX – X в.в.) человек
познакомился с гидроксидами натрия и кальция.
Так как они разъедали кожу, их назвали едкими
щелочами. (Рисунок 1).
(Рисунок 1).
Щелочи долгое время считались простыми веществами, так как их не могли разложить на составные части и считали, что щелочи – “основные элементы”, из которых состоят другие вещества. Этим же объясняется и данное позднее название “основания” для гидроксидов металлов. Сам термин основание ввел французский химик Г. Руэль в 1744 году.
Учитель. Сегодня ребята мы должны рассмотреть еще один класс неорганических соединений — основания.
На Кодоскопе: NaOH, KOH, Ca(OH), Mg(OH), Fe(OH), Al(OH). Что общего в формулах этих соединений и чем они отличаются?
Учащиеся отвечают, что во всех этих формулах присутствует ОН - группа (учитель подсказывает, что эта группа называется гидроксогруппой). После обсуждений формулируют определение оснований.
Основания – это сложные вещества,
состоящие из ионов металлов и связанных с ними
одной или нескольких гидроксогрупп.
Учитель подчеркивает, названия оснований складываются из слов “гидроксид” и названия элемента в родительном падеже. Если элемент имеет переменную валентность, она указывается в скобках после названия: Fe (OH) — гидроксид железа (III).
Графические формулы оснований: NaOH; Na-O-H.
И основания, и кислоты, содержащие кислород, относятся к общей группе “гидроксиды”. Однако, когда говорят “гидроксид”, чаще всего подразумевают основания.
В таблице №1 приводятся тривиальные названия оснований.
Физические свойства оснований.
Лабораторная работа №1.
В данной работе учащиеся описывают внешний вид
и агрегатное состояние оснований, определяют
растворимость их в воде. Обобщают физические
свойства (можно воспользоваться справочными
данными таблицы №2). Учащиеся, к каждому
из выданных образцов оснований, добавляют по
несколько капель воды и делают вывод, что одни из
них растворяются, другие – нет (обязательное
соблюдение ТБ).
Учитель. Таким образом, основания бывают растворимые и нерастворимые. Учитель поясняет, что растворимые в воде основания называются щелочами. Растворы щелочей мыльные на ощупь, разъедают кожу, ткань, шерсть и т.д. В связи с этим их называют едкими щелочами.
Демонстрационный опыт, подтверждающий действие щелочей на органические вещества.
Лабораторная работа №2.
Учащиеся проводят лабораторный опыт по определению реакции среды в растворах щелочей с помощью индикаторов. Проверяют, изменяется ли окраска фенолфталеина в гидроксиде меди (II). Делают вывод: в растворах щелочей индикаторы изменяют окраску, а в нерастворимых основаниях – нет.
Учитель объясняет способы получения оснований (информация записана на кодоскопе). Каждое уравнение подтверждают демонстрационными опытами.
Получение щелочей:
а) взаимодействие щелочей и щелочноземельных металлов с водой – образуется щелочь и водород:
2К + 2НО 2КОН + Н
Са + 2НОСа(ОН)+Н
б) взаимодействие основных оксидов с водой:
КО+НО2КОН
Учитель. Каким способом можно
получить нерастворимые основания, например Сu(ОН)?
Каким способом можно
получить нерастворимые основания, например Сu(ОН)?
Лабораторная работа №3.
Учащиеся в лабораторной работе №3 пытаются получить гидроксид меди (II) различными способами (медь с водой, оксид меди (II) с водой – реакция не идет). Также способы не подходят. Как же быть?
Учитель помогает или объясняет, что нерастворимые основания можно получить только косвенным путем:
СuSO+ 2NaOHCu(OH)+NaSO
Учащиеся в ходе работы получают нерастворимые основания из соответствующих солей.
Применение гидроксидов.
Гидроксид лития служит важным компонентом электролитов в щелочных аккумуляторах, удлиняя срок службы в 2-3 раза и существен повышая их емкость. На подводных лодках и космических кораблях гидроксид лития поглощает углекислый газ, выдыхаемый людьми.
Гидроксид натрия, известный в технике под
названием каустика, применяется в больших
количествах для производства мыла, стекла,
красок, при обработке целлюлозы и очистке масел и
керосина от жиров. Много расходуется его при
мытье посуды на масло- и молокозаводах, поскольку
каустик легко разлагает жир. (Рисунок 2).
Много расходуется его при
мытье посуды на масло- и молокозаводах, поскольку
каустик легко разлагает жир. (Рисунок 2).
Гидроксид калия, рубидия и цезия, используется в качестве добавок в электролиты низкотемпературных щелочных аккумуляторов, а также как катализаторы в органическом синтезе.
Гидроксид кальция – важнейший строительный материал. Мировое производство данного оксида исчисляется десятками миллионов тонн в год. Смесь гашеной извести с песком служит прекрасным строительным раствором, которым скрепляют кирпичи, камни, блоки, штукатурят потолки и стены. В больших количествах гидроксид кальция расходуется на производство хлорной извести, служащей дезинфектором в санитарии.
Гидроксид алюминия в виде природного
минерала гидраргилита входит в состав многих
бокситов и служит сырьем для получения оксида
алюминия, из которого в свою очередь, производят
металлический алюминий. Поскольку последний
получают в огромных количествах, то мировое
производство оксида алюминия из бокситов
составляет в настоящее время около 100 млн.т. в год
Поскольку последний
получают в огромных количествах, то мировое
производство оксида алюминия из бокситов
составляет в настоящее время около 100 млн.т. в год
Гидроксид железа (III) распространенный природный минерал, важная составная часть железных руд. В кристаллическом состоянии это порошок светло- желто цвета с приятным оттенком. Используется как сырье в производстве чугуна и стали. Кроме того, под названием “охра” он применяется как самый дешевый и химически устойчивы пигмент для изготовления художественных и малярных красок, грунтовок, шпатлевок.
Применяется как катализатор и как компонент поглотительной массы при очистке промышленных газов.
Гидроксид хрома (III) в момент образования
представляет собой серо- синий порошок. При
укрупнении кристаллов он приобретает изумрудно-
зеленый цвет и химическую стойкость, так как
превращается в сложный полимер. Применяется в
качестве пигмента в изготовлении художественных
красок зеленого цвета.
Закрепление.
Учащиеся получают карточки с заданиями “Основания. Химические свойства воды” (4 варианта заданий).
Вариант 1.
- Составьте уравнения реакций взаимодействия с водой следующих веществ: лития, кальция, оксида бария. Укажите названия веществ, образующихся в результате реакций.
- Из числа приведенных ниже формул веществ выпишите формулы оснований и назовите их: СаСО, КОН, НSО, СиО, NaO, Ba (OH), KS, Fe(OH), NaOH.
Вариант 2.
- Составьте уравнения реакций взаимодействия с водой следующих веществ: натрия, оксида калия, оксида кальция. Укажите названия веществ, образующихся в результате реакций.
- Из числа приведенных ниже формул веществ
выпишите формулы нерастворимых в воде оснований
и назовите их: HNO, SO,
NaOH, Pb (OH), FeO, PО, ВоSО, Ca (OH), NaCI, Fe(OH).

Вариант 3.
- Составьте уравнения реакций взаимодействия с водой следующих веществ: калия, кальция, оксида лития. Укажите названия веществ, образующихся в результате реакций.
- Из числа приведенных ниже формул веществ выпишите формулы нерастворимых в воде оснований и назовите их: NaSO, CaO, Ca (OH), ZnO, NaOH, HCI, CuO, AI (OH), KOH, NaO, KCO, Ba (OH).
Вариант 4.
- Составьте уравнения реакций взаимодействия с водой следующих веществ: бария, оксида кальция, оксида натрия. Укажите названия веществ, образующихся в результате реакций:
- Из числа приведенных ниже формул веществ выпишите формулы нерастворимых в воде оснований и назовите их: MgO, Ca (OH),BaO, НSО,CO, Cи (OH), PО, LiOH., KNO, Fe(OH).
Таблица №1. Тривиальные названия
оснований.
Тривиальные названия
оснований.
| Химическая формула веществ | Условия, при которых вещество имеет традиционное название | Тривиальное (историческое) название |
Современное название | Применение вещества |
| Ba (OH) | Раствор, содержащий 38г вещества в 1л воды при 20 градусов С | Баритовая вода | Раствор гидроксида бария | Химический реагент |
| Ca (OH) | Раствор, содержащий 1,56г вещества в 1л воды при 20 градусах С | Известковая вода | Раствор гидроксида кальция | Реагент на оксид углерода (IV) |
| Ca (OH) | В твердом виде | Пушонка (гашеная известь) |
Гидроксид кальция | В строительстве |
| Na (OH) | Обычные | Едкий натрий | Гидроксид натрия | Производство мыла, в аккумуляторах |
| K (OH) | Обычные | Едкий калий | Гидроксид калия | Производство химических |
| NH HO | Раствор аммиака в воде | Аммиачная вода (нашатырный спирт) | Гидроксид аммония | Подкормка в сельском хозяйстве |
Таблица№2. Состав и некоторые
свойства щелочей.
Состав и некоторые
свойства щелочей.
| Формула | Плотность Кг/м |
Температура плавления, С | Растворимость г/л воды | Устойчивые гидраты |
| LiOH NaOH KOH RbOH CsOH FrOH Ca(OH) Sr(OH) Ba(OH) |
1430 2130 2120 3200 3675 — 2240 3625 4500 |
471 3200 361 301 272 — Разлагается 375 408 — |
124 1090 1120 1900 4000 — 1,65 8,2 38,0 — |
LiOH *HO NaOH*HO KOH*2HO RbOH*2HO CsOH*HO Сходен с CsOH Ca(OH) Sr(OH)*8 HO Ba(OH)*8HO |
Графический диктант «Оксиды. Простые
и сложные вещества».
Простые
и сложные вещества».
Знаками «+» и «-» отмечается, характерно ли данное утверждение (1-10) для указанного варианта.
Вариант 1. Основные оксиды.
Вариант 2. Кислотные оксиды.
Утверждения:
- Оксиды, которым соответствуют основания.
- Оксиды, образуемые неметаллами и металлами, проявляющими высшие степени окисления.
- Оксид, водный раствор которого окрашивает индикатор метилоранж в красный цвет.
- Оксиды, которым соответствуют кислоты.
- Оксиды, образующиеся при горение металлов.
- Оксид, образующийся при горении угля.
- Оксид, дающий при взаимодействии с кислотой соль и воду.
- Нерастворимые в воде карбонаты разлагаются на углекислый газ и на соответствующий оксид.
- Какие оксиды при растворение в воде окрашивают фенолфталеин в малиновый цвет.
- Оксид, дающий при взаимодействии с основаниями
соль и воду.

Рисунок 1, 2.
Barite (Baryte)- Использование, свойства, химическая формула, цена, роза
- БАРИТ. Использование барита
- Барит Цена и доступность
Барит или барит представляет собой минерал, содержащий сульфат бария. Его название первоначально произошло от греческого слова «барыс», что означает «тяжелый». Этот минерал принадлежит к группе минералов барита вместе с англезитом, целестином и ангидритом. Имеет довольно красивый внешний вид. Эта минеральная руда также известна как тяжелый шпат, баритин, шверспат, баритит и барит. Это основной источник бария. Агрегаты барита и песка называют розовой породой, которая кажется красноватой из-за содержания в ней железа. Он широко известен как баритовая роза.
Барит Отличительная характеристика
Необычайно высокий удельный вес этого светлого минерала является главной отличительной чертой. Его также можно определить по нерастворимости в кислоте. Его можно отличить от ангидрита и целестита по оранжевой флуоресценции и зеленому пламени, которое появляется при испытаниях пламенем. Его кристаллическая форма, расщепление и отсутствие флуоресценции флюорита отличают его от флюоритов.
Его кристаллическая форма, расщепление и отсутствие флуоресценции флюорита отличают его от флюоритов.
Барит Состав
Этот минерал сульфата бария содержит:
Оксид бария (BAO): 65,7%
Триоксид серы 3 ): 34,3%
Картина 1 — Barite
Barite. БаСО
4 .Барит Свойства
Вот некоторые основные свойства этого материала:
Внешний вид: Он имеет вид прозрачных кристаллов.
Цвет: Цвет может варьироваться от бесцветного до белого и светлых оттенков желтого, синего, коричневого и серого.
Молекулярная масса: Молекулярная масса этого материала составляет 233,4 грамма на моль.
Плотность: Плотность барита 4,48 г/см 3 .
Растворимость: Практически нерастворим в воде.
Кристаллическая система: Имеет орторомбическую кристаллическую систему.
Кристалл Габитус: Пластинчатый, параллельный основанию, волокнистый, узловатый до массивного
Излом: Неправильный и неравномерный излом.
Твердость: Твердость этого минерала составляет от 3 до 3,5 по шкале Мооса.
Блеск: Кристаллы барита имеют стеклянный перламутровый блеск.
Удельный вес: Удельный вес барита находится где-то между 4,3 и 5.
Полоса: Имеет белые полосы.
Прочность: Прочность этого кристаллического минерала хрупка.
Прозрачность: Прозрачность от прозрачной до непрозрачной.
Оптические свойства: Биаксиальный положительный
Показатель преломления: nα = 1,634–1,637; nβ = 1,636–1,638; nγ = 1,646–1,648
Двулучепреломление: 0,012
Плавкость: Плавкость 4. Образует желтовато-зеленое пламя бария.
Местонахождение и добыча баритовой минеральной руды
Встречается в различных средах осадконакопления, отлагаясь в результате ряда процессов, таких как гидротермальный, биогенный и испарительный. Барит обычно встречается в месторождениях горячих источников и свинцово-цинковых жилах известняка. Часто встречается вместе с гематитовой рудой. Этот минерал также был обнаружен в метеоритах.
Он встречается в различных регионах США, включая Чешир в Коннектикуте, Де Калб в Нью-Йорке, Нью-Мексико, Теннесси, Джорджию, Северную Каролину, Неваду, Вирджинию, Миссури и Кентукки. Барит встречается в Байя-Спри в Румынии, Уэстморленде, Корнуолле, Камберленде, Дербишире, Дареме, Пертшире и Суррее в Великобритании, а также в Индии, Китае, Перу, Канаде, Марокко, Турции, Ирландии, Таиланде, Иране, Греции и Бразилии. Встречается в горах Барбертон в Южной Африке.
Ведущими странами-производителями барита являются (производство в тысячах тонн, в 2010 г.):
- Китай (3600)
- Индия (1000)
- США (670)
- Марокко (460)
- Иран (250)
- Турция (150)
- Казахстан (100)
Сопутствующие минералы барита
Этот сульфатный минерал часто ассоциируется с другими минералами, такими как англезит и целестин.
Использование барита
Эта минеральная руда имеет множество важных промышленных и коммерческих применений, таких как:
- Основное количество (77%) всего найденного барита используется в качестве утяжелителя для буровых растворов. Немагнитные свойства этого материала делают его более полезным для этой цели, поскольку он не мешает магнитным измерениям скважины в течение всего процесса.
- Синий, черный, серый или коричневый Барит широко используется для бурения нефтяных скважин. Подходящий цвет барита выбирается в зависимости от рудного тела.
- Это основная руда металлического бария.
- Также используется в качестве наполнителя для красок и пластмасс.
- Применяется для шумоизоляции в различных моторных отсеках.
- Этот минерал используется для изготовления гладкого и устойчивого к коррозии покрытия грузовых и легковых автомобилей.
- Используется в радиационно-защитных цементах и стеклокерамике.

- Этот минерал также имеет медицинское применение. Он используется для бариевой муки или серии исследований верхних отделов желудочно-кишечного тракта перед проведением компьютерной томографии с контрастом.
- Этот минерал использовался для производства гидроксида бария для целей очистки сахара.
- Исторически он также использовался в качестве пигмента для бумаги, текстиля и красок.
Барит Цена и наличие
По всему миру существует множество поставщиков минерального барита. Эти кристаллы также доступны онлайн. Цена изделия зависит от объема обработки.
Барит считается одним из наиболее полезных минералов, имеющих различные промышленные применения. Его широкая доступность делает его более подходящим для различных целей.
Ссылки:
http://www.answers.com/topic/barite
http://www.mindat.org/min-549.html
http://www.galleries.com/ Барит
http://geology.com/minerals/barite.shtml
http://www. handbookofmineralogy.org/pdfs/baryte.pdf
handbookofmineralogy.org/pdfs/baryte.pdf
Барит в буровом растворе Свойства и формула
В Калифорнии барит впервые был использован в скважине, которую повторно бурили с помощью тросовых инструментов в 1923 году. Согласно отчету, плотность бурового раствора была увеличена до 90 фунтов/фут3 (1,44 г/см3) для контроля притока газа и перестань карабкаться. Здесь, в этой статье, мы обсудим основные знания, которые инженеры по бурению и инженеры по буровым растворам должны знать о барите в буровом растворе / жидкости и его формуле увеличения веса. (См. также: Индикация проблем и предотвращение оседания барита )
Применение барита в буровом растворе
Барит (сульфат бария, BaSO 4 ) содержит 58,8 % бария и имеет удельный вес (4,2–4,5). Барит, используемый в буровом растворе, который обычно является нечистым, имеет более низкий удельный вес, поскольку он содержит другие минералы, такие как кварц , кремний , кальцит , ангидрит , целестит и различные силикаты. Кроме того, он состоит из других минералов железа, некоторые из которых могут увеличивать средний удельный вес продукта. Барит физически не растворяется в воде и не вступает в химические реакции с другими реагентами бурового раствора.
Кроме того, он состоит из других минералов железа, некоторые из которых могут увеличивать средний удельный вес продукта. Барит физически не растворяется в воде и не вступает в химические реакции с другими реагентами бурового раствора.
Как правило, барит используется для повышения плотности буровых растворов на водной основе и на нефтяной основе до 22 фунтов на галлон (2,64 удельного веса). Барит также используется для утяжеления глушильных растворов и в рецептуре баритовой запорной пробки.
Физические свойства барита
Барит представляет собой инертный твердый утяжелитель, который не вступает в реакцию с добавками бурового раствора или выбуренными загрязнителями.
- Внешний вид: Порошок
- Цвет: Светло-коричневый/Розовый/Серый
- Запах: Отсутствует
- Удельный вес: от 4,20 до 4,27
- Молекулярный вес (г/моль): 233,4
- Температура воспламенения: 1580°C
- Растворимость: Нерастворим в воде барита разработала препарат временной пробки высокой плотности, образованной из суспензии барита в воде (2,65 SG).
 Такая суспензия содержит максимальную используемую концентрацию барита — около 750 фунтов/баррель (2100 кг/м3). Минимальная концентрация барита может составлять всего 10 фунтов/баррель (28 кг/м3), хотя обычно она значительно выше. Количество барита, необходимое для повышения плотности данного объема бурового раствора на определенную величину, можно легко рассчитать по соотношению в последовательных единицах: Barite Weight Up Formula
Такая суспензия содержит максимальную используемую концентрацию барита — около 750 фунтов/баррель (2100 кг/м3). Минимальная концентрация барита может составлять всего 10 фунтов/баррель (28 кг/м3), хотя обычно она значительно выше. Количество барита, необходимое для повышения плотности данного объема бурового раствора на определенную величину, можно легко рассчитать по соотношению в последовательных единицах: Barite Weight Up FormulaWhere:
- ρ f = final mud density
- ρ o = original mud density
- ρ R = barite density
- V o = original mud volume
- V B = объем барита
Примечания по ОТОСБ при смешивании барита с буровым раствором
Барит может быть опасен для здоровья и не должен поступать внутрь (опасность на нефтяной вышке). При смешивании барита следует использовать следующую защитную одежду:
- Стандартный СИЗ
- Пылезащитная маска
Осторожно:
- Барит бурового раствора может вызвать раздражение глаз, кожи и дыхательных путей.
 Может быть вреден при проглатывании.
Может быть вреден при проглатывании. - Вдыхание кристаллического кремнезема может вызвать заболевание легких, включая силикоз и рак легких. Кристаллический кремнезем также был связан со склеродермией и заболеванием почек.
Меры первой помощи:
- Вдыхание: При вдыхании вынести на свежий воздух. Обратитесь за медицинской помощью, если развивается раздражение дыхательных путей или если дыхание становится затрудненным.
- Кожа: промыть водой с мылом. Обратитесь за медицинской помощью, если раздражение не проходит.
- Глаза: В случае контакта с баритом бурового раствора немедленно промойте глаза большим количеством воды в течение не менее 15 минут и обратитесь к врачу, если раздражение не проходит.
- Проглатывание: Не вызывать рвоту. Медленно разбавьте 1-2 стаканами воды или молока и обратитесь за медицинской помощью. Никогда не давайте ничего в рот человеку, находящемуся без сознания.
Меры предосторожности при обращении
- Барит для буровых растворов содержит кварц, кристобалит и/или тридимит, которые могут находиться в воздухе без видимого облака.

- Избегайте вдыхания пыли барита бурового раствора.
- Избегайте пыльных условий.
- Используйте только при достаточной вентиляции, чтобы поддерживать воздействие ниже рекомендуемых пределов воздействия.
- При использовании этого изделия надевайте сертифицированный NIOSH, европейский стандарт EN 149 или аналогичный респиратор.
- Материал скользкий во влажном состоянии.
Потребление барита по годам
Ежегодно с 1971 г. ежегодно потребляется барит из бурового раствора, как показано на рис. 2. На рисунке также показано количество скважин и общее количество футов, пробуренных каждый год с 1968 г. по 1978 г. Грубая корреляция очевидна между потреблением барита, количеством скважин и общей пробуренной шириной в футах, хотя использование барита за этот интервал увеличилось больше, чем можно было бы ожидать, судя по данным бурения.
Рис.2Роджерс отметил аналогичную грубую корреляцию для периода 1938-1962 гг. Среднее количество барита, используемого на 1000 футов скважины, увеличилось с 5,4 тонны за период 1953-1962 гг.




 Такая суспензия содержит максимальную используемую концентрацию барита — около 750 фунтов/баррель (2100 кг/м3). Минимальная концентрация барита может составлять всего 10 фунтов/баррель (28 кг/м3), хотя обычно она значительно выше. Количество барита, необходимое для повышения плотности данного объема бурового раствора на определенную величину, можно легко рассчитать по соотношению в последовательных единицах: Barite Weight Up Formula
Такая суспензия содержит максимальную используемую концентрацию барита — около 750 фунтов/баррель (2100 кг/м3). Минимальная концентрация барита может составлять всего 10 фунтов/баррель (28 кг/м3), хотя обычно она значительно выше. Количество барита, необходимое для повышения плотности данного объема бурового раствора на определенную величину, можно легко рассчитать по соотношению в последовательных единицах: Barite Weight Up Formula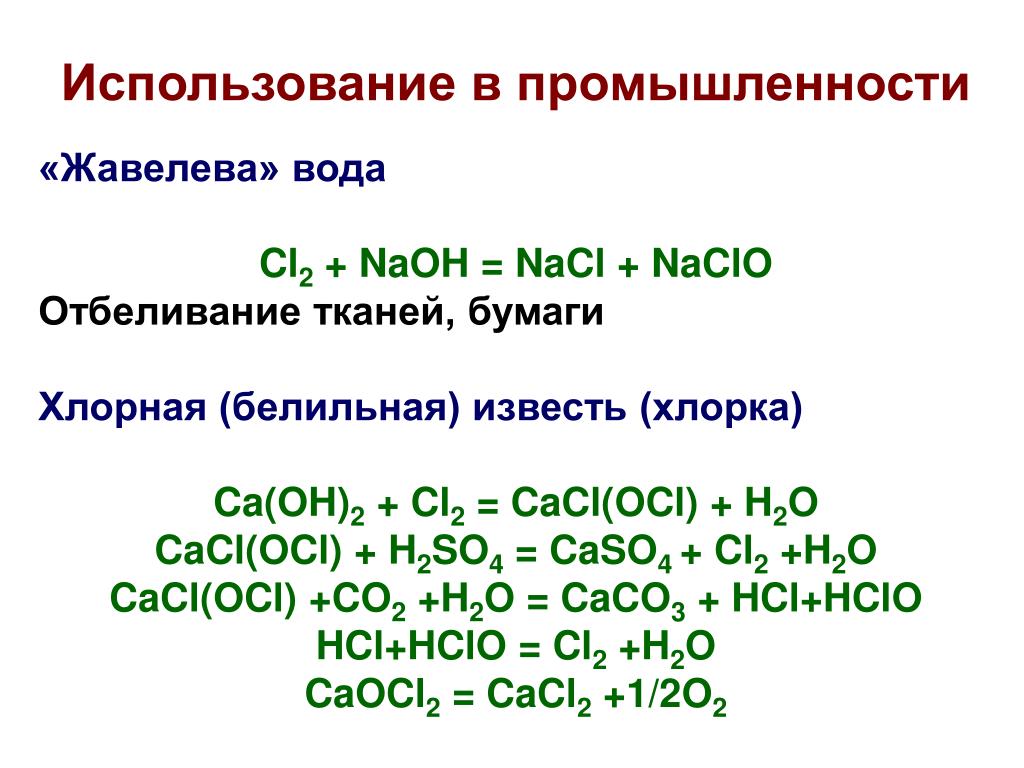 Может быть вреден при проглатывании.
Может быть вреден при проглатывании.
