Метод расчета молярной массы сульфата бария
Многие задачи в химии связаны с вычислением молярной массы вещества, с которым проводятся опыты. В статье рассмотрим один из примеров таких задач и найдем, чему равна молярная масса сульфата бария. Также рассмотрим, в каких областях человеческой деятельности используется это вещество.
Что такое сульфат бария?
Прежде чем рассматривать вопрос молярной массы сульфата бария, познакомимся поближе с этим веществом. Оно, с химической точки зрения, представляет собой соль, образованную сульфат-анионом и катионом бария. Его формулу можно записать следующим образом: BaSO4.
Сульфат бария является белым порошком, который обладает высокой химической инертностью. Так, он не только не растворяется в воде, но и не реагирует со многими щелочами и кислотами. Растворяется он только в концентрированной серной кислоте, а также восстанавливается до оксида бария при нагреве выше 1600 oC.
В природе сульфат бария встречается во многих рудах этого металла, например, он является основным веществом минерала барит.
Благодаря своему белому цвету и химической инертности, эта соль применяется в качестве специальной «каши», которую употребляет в пищу пациент во время рентгеновского исследования желудка (тяжелые атомы бария хорошо поглощают рентгеновские лучи), а также используется при производстве белых красителей в пластмассах.
Любопытно отметить, что почти все соли бария являются ядовитыми и при попадании в организм вызывают сильные отравления. Сульфат бария в этом плане безвреден благодаря его нерастворимости в кислой среде нашего желудка.
Понятие о молярной массе
Прежде чем ответить на вопрос о том, что такое молярная масса сульфата бария, необходимо разобраться с этим понятием. Молярная масса представляет собой отношение массы вещества к количеству молей этого вещества, то есть массу одного моля вещества
Слово «моль» является одной из семи основных или базовых единиц измерения в системе СИ, которая была добавлена в нее в 1971 году. Эта величина означает количество элементов, которое составляет рассматриваемый материал. Это могут быть атомы, молекулы, ионы, электроны, в общем случае любые частицы, на которые можно разделить объект. Значение 1 моль принято считать равным числу Авогадро (NA = 6.022 * 1023). Откуда взялось это число? Все просто, оно точно соответствует числу атомов в 2 граммах газообразного водорода (H2), то есть 1 грамм атомарного водорода (H) так же будет содержать 1 моль частиц.
Это могут быть атомы, молекулы, ионы, электроны, в общем случае любые частицы, на которые можно разделить объект. Значение 1 моль принято считать равным числу Авогадро (NA = 6.022 * 1023). Откуда взялось это число? Все просто, оно точно соответствует числу атомов в 2 граммах газообразного водорода (H2), то есть 1 грамм атомарного водорода (H) так же будет содержать 1 моль частиц.
Использование этой единицы в физике и химии является удобным, ввиду малых размеров атомов и молекул и их большого количества.
Как рассчитать молярную массу сульфата бария?
Теперь, когда разобрано понятие молярной массы, можно переходить непосредственно к теме статьи. Как можно понять из предыдущего пункта, чтобы рассчитать массу 1 моль рассматриваемой соли, необходимо знать, сколько весит одна ее молекула, то есть BaSO4.
Согласно химической формуле, рассматриваемая молекула состоит из одного атома бария, одного атома серы и четырех атомов кислорода.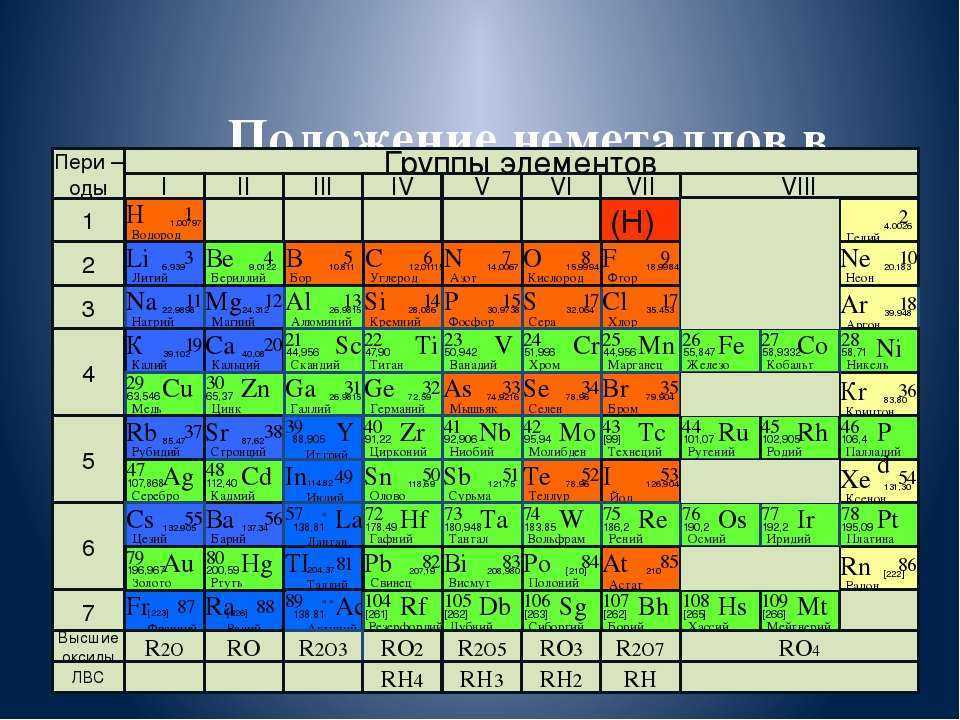 Идея расчета ее массы заключается в суммировании атомных масс соответствующих элементов. Необходимые данные можно найти в периодической системе Д. И. Менделеева.
Идея расчета ее массы заключается в суммировании атомных масс соответствующих элементов. Необходимые данные можно найти в периодической системе Д. И. Менделеева.
Использование таблицы Менделеева: атомные молярные массы
Если обратиться к периодической системе химических элементов, то можно увидеть, что в каждой клетке, представляющей химический элемент, приводится информация о заряде ядра его атома (порядковый номер), конфигурация внешних электронных оболочек, а также некоторое число, которое отражает молярную массу атомов соответствующего элемента.
Из таблицы получаем необходимые молярные массы:
- M(Ba): 137,327;
- M(S): 32,065;
- M(O): 15,999.
Все приведенные значения имеют размерность грамм на моль (г/моль). Отметим, что эти цифры являются усредненным значением между массами разных изотопов одного химического элемента, ядра атомов которого содержат постоянное количество протонов, но число нейтронов может изменяться. Так, барий в действительности является смесью из 6 изотопов, которые могут считаться относительно стабильными, поскольку имеют большие значения периодов полураспада.
Полученные из таблицы Менделеева значения для отдельных атомов можно использовать, чтобы определить, чему равна молярная масса сульфата бария.
Молярная масса BaSO4
Чтобы рассчитать молярную массу сульфата бария 2 (цифра указывает валентность, которую проявляет атом металла в химическом соединении), необходимо сложить соответствующие величины для каждого элемента, учитывая их количество в рассматриваемой молекуле соли. Так, соединение BaSO4 образовано 6-тью атомами: по одному атому Ba и S и 4 атома O. Молярная масса соединения равна: M(BaSO4) = 1 * M(Ba) + 1 * M(S) + 4 * M(O) = 1 * 137,327 + 1 * 32,065 + 4 * 15,999 = 233,388 г/моль.
Справедливости ради следует отметить, что образование устойчивых химических соединений из отдельных атомов сопровождается выделением некоторого количества энергии. Согласно же уравнению Эйнштейна (E = m*c2), потеря энергии эквивалентна потери массы. Поэтому в действительности молярная масса соединения BaSO4 будет иметь меньшее значение, чем посчитанная величина, однако, эта поправка настолько незначительна, что ей пренебрегают.
Рассмотренный на примере сульфата бария способ расчета молярной массы можно применять абсолютно к любым соединениям. Для этого лишь важно знать их химические формулы.
Лактат бария, структурная формула, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задание 022
Задание 022
Вопрос 1
Молярная масса карбоната аммония
А. 96,08 г/моль | Б. 164,1 г/моль | С. 106,9 г/моль |
D. 102,0 г/моль | E. 120,4 г/моль |
|
Вопрос 2
Молярная масса Al 2 O 3 равна
А. 96,08 г/моль | Б. | С. 106,9 г/моль |
D. 102,0 г/моль | E. 120,4 г/моль |
|
Вопрос 3
Рассчитайте массу 6,89 молей атомов калия.
Вопрос 4
Сколько молей атомов бария содержится в 8,64 г атомов бария?
Вопрос 5
Рассчитайте массу 5,36×10 24 атомов серебра.
Вопрос 6
Рассчитайте молярную массу C 18 H 40 .
Вопрос 7
Сколько молей C 17 H 40 содержится в 55,0 г C 17 H 40 ?
Вопрос 8
Сколько молекул C 10 H 20 содержится в 59,7 г C 10 Н 20 ?
Вопрос 9
Рассчитайте количество молей карбонат-ионов в смеси 11,4 г карбоната кальция. и 19,9 г карбоната алюминия.
и 19,9 г карбоната алюминия.
ОТВЕТЫ
Вопрос 1 (00000001A0601102, вариант № 70): A. 96,08 г/моль
Обратная связь
Карбонат аммония (NH 4 ) 2 CO 3 .
Молярная масса = масса (2 моль N + 8 моль H + 1 моль C + 3 моль O)
= 2×14,01 + 8×1,008 + 1×12,01 + 3×16,00
= 96,08 г/моль. Молярная масса соединения равна массе одного моля
сложный. Сложите молярную массу каждого атома в формульной единице
сложный. Числовое значение обычно называют «молекулярным
Вес» или «Вес формулы» или «Вес формулы в граммах».
Вопрос 2 (00000001A0601103, Вариант № 53): D. 102,0 г/моль
Обратная связь
Молярная масса = масса (2 моль Al + 3 моль O)
= 2×26,98 + 3×16,00
= 102,0 г/моль Молярная масса соединения равна массе одного моля
сложный. Сложите молярную массу каждого атома в формульной единице
сложный. Числовое значение обычно называют «молекулярным
Вес» или «Вес формулы» или «Вес формулы в граммах».
Вопрос 3 (00000001A0601402, Вариант № 57): 269 г
Обратная связь
Вам нужно обратиться к периодической таблице и найти атомный вес
калий. Вы обнаружите, что оно равно 39,10 (округлено до четырех значащих цифр).
Это означает, что:
Моляр масса калия составляет 39,10 г/моль.
Один моль атомов калия имеет массу 39,10 г
Следовательно: n молей калия
атомы будут иметь массу (n РАЗ 39.10) г.
ИЛИ: 6,89 молей атомов калия будут иметь массу (6,89 РАЗ 39,10) г,
что равно 269 г.
Вот как это делается с помощью размерного анализа:
6,89 моль атомов калия |
| 39,10 г калия |
|
|
| х |
| = | 269 г калия |
|
| 1 моль атомов калия |
|
|
ПРИМЕЧАНИЯ:
1. «моль» является официальной аббревиатурой «моль» (или
«кроты»).
«моль» является официальной аббревиатурой «моль» (или
«кроты»).
2. Количество значащих цифр в нашей молярной массе должно, по возможности, превышать что в измеренной массе. Так как в числе 6,89 3 значащие цифрыграмм; Это достаточно, чтобы округлить нашу молярную массу до четырех значащих цифр (39,10 г/моль).
Вопрос 4 (00000001A0601403, Вариант № 28): 0,0629 моль атомов бария
Обратная связь
Вам нужно обратиться к периодической таблице и найти атомный вес бария.
Вы обнаружите, что оно равно 137,3 (округлено до четырех значащих цифр). Это означает
что:
Моляр масса бария составляет 137,3 г/моль.
Один моль атомов бария имеет массу 137,3 г
Следовательно: n молей бария
атомы будут иметь массу (n РАЗ 137,3) г.
В задаче сказано: 8,64 г РАВНО (n РАЗ 137,3) г; поэтому мы решаем для n по
деление 8,64 на молярную массу (137,3).
Вот как это делается с помощью размерного анализа:
8,64 г атомов бария |
| 1 моль атомов бария |
|
|
| х |
| = | 0,0629 моль атомов бария |
|
| 137,3 г атомов бария |
|
|
Вопрос 5 (00000001A0601405, вариант № 30): 9,61×10 2 г атомов серебра
Обратная связь
Вам нужно обратиться к периодической таблице и найти атомный вес серебра.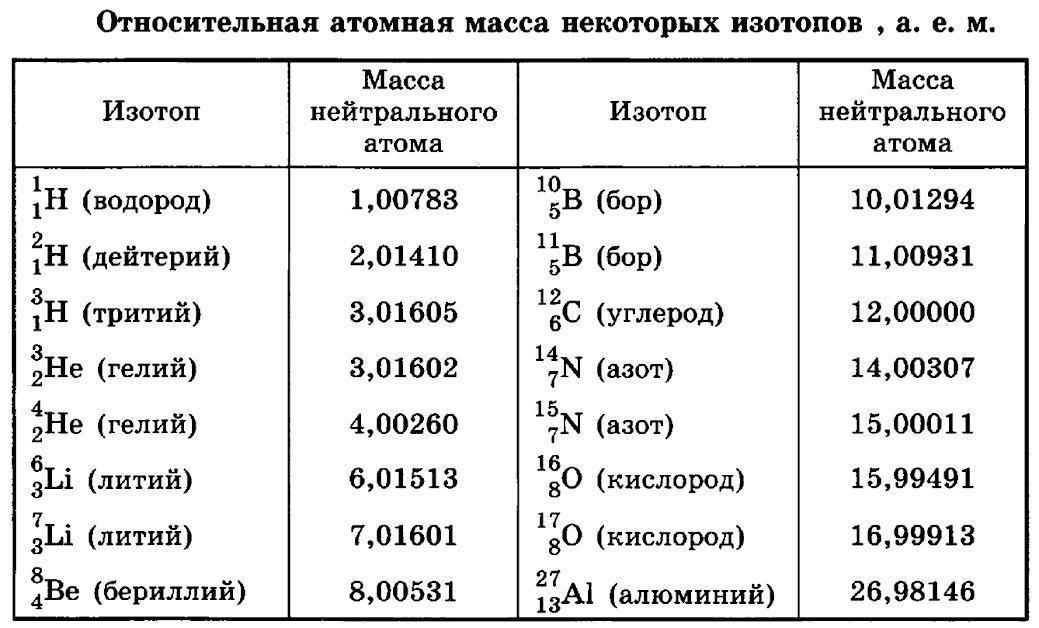 Вы обнаружите, что оно равно 107,9 (округлено до четырех значащих цифр). Это означает
что:
Вы обнаружите, что оно равно 107,9 (округлено до четырех значащих цифр). Это означает
что:
Моляр масса серебра составляет 107,9 г/моль.
Один моль атомов серебра имеет массу 107,9г
Следовательно: n молей серебра атомы будут иметь массу (n РАЗ 107,9) г. Мы можем вычислить (n) просто деление количества отдельных атомов на число Авогадро. Затем умножьте (n) на молярную массу, чтобы получить ответ.
Вот как это делается с помощью размерного анализа. Во-первых, мы конвертируем количество отдельных атомов в количество молей:
5,36×10 24 атомы серебра |
| 1 моль атомов серебра |
|
|
| х |
| = | 8,904 моль атомов серебра |
|
| 6,02×10 23 атомы серебра |
|
|
ТОГДА переводим моли в граммы:
8,904 моль атомов серебра |
| 107,9 г серебра атомы |
|
|
| х |
| = | 961 г атомов серебра |
|
| 1 моль атомов серебра |
|
|
Вот более прямой подход, так как 1 моль атомов равен 6,02×10 23 атомы:
5,36×10 24 атомы серебра |
| 107,9 г серебра атомы |
|
|
| х |
| = | 961 г атомов серебра |
|
| 6,02×10 23 атомы серебра |
|
|
Вопрос 6 (00000001A0601406, Вариант № 77): 256,5 г/моль
Обратная связь
Молярная масса определяется как масса одного моля соединения. В этом
случае, один моль C 18 H 40 содержит 18 моль C и 40 моль H. Вы
необходимо обратиться к периодической таблице для определения молярных масс C и H. Вы найдете
молярная масса C составляет 12,01 г/моль, а молярная масса H составляет 1,008 г/моль.
В этом
случае, один моль C 18 H 40 содержит 18 моль C и 40 моль H. Вы
необходимо обратиться к периодической таблице для определения молярных масс C и H. Вы найдете
молярная масса C составляет 12,01 г/моль, а молярная масса H составляет 1,008 г/моль.
Вклад 18 молей С равен: 18 РАЗ 12,01 = 216,18 г
Вклад от 40 молей H: 40 РАЗ 1,008 = 40,320 г
Суммарная масса 18 моль C и 40 моль H составляет: 256,5 г
Так, один моль C 18 H 40 имеет массу 256,5 г.
Молярная масса C 18 H 40 составляет 256,5 г/моль.
Вопрос 7 (00000001A0601408, Вариант № 1): 2,25×10 -1 моль
Обратная связь
Молярная масса С 12,01 г/моль; коренной зуб
масса Н 1,008 г/моль. Следовательно, моляр
масса C 17 H 40 равна
(17)(12,01)+(40)(1,008)
= 244,5 г/моль.
Масса (n молей C 17 H 40 ) равно
(n РАЗ масса одного моля C 17 H 40 ),
или (n РАЗ больше молярной массы C 17 H 40 ).
IF (н моль) (244,5 г / моль) = 55,0 г,
ТОГДА мы можем найти n, разделив 55,0 г на молярную массу.
Вот как это делается с помощью размерного анализа:
55,0 г C 17 H 40 |
| 1 моль C 17 H 40 |
|
|
| х |
| = | 2,25×10 -1 моль C 17 H 40 |
|
| 244,5 г C 17 H 40 |
|
|
Вопрос 8 (00000001A0601410, вариант № 75): 2,56×10 23 C 10 H 20 молекулы
Обратная связь
Молярная масса С 12,01 г/моль; коренной зуб
масса Н 1,008 г/моль. Следовательно, моляр
масса C 10 H 20 равна
Следовательно, моляр
масса C 10 H 20 равна
(10)(12,01)+(20)(1,008)
= 140,3 г/моль.
Масса (n молей C 10 Н 20 )
(n РАЗ масса одного моля C 10 H 20 ),
или (n РАЗ больше молярной массы C 10 H 20 ).
IF (н моль) (140,3 г / моль) = 59,7 г,
ТОГДА мы можем найти n, разделив 59,7 г на молярную массу.
Вот как это делается с помощью размерного анализа:
59,7 г C 10 H 20 |
| 1 моль C 10 H 20 |
|
|
| х |
| = | 0,4255 моль C 10 H 20 |
|
| 140,3 г C 10 H 20 |
|
|
Наконец, нам нужно преобразовать количество молей в количество отдельных молекул путем умножения
подсчет молей по числу Авогадро. Используя размерный анализ, вот как
сделано:
Используя размерный анализ, вот как
сделано:
0,4255 моль C 10 H 20 молекула |
| 6,02×10 23 C 10 H 20 молекула |
|
|
| х |
| = | 2.56×10 23 C 10 H 20 молекула |
|
| 1 моль C 10 H 20 молекула |
|
|
Вопрос 9 (00000001A0601413, Вариант № 81): 0,369 моль ионов карбоната
Обратная связь
Вы должны знать формулы этих соединений:
Формула карбоната кальция CaCO 3 , молярная масса = 100,1 г/моль
Формула карбоната алюминия Al 2 (CO 3 ) 3 ,
молярная масса = 234,0 г/моль
Вот общий план того, что нам нужно сделать.
1. Рассчитаем моли каждого соединения (массу разделим на молярную массу): получим
0,1139 моль CaCO 3
и 0,08504 моль Al 2 (CO 3 ) 3 .
2. Рассчитайте количество молей карбоната в каждом соединении: имеется ОДИН моль
карбонат-ион на каждый моль CaCO 3 ; есть ТРИ моля
ионов карбоната на каждый моль Al 2 (CO 3 ) 3 .
У нас будет
0,1139 моль CO 3 2- из CaCO 3
и 3 РАЗА 0,08504 (=0,2551) моль CO 3 2- от Al 2 (CO 3 ) 3 .
3. Сложите моли карбонат-ионов, полученные в #2.
0,1139+0,2551 в сумме дает 0,369 моль CO 3 2- .
Какова молярная масса хлорида бария?
Ответ
Проверено
183,6 тыс.+ просмотров
Подсказка: Молярная масса любого химического соединения относится к отношению массы образца этого конкретного соединения к количеству вещества в этом конкретном образце (в молях) .

 164,1 г/моль
164,1 г/моль