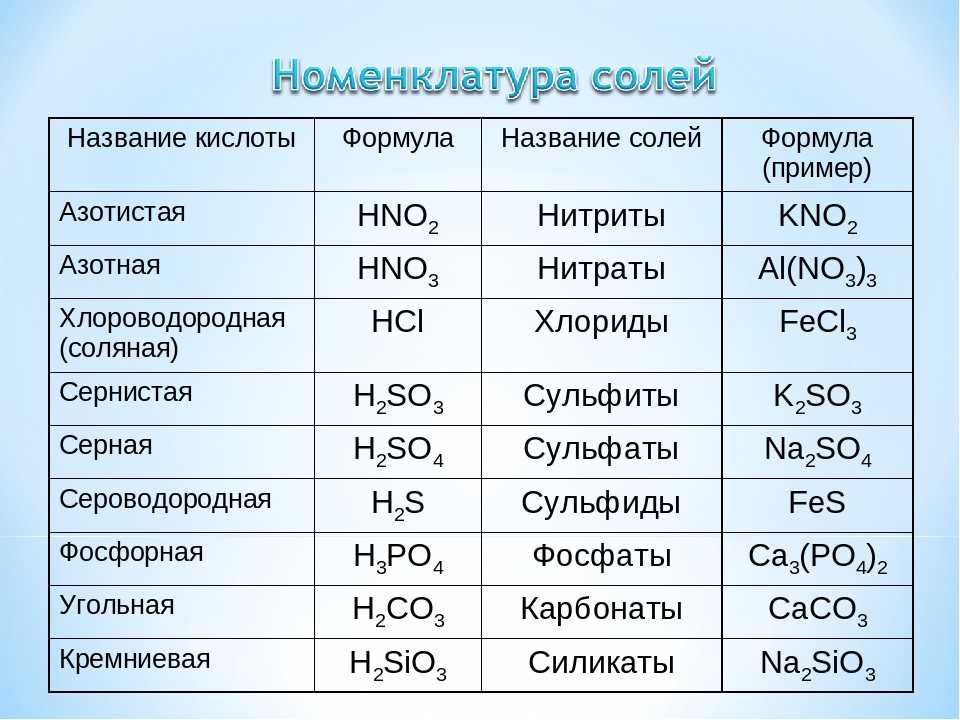
Химические уравнения — как расставлять коэффициенты?
Поможем понять и полюбить химию
Начать учиться
117.3K
Из этой статьи вы узнаете, что такое химические уравнения, зачем они нужны и как их составлять, а также вспомните классификацию химических реакций — все это, конечно, с примерами уравнений.
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в ходе этой реакции.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны. Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.
Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Это важно
Коэффициент 1 в уравнении химической реакции не указывается, но при подсчете суммы коэффициентов в уравнении его необходимо учитывать.
Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=».
 Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.

По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Na2O + H2O = 2NaOH.
Реакции разложения
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
2AgNO3 = 2Ag + 2NO2↑ + O2↑.
Что это за стрелочка? 🤔
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Zn + 2HCl = ZnCl2 + H2↑.
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.

В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов ( восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Между какими веществами протекает | Обозначение | Примеры реагентов |
|---|---|---|
Между жидкостью и твердым веществом | ж—тв | Сода и уксусная кислота |
Между твердым веществом и газом | г—тв | Натрий с водой |
Между жидким веществом и газом | г—ж | |
Между двумя несмешивающимися жидкостями | ж—ж | Вода и масло |
По наличию или отсутствию катализатора
По этому признаку выделяют реакции каталитические и некаталитические.
Каталитические реакции — реакции, протекающие с участием катализатора
Катализатор — вещество, которое ускоряет реакцию, участвует в ней, но остается неизменным после окончания этой реакции.
Наличие катализатора указывается над знаком равенства как kat или формула конкретного вещества, выступающего в роли катализатора.
Например:
Некаталитические реакции — реакции, протекающие без участия катализатора.
По обратимости
Различают обратимые и необратимые реакции.
Обратимые реакции — реакции, протекающие в двух противоположных направлениях.
При составлении уравнений обратимых реакций вместо знака равенства используют знак «⇄».
К обратимым реакциям относят реакции ионного обмена, диссоциации электролитов и многие другие:
H2 + I2 ⇄ 2HI.
Необратимые реакции — реакции, которые протекают только в одном направлении.
Чтобы научиться составлять уравнения химических реакций, нужно только одно — практика. Много практики школьники получают на онлайн-курсах по химии в Skysmart. Интересные задания на интерактивной платформе, примеры из жизни и опытные преподаватели обязательно приведут к желаемому результату — и просто помогут полюбить химию.
Татьяна Сосновцева
К предыдущей статье
Способы получения алкенов
К следующей статье
Тепловой эффект
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Тренировочные задания.
 Реакции, подтверждающие взаимосвязь различных классов неорганических веществ – HIMI4KA
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ – HIMI4KAЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
1. Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
2. Натрий сожгли в избытке кислорода. Образовавшееся вещество обработали водой. Полученную смесь прокипятили, после чего в горячий раствор пропустили хлор. Напишите уравнения описанных реакций.
3. Калий нагрели в атмосфере азота. Полученное соединение обработали избытком соляной кислоты, после чего к образовавшейся смеси солей добавили суспензию гидроксида кальция и нагрели. Полученный газ пропустили над раскаленным оксидом меди (II). Напишите уравнения описанных реакций.
4. Калий сожгли в атмосфере хлора, образовавшуюся соль обработали избытком водного раствора нитрата серебра. Выпавший осадок отфильтровали, фильтрат выпарили и осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
Выпавший осадок отфильтровали, фильтрат выпарили и осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
5. Барий растворили в избытке соляной кислоты, к полученному раствору добавили избыток раствора сульфата натрия. Выпавший осадок отфильтровали и прокалили с углем. Образовавшийся газ пропустили над оксидом железа (III). Напишите уравнения описанных реакций.
6. Барий растворили в воде. К полученному раствору добавили сульфат калия, выпавший осадок отфильтровали, после чего через горячий фильтрат пропустили газообразный хлор. Реакционную массу выпарили, а затем прокалили до образования одной соли. Напишите уравнения описанных реакций.
7. Алюминий растворили в соляной кислоте. К полученному раствору добавили избыток раствора карбоната калия. Выпавший осадок растворили в избытке раствора едкого калия, а выделившийся газ пропустили над раскаленным углем. Напишите уравнения описанных реакций.
8. Алюминий растворили в водном растворе горячего гидроксида натрия. К полученному раствору добавили по каплям разбавленную соляную кислоту до прекращения выделения осадка. Выделившийся в первой реакции газ пропустили над раскаленным оксидом меди (II). Полученное простое вещество растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
9. Углерод сожгли в недостатке кислорода, образовавшийся газ пропустили над оксидом меди (II). Полученное простое вещество сплавили с серой, а продукт этой реакции сожгли в кислороде. Напишите уравнения описанных реакций.
10. Кремний сожгли в кислороде. Продукт реакции сплавили с карбонатом натрия, образовавшееся вещество обработали избытком соляной кислоты при нагревании. Осадок отфильтровали, а к фильтрату добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
11. Газ, образовавшийся при взаимодействии азота и водорода, разделили на две части. Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратился в газ бурого цвета. Напишите уравнения описанных реакций.
Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратился в газ бурого цвета. Напишите уравнения описанных реакций.
12. Разбавленная азотная кислота прореагировала с магнием с выделением бесцветного газа. В его атмосфере сожгли графит с образованием простого и сложного веществ. Простое вещество при нагревании вступило в реакцию с кальцием, а сложное прореагировало с избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
13. Аммиак поглотили азотной кислотой, полученную соль нагрели до образования только двух оксидов. Один из них прореагировал с натрием, а второй при высокой температуре прореагировал с медью. Напишите уравнения описанных реакций.
14. Оксид азота (II) доокислили кислородом. Продукт реакции поглотили раствором гидроксида калия, через полученный раствор пропускали кислород до тех пор, пока в нем не образовалась только одна соль. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
15. Фосфат кальция прокалили с песком и углем. Полученное простое вещество сожгли в кислороде, продукт реакции растворили в воде и нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
16. Фосфор сожгли в избытке кислорода, а образовавшееся вещество сплавили с оксидом натрия. Полученную соль разделили на две части: первую ввели в реакцию с хлоридом кальция, а вторую — с нитратом серебра. Напишите уравнения описанных реакций.
17. Железо сплавили с серой, полученную соль обработали разбавленной серной кислотой. Выделившийся газ сожгли в избытке кислорода, а образовавшееся соединение поглотили раствором гидроксида калия. Напишите уравнения описанных реакций.
18. Серу сплавили с алюминием, полученную соль растворили в воде. Выпавший осадок растворили в избытке гидроксида калия, а газ сожгли в избытке кислорода. Напишите уравнения описанных реакций.
19. Серу растворили в кипящем растворе гидроксида натрия. К полученному раствору добавили хлорид цинка, выпавший осадок отфильтровали и сожгли в кислор оде. Образовавшийся при этом газ прореагировал с сероводородом. Напишите уравнения описанных реакций.
20. Оксид серы (IV) окислили кислородом в присутствии катализатора. Образовавшееся вещество поглотили избытком гидроксида натрия, а к полученному раствору добавили раствор хлорида бария. Выпавший осадок отфильтровали и прокалили с коксом. Напишите уравнения описанных реакций.
21. Железо сожгли в атмосфере хлора. Полученную соль растворили в воде и добавили к ней раствор йодида калия. Выпавший осадок простого вещества отделили и разделили на две части. Первую обработали разбавленной азотной кислотой, а вторую нагрели в атмосфере водорода. Напишите уравнения описанных реакций.
22. Железо растворили в соляной кислоте, к полученному раствору добавили гидроксид натрия до прекращения выделения осадка. В полученную реакционную массу вначале пропустили кислород, а затем добавили избыток йодоводородной кислоты до прекращения выделения осадка. Напишите уравнения описанных реакций.
В полученную реакционную массу вначале пропустили кислород, а затем добавили избыток йодоводородной кислоты до прекращения выделения осадка. Напишите уравнения описанных реакций.
23. Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавляли соляную кислоту до прекращения выделения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
24. Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор, и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй — нитрат серебра. Выделившийся газ прореагировал с раствором гидроксида калия при охлаждении. Напишите уравнения описанных реакций.
25. Осадок, полученный при взаимодействии растворов сульфата железа (III) и нитрата бария, отфильтровали. Фильтрат обработали избытком едкого натра. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
26. Литий сплавили с серой. Полученную соль обработали разбавленной соляной кислотой, при этом выделился газ с запахом тухлых яиц. Этот газ сожгли в избытке кислорода, при этом выделился газ с характерным резким запахом. При пропускании этого газа в избыток гидроксида натрия образовалась средняя соль. Напишите уравнения описанных реакций.
27. Нитрат калия подвергли термическому разложению. Выделившийся газ на свету пропустили через насыщенный раствор сероводорода в воде. Выпавшее вещество желтого цвета сплавили с железом, а полученную соль обработали разбавленной соляной кислотой. Напишите уравнения описанных реакций.
28. Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным резким запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении в реакцию с гидроксидом натрия. Напишите уравнения описанных реакций.
Это вещество вступает при охлаждении в реакцию с гидроксидом натрия. Напишите уравнения описанных реакций.
29. Нитрат натрия сплавили с оксидом хрома в присутствии карбоната натрия. Выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выделения осадка. Напишите уравнения описанных реакций.
30. Литий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с бромом, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
31. Натрий сожгли на воздухе. Образовавшееся при этом твердое вещество поглощает углекислый газ с выделением кислорода и выделением соли. Последнюю соль растворили в соляной кислоте, а к полученному при этом раствору добавили раствор нитрата серебра. При этом выпал белый творожистый осадок. Напишите уравнения описанных реакций.
При этом выпал белый творожистый осадок. Напишите уравнения описанных реакций.
32. Калий сплавили с серой. Полученную соль обработали соляной кислотой. Выделившийся при этом газ пропустили через раствор бихромата калия в серной кислоте. Выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
33. Магний растворили в разбавленной азотной кислоте. К полученному раствору последовательно добавили гидроксид натрия, бромоводородную кислоту, фосфат натрия. Напишите уравнения описанных реакций.
34. Кальций сожгли в атмосфере азота. Полученную соль разложили кипящей водой. Выделившийся газ сожгли в кислороде в присутствии катализатора, а к суспензии прибавили раствор соляной кислоты. Напишите уравнения описанных реакций.
35. Барий растворили в разбавленной азотной кислоте, при этом выделился бесцветный газ — несолеобразующий оксид. Полученный раствор разделили на три части. Первую — выпарили досуха, полученный осадок прокалили. Ко второй части прилили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
Первую — выпарили досуха, полученный осадок прокалили. Ко второй части прилили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
36. Алюминий вступил в реакцию с Fe3O4. Полученную смесь веществ растворили в концентрированном растворе гидроксида натрия и отфильтровали. Твердое вещество сожгли в атмосфере хлора, а фильтрат обработали концентрированным раствором хлорида алюминия. Напишите уравнения описанных реакций.
37. Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте, выделившийся газ вступил в реакцию с оксидом серы (IV), а раствор — с сульфитом натрия. Напишите уравнения описанных реакций.
38. Кремний растворили в концентрированном растворе гидроксида натрия. Через полученный раствор пропустили углекислый газ. Выпавший осадок отфильтровали, высушили и разделили на две части. Первую растворили в плавиковой кислоте, вторую сплавили с магнием. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
39. Азот при нагревании на катализаторе прореагировал с водородом. Полученный газ поглотили раствором азотной кислоты, выпарили досуха и полученное кристаллическое вещество разделили на две части. Первую разложили при температуре 190–240 °C, при этом образовался только один газ и водяные пары. Вторую часть нагрели с концентрированным раствором едкого натра. Напишите уравнения описанных реакций.
40. Красный фосфор окислили кипящей азотной кислотой. Выделившийся при этом газ поглотили раствором гидроксида калия. Продукт окисления в первой реакции нейтрализовали гидроксидом натрия, а к образовавшейся реакционной массе по каплям добавили раствор хлорида кальция до прекращения выделения осадка. Напишите уравнения описанных реакций.
41. Кислород подвергли воздействию электроразряда в озонаторе. Полученный газ пропустили через водный раствор йодида калия, при этом выделился новый газ без цвета и запаха, поддерживающий горение и дыхание. В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
42. Концентрированная серная кислота прореагировала с медью. Выделившийся при этом газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выделения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
43. Хром сожгли в атмосфере хлора. К образовавшейся соли добавили по каплям гидроксид калия до прекращения выделения осадка. Полученный осадок окислили перекисью водорода в среде едкого калия и упарили. К полученному твердому остатку добавили избыток горячего раствора концентрированной соляной кислоты. Напишите уравнения описанных реакций.
44. Перманганат калия обработали концентрированной горячей соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ →
← Тренировочные задания. Окислительно-восстановительные реакции
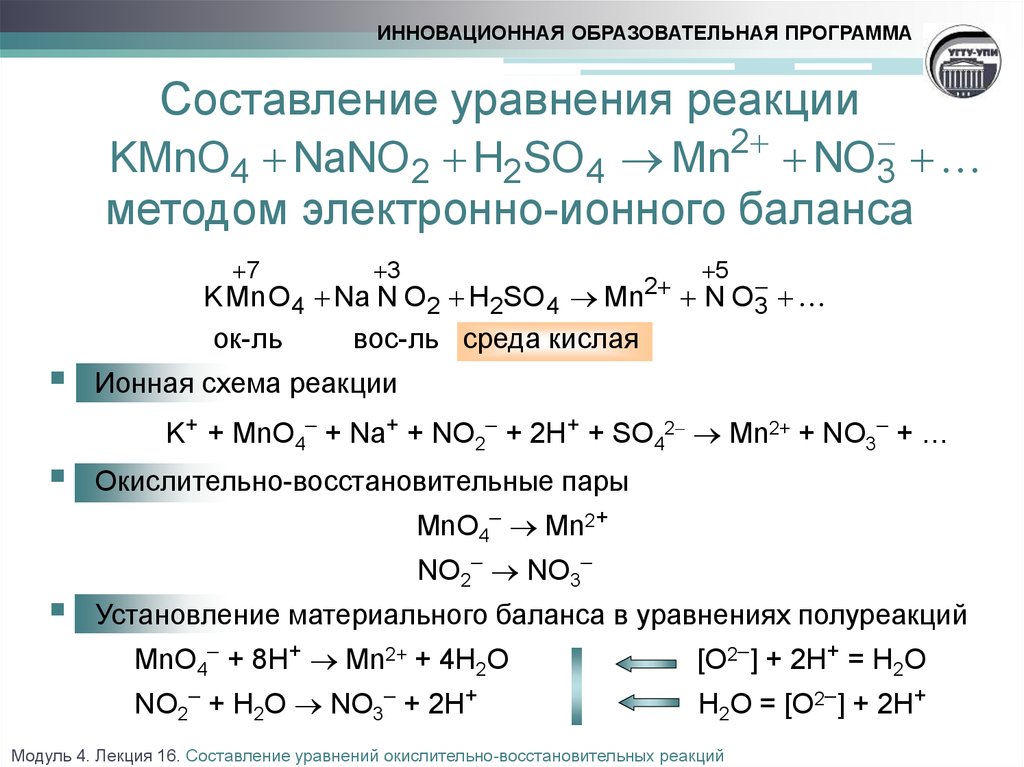
Окислители сильные | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Реактивная группа Лист данных
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом.
способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность. предсказания.
Подробнее о прогнозах реактивности…
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 174 химических паспорта относятся к этой реактивной группе.
Описание
Воспламеняемость
Материалы этой группы технически не горят, но для возникновения реакции горения необходима какая-либо форма окислителя, а сильные окислители могут инициировать или ускорять горение других материалов. Это действие делает пожары более опасными и может привести к взрывам. На самом деле члены этой группы часто входят в состав взрывчатых смесей.
Реактивность
Сильные окислители часто энергично реагируют с другими соединениями, выделяя тепло и, возможно, газообразные продукты, которые могут создавать давление в закрытом контейнере и которые могут продолжать участвовать в дальнейших реакциях. Примером широко известной окислительно-восстановительной (или окислительно-восстановительной) реакции является горение. Когда бензин сжигается в двигателе автомобиля, кислород воздуха действует как окислитель, а бензин действует как (очень слабый) восстановитель. Как только эта реакция инициируется искрой зажигания, она выделяет тепло, а также генерирует много продуктов, включая горячие газы, вызывая повышение давления в камере внутреннего сгорания, которое толкает поршень. Органические соединения в целом обладают некоторой восстановительной способностью и в принципе могут реагировать с соединениями этого класса. Фактическая реакционная способность сильно зависит от идентичности органического соединения.
Примером широко известной окислительно-восстановительной (или окислительно-восстановительной) реакции является горение. Когда бензин сжигается в двигателе автомобиля, кислород воздуха действует как окислитель, а бензин действует как (очень слабый) восстановитель. Как только эта реакция инициируется искрой зажигания, она выделяет тепло, а также генерирует много продуктов, включая горячие газы, вызывая повышение давления в камере внутреннего сгорания, которое толкает поршень. Органические соединения в целом обладают некоторой восстановительной способностью и в принципе могут реагировать с соединениями этого класса. Фактическая реакционная способность сильно зависит от идентичности органического соединения.
Реакции сильных окислителей с соединениями, известными как восстановители, часто бывают взрывоопасными. Тем не менее, потенциально взрывоопасные смеси окислителей и восстановителей могут оставаться неизменными в течение длительного времени, если не допускаются помехи (тепло, искра, катализатор, механический удар). Порох и есть такая смесь. Другой, более опасный класс взрывчатых веществ — это те, в которых окислитель и восстановитель фактически являются разными частями одного и того же соединения. Эти соединения обычно гораздо более чувствительны, чем смеси отдельных окислителей и восстановителей, и могут использоваться в качестве детонаторов или первичных взрывчатых веществ.
Порох и есть такая смесь. Другой, более опасный класс взрывчатых веществ — это те, в которых окислитель и восстановитель фактически являются разными частями одного и того же соединения. Эти соединения обычно гораздо более чувствительны, чем смеси отдельных окислителей и восстановителей, и могут использоваться в качестве детонаторов или первичных взрывчатых веществ.
Сильные окислители могут энергично реагировать с активными металлами, цианидами, сложными эфирами и тиоцианатами. Другие примеры включают смесь сахара (органическое соединение) с хлоратом натрия или магния (неорганический восстановитель) с пероксидом бария.
Токсичность
Большинство токсичны при приеме внутрь; степень варьируется в широких пределах. Кроме того, газообразные или жидкие окислители могут вызывать химические ожоги при вдыхании или попадании на кожу.
Прочие характеристики
Окислитель — это вещество, которое обычно вступает в реакцию, удаляя электроны из других веществ, процесс, известный как окисление. Противоположный процесс (присоединение электронов к соединению) известен как восстановление и всегда происходит одновременно с окислением. Общая реакция называется окислительно-восстановительной или «окислительно-восстановительной» реакцией.
Противоположный процесс (присоединение электронов к соединению) известен как восстановление и всегда происходит одновременно с окислением. Общая реакция называется окислительно-восстановительной или «окислительно-восстановительной» реакцией.
Существует широкий диапазон возможных сил окисления, и эта группа реактивности предназначена для охвата тех окислителей, которые являются такими же или более сильными, чем кислород в условиях окружающей среды. Некоторые материалы становятся более сильными окислителями в присутствии кислоты и могут быть включены сюда, но кислоты-окислители выделены в другую группу (кислоты, сильные окислители). Соединения, которые содержат как окисляющий компонент, так и восстановительный компонент (такие соединения часто являются взрывчатыми веществами), классифицируются как в реакционноспособной группе окислителя, так и в реакционноспособной группе восстановителя.
Примеры
Дихромат аммония, перхлорат аммония, перманганат аммония, бромат бария, хлорат бария, пероксид бария, хлорат кальция, хромат кальция, перхлорат кальция, хлор, кислород, фтор.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым реактивных групп в базе данных.
Прогнозируемые опасности и побочные продукты газа для каждой пары реактивных групп будут отображаться, а также документация и ссылки, которые использовались для делать прогнозы реактивности.
Смешать Окислители сильные с:
- Ацетали, кетали, полуацетали и полукетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окислители
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины, не содержащие ацетиленового водорода
- Амиды и имиды
- Амины ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо-, диазо-, азидо-, гидразиновые и азидные соединения
- Основания, прочные
- Базы, слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды неорганические
- Соли диазония
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Соли фтора, растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды, алифатические ненасыщенные
- Углеводороды ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементальные и порошковые, активные
- Металлы менее химически активные
- Соединения нитратов и нитритов, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Неокислительно-восстановительные неорганические соединения
- Не химически активный
- Металлоорганические соединения
- Окислители, сильные
- Окислители, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные аммониевые и фосфониевые соли
- Восстанавливающие агенты, сильные
- Восстанавливающие агенты, слабые
- Соли кислотные
- Соли основные
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Сложные эфиры и соли тиокарбамата/ Сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
Реакции, тенденции поляризации и растворимости
ᐉ Элементы группы 2: реакции, тенденции поляризации и растворимости5 минут чтения
Реакции с кислородом- Элементы группы 2 сгорают в кислороде с образованием оксида металла.
 Реакция между элементом группы 2 и кислородом является окислительно-восстановительной, поскольку группа 9Элементы 0197 2 окисляются от степени окисления 0 до +2, а кислород восстанавливается от степени окисления 0 до -2. Все оксиды металлов группы 2 представляют собой белые твердые вещества.
Реакция между элементом группы 2 и кислородом является окислительно-восстановительной, поскольку группа 9Элементы 0197 2 окисляются от степени окисления 0 до +2, а кислород восстанавливается от степени окисления 0 до -2. Все оксиды металлов группы 2 представляют собой белые твердые вещества.
- Различные элементы группы 2 будут производить пламя разного цвета . Это характерно окрашенное пламя вызвано присутствием 2+ ионов и, следовательно, может использоваться в качестве теста на наличие ионов металлов Группы 2 .
Группа 2
Реакции с водой- Элементы группы 2 легко реагируют с холодной водой с образованием гидроксида металла и водорода. Реакция металлов группы 2 с водой является окислительно-восстановительной, так как элементы группы 2 окисляются от степени окисления 0 до +2.
 Водород восстанавливается из состояния +1 до 0. Элементы группы 2 образуют ионы +2, которые затем реагируют с водой.
Водород восстанавливается из состояния +1 до 0. Элементы группы 2 образуют ионы +2, которые затем реагируют с водой.
- Скорость реакции с водой элементов увеличивается по мере того, как вы продвигаетесь вниз по группе. Бериллий вообще не реагирует, магний реагирует очень медленно, тогда как барий реагирует быстро.
- Металлы группы 2 энергично реагируют с паром с образованием оксида металла и водорода. Обратите внимание на разницу в продуктах, образующихся в зависимости от того, насколько горячей является вода.
- Оксиды металлов группы 2 энергично реагируют с водой с образованием гидроксида металла . Реакция настолько экзотермическая, что часть воды испарится. В отличие от реакций с металлами 2-й группы водород не выделяется.
- Гидроксиды группы 2 образуют слабощелочные растворы. Гидроксид металла растворяется в воде с образованием избытка ионов ОН-, который увеличить рН раствора.
- Элементы группы 2 легко реагируют с разбавленными кислотами с образованием соли и водорода. Реакция между элементом группы 2 и кислородом представляет собой окислительно-восстановительную реакцию, поскольку элементы группы 2 окисляются из состояния окисления 0 в +2, а водород восстанавливается из состояния +1 в состояние 0. Реакционная способность увеличивается вниз по группе.
Ионная поляризация возникает, когда катион искажает электронное облако соседнего аниона, притягивая к себе делокализованные электроны.
Насколько сильно катион может поляризовать анион, зависит от заряда плотность катион.
Это, в свою очередь, зависит от его размера и заряда : чем меньше ионный радиус и, следовательно, больше заряд 9019 катиона, тем больше его заряд 9019 поляризующая сила.
По мере продвижения по группе 2 поляризующая способность катионов металлов убавок.
Реакции элементов группы 2 Термическое разложение карбонатов и нитратовКарбонаты элементов 2 группы разлагаются при нагревании. Они разлагаются с образованием оксида металла и двуокиси углерода.
Пусть M представляет любой элемент группы 2:
МСО 3 (с) —> МО 2 (с) + СО 2 (г)
Реакции элементов группы 2- Термическая устойчивость карбонатов группы 2 увеличивается по мере снижения группы. По мере продвижения вниз по группе поляризующая способность катионов металлов Drop 2 уменьшается. Чем больше поляризующая способность катиона , тем больше он будет поляризовать ион карбоната, ослабляя ковалентные связи между атомами углерода и кислорода в его структуре , чтобы они с большей вероятностью разрушались при нагревании с образованием диоксида углерода и оксида.

- Нитраты элементов 2 группы при нагревании разлагаются. Они расщепляют с образованием оксида металла, оксида азота (IV) и газообразного кислорода. Пусть M представляет любой элемент группы 2: 2М (№ 3 ) 2 (с) —> 2МО 2 (с) + 4НО 2 (ж) + О 2 (ж) 77
- Термическая стабильность нитратов группы 2 увеличивается по мере того, как мы спускаемся по группе . Как и в случае с карбонатами, температура, при которой разлагаются нитраты , увеличивается по мере продвижения вниз по группе из-за изменений в ионной поляризации.
- По мере продвижения вниз по группе 2 растворимость соединений , содержащих однозарядные отрицательные ионы, увеличивается.
 Если соединение группы 2 состоит из отрицательных ионов с одним зарядом, таких как OH-, растворимость этих соединений в воде увеличивается по мере продвижения вниз по группе.
Если соединение группы 2 состоит из отрицательных ионов с одним зарядом, таких как OH-, растворимость этих соединений в воде увеличивается по мере продвижения вниз по группе. - По мере продвижения вниз по группе 2 растворы гидроксидов металлов становятся более щелочной. Как мы видели ранее, гидроксиды металлов диссоциируют в растворе с образованием избытка ионов ОН-. Чем ниже в группе находится металл , тем более растворим его гидроксид металла и, следовательно, тем больше OH- он диссоциирует на , повышая рН раствора.
- Известно, что гидроксид магния плохо растворим в воде. Гидроксид магния плохо растворим в воде (будет образовывать осадок), тогда как гидроксид бария хорошо растворим.
- По мере продвижения вниз по группе 2 растворимость соединений , содержащих двухзарядные отрицательные ионы, уменьшается.
 Если соединение группы 2 состоит из отрицательных ионов с двойным зарядом, таких как SO42-, растворимость этих соединений в воде уменьшается по мере продвижения вниз по группе.
Если соединение группы 2 состоит из отрицательных ионов с двойным зарядом, таких как SO42-, растворимость этих соединений в воде уменьшается по мере продвижения вниз по группе.
- Сульфат бария (BaSO 4 ) нерастворим в воде. Сульфат бария не растворяется в воде, а при смешивании с водой образует белый осадок.
- Подкисленный хлорид бария можно использовать для проверки на наличие сульфат-ионов. Если к раствору, содержащему сульфат-ионы, добавить подкисленный хлорид бария, образуется белый осадок сульфата бария. Это тест на наличие сульфат-ионов. Хлорид бария подкисляют соляной кислотой для удаления из раствора избытка сульфитов или карбонатов, что также может привести к образованию белого осадка и маскировке результатов.
→Что такое элементы группы 2?
Элементы группы 2 представляют собой набор химических элементов, принадлежащих ко второму столбцу таблицы Менделеева. Они также известны как щелочноземельные элементы.
Они также известны как щелочноземельные элементы.
→ Какова реакционная способность элементов группы 2?
Элементы 2-й группы обладают умеренной реакционной способностью, они менее реакционноспособны, чем элементы 1-й группы, но более реакционноспособны, чем элементы 3-й группы.
→В какие реакции вступают элементы группы 2?
Элементы группы 2 в основном подвергаются реакциям замещения, когда они заменяют другой элемент в соединении. Они также образуют соединения, реагируя с неметаллами, такими как хлор, бром и кислород.
→Какова динамика реакционной способности элементов группы 2?
Реакционная способность элементов группы 2 увеличивается в группе сверху вниз. Это означает, что низшие элементы в группе более реакционноспособны, чем высшие элементы.
→Как реактивность элементов группы 2 сравнивается с элементами группы 1?
Элементы группы 2 менее реакционноспособны, чем элементы группы 1, известные как щелочные металлы. Элементы группы 1 обладают высокой реакционной способностью и легко отдают электроны, в то время как элементы группы 2 имеют меньшую склонность к этому.
Элементы группы 1 обладают высокой реакционной способностью и легко отдают электроны, в то время как элементы группы 2 имеют меньшую склонность к этому.
→Какой самый реактивный элемент в группе 2?
Наиболее реакционноспособным элементом группы 2 является бериллий (Be), наименее реакционноспособным является барий (Ba).
→Как элементы 2 группы реагируют с водой?
Элементы группы 2 реагируют с водой с образованием щелочного раствора. Реакция становится более интенсивной по мере того, как вы спускаетесь вниз по группе, при этом наиболее реакционноспособные элементы, такие как бериллий, реагируют очень медленно, а наименее реакционноспособные элементы, такие как барий, реагируют очень энергично.
Доступ к 20 БЕСПЛАТНЫМ учебникам по химии
Выберите свою экзаменационную доску из раскрывающегося списка, и инструкции о том, как получить доступ, будут отправлены на ваш почтовый ящик.
Ваш адрес электронной почты
Выберите вариант Учебники по общей химии уровня AУчебники по химии уровня CIEУчебники по химии уровня A EdexcelУчебники по химии уровня A OCRУчебники по химии уровня AQA
Давайте знакомиться ?
Как тебя зовут?
Далее
Приятно познакомиться, {{name}}!
Какой предпочитаемый номер телефона?
Какой номер телефона вам больше нравится?
Далее
Просто проверить, что вас интересует?
1-1 Репетиторство Онлайн-курс Стипендии/Ресурсы Другое
Когда мы должны вам позвонить?
Было бы здорово провести 15-минутный чат, чтобы обсудить индивидуальный план и ответить на любые вопросы
Другой день
Пропустить вызов
Какое время вам больше всего подходит? (британское время)
Выберите наиболее удобный для вас временной интервал?
8:00-14:00 14:00–22:00
10:00-10:30 10:30-11:00 11:00-11:30 11:30-12:00 12:00-12:30 12:30-13:00
15:00-15:30 15:30-16:00 16:00-16:30 16:30-17:00 17:00-17:30 17:30-18:00 18:00-18:30 18:30-19:00 19:00-19:30 19:30-20:00
Сколько часов индивидуальных занятий вы ищете?
0-5 10 20-30 40+
Мой номер WhatsApp.
 ..
..Такой же, как тот, который я ввел Отличается от того, который я ввел Следующие
Пожалуйста, подтвердите нашу политику безопасности…
мне нет 18 Я старше 18
Представлять на рассмотрение
Какой онлайн-курс вас интересует?
ДалееКаков ваш запрос?
ОтправитьВы можете подать заявку на получение стипендии, нажав на эту ссылку
https://www.medicmind.co.uk/medic-mind-foundation/Конечно, какой у вас вопрос?
ОтправитьЗагрузка…
Спасибо за ответ.
Мы постараемся ответить вам в течение 12-24 часов.
Запишитесь на 2-часовой урок 1-1 с репетитором прямо сейчас
Если вы готовы и хотите начать, нажмите кнопку ниже, чтобы забронировать свой первый 2-часовой урок с репетиторством 1-1 у нас.
