БАРИЙ | Энциклопедия Кругосвет
Содержание статьи- История открытия.
- Барий в природе.
- Получение.
- Простое вещество.
- Применение в промышленности и науке.
- Соединения бария.
- Другие соединения бария.
- Токсикология соединений бария.
БАРИЙ – химический элемент 2-й группы периодической системы, атомный номер 56, относительная атомная масса 137,33. Расположен в шестом периоде между цезием и лантаном. Природный барий состоит из семи стабильных изотопов с массовыми числами 130(0,101%), 132(0,097%), 134(2,42%), 135(6,59%), 136(7,81%), 137(11,32%) и 138 (71,66%). Барий в большинстве химических соединений проявляет максимальную степень окисления +2, но может иметь и нулевую. В природе барий встречается только в двухвалентном состоянии.
История открытия.
В 1602 Касциароло (болонский сапожник и алхимик) подобрал в окрестных горах камень, который настолько тяжелый, что Касциароло заподозрил в нем золото. Пытаясь выделить золото из камня, алхимик прокалил его с углем. Хотя выделить золото при этом не удалось, опыт принес явно обнадеживающие результаты: охлажденный продукт прокаливания светился в темноте красноватым цветом. Известие о столь необычной находке произвело настоящую сенсацию в алхимической среде и необычный минерал, получивший целый ряд названий – солнечный камень (Lapis solaris), болонский камень (Lapis Boloniensis), болонский фосфор (Phosphorum Boloniensis) стал участником разнообразных экспериментов. Но время шло, а золото и не думало выделяться, поэтому интерес к новому минералу постепенно пропал, и долгое время его считали видоизмененной формой гипса или извести. Лишь через полтора столетия, в 1774 известные шведские химики Карл Шееле и Юхан Ган пристально изучили «болонский камень» и установили, что в нем содержится некая «тяжелая земля». Позднее, в 1779, Гитон де Морво назвал эту «землю» барот (barote) от греческого слова «barue» – тяжелый, а в дальнейшем изменил название на барит (baryte).
Пытаясь выделить золото из камня, алхимик прокалил его с углем. Хотя выделить золото при этом не удалось, опыт принес явно обнадеживающие результаты: охлажденный продукт прокаливания светился в темноте красноватым цветом. Известие о столь необычной находке произвело настоящую сенсацию в алхимической среде и необычный минерал, получивший целый ряд названий – солнечный камень (Lapis solaris), болонский камень (Lapis Boloniensis), болонский фосфор (Phosphorum Boloniensis) стал участником разнообразных экспериментов. Но время шло, а золото и не думало выделяться, поэтому интерес к новому минералу постепенно пропал, и долгое время его считали видоизмененной формой гипса или извести. Лишь через полтора столетия, в 1774 известные шведские химики Карл Шееле и Юхан Ган пристально изучили «болонский камень» и установили, что в нем содержится некая «тяжелая земля». Позднее, в 1779, Гитон де Морво назвал эту «землю» барот (barote) от греческого слова «barue» – тяжелый, а в дальнейшем изменил название на барит (baryte).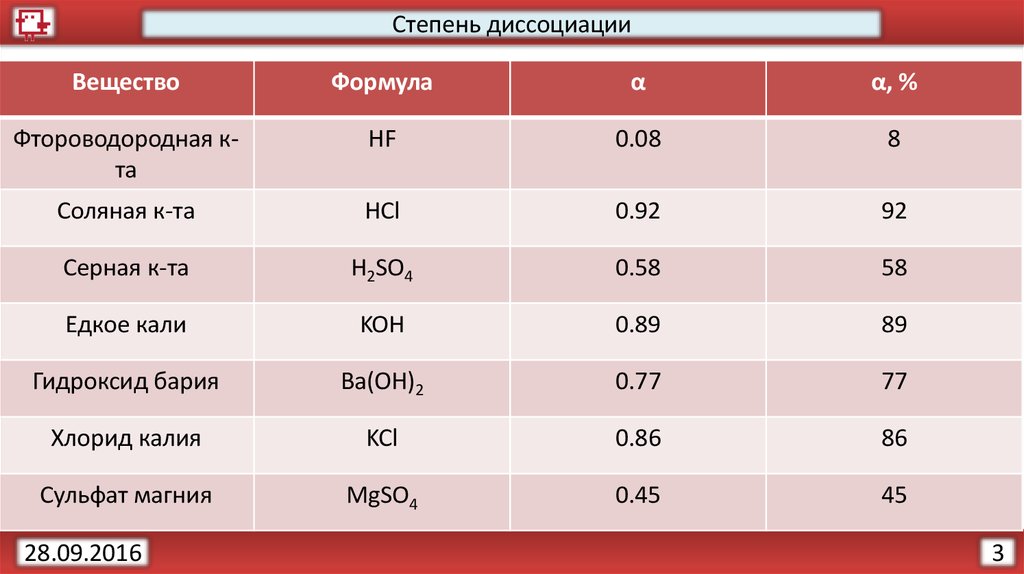 Под этим названием бариевая земля фигурировала в учебниках химии конца 18 – начала 19 вв. Так, например, в учебнике А.Л.Лавуазье (1789) барит входит в список солеобразующих землистых простых тел, причем приводится и другое название барита – «тяжелая земля» (terre pesante, лат. terra ponderosa). Содержащийся в минерале неизвестный пока металл стали называть барием (лат. – Barium). В русской литературе 19 в. также употреблялись названия барит и барий. Следующим известным минералом бария стал природный карбонат бария, открытый в 1782 Витерингом и названный впоследствии в его честь витеритом. Металлический барий был впервые получен англичанином Гэмфри Дэви в 1808 путем электролиза влажного гидроксида бария с ртутным катодом и последующим испарением ртути из амальгамы бария. Следует отметить, что в том же 1808 несколько раньше Дэви амальгаму бария получил шведский химик Йенс Берцелиус. Несмотря на свое название, барий оказался сравнительно легким металлом с плотностью 3,78 г/см3, поэтому в 1816 английский химик Кларк выступил с предложением отклонить название «барий» на том основании, что если бариевая земля (оксид бария) действительно тяжелее других земель (оксидов), то металл, наоборот, легче других металлов.
Под этим названием бариевая земля фигурировала в учебниках химии конца 18 – начала 19 вв. Так, например, в учебнике А.Л.Лавуазье (1789) барит входит в список солеобразующих землистых простых тел, причем приводится и другое название барита – «тяжелая земля» (terre pesante, лат. terra ponderosa). Содержащийся в минерале неизвестный пока металл стали называть барием (лат. – Barium). В русской литературе 19 в. также употреблялись названия барит и барий. Следующим известным минералом бария стал природный карбонат бария, открытый в 1782 Витерингом и названный впоследствии в его честь витеритом. Металлический барий был впервые получен англичанином Гэмфри Дэви в 1808 путем электролиза влажного гидроксида бария с ртутным катодом и последующим испарением ртути из амальгамы бария. Следует отметить, что в том же 1808 несколько раньше Дэви амальгаму бария получил шведский химик Йенс Берцелиус. Несмотря на свое название, барий оказался сравнительно легким металлом с плотностью 3,78 г/см3, поэтому в 1816 английский химик Кларк выступил с предложением отклонить название «барий» на том основании, что если бариевая земля (оксид бария) действительно тяжелее других земель (оксидов), то металл, наоборот, легче других металлов. Кларк хотел назвать этот элемент плутонием в честь древнеримского бога, властителя подземного царства Плутона, однако это предложение не встретило поддержки у других ученых и легкий металл продолжал именоваться «тяжелым».
Кларк хотел назвать этот элемент плутонием в честь древнеримского бога, властителя подземного царства Плутона, однако это предложение не встретило поддержки у других ученых и легкий металл продолжал именоваться «тяжелым».
Барий в природе.
В земной коре содержится 0,065% бария, он встречается в виде сульфата, карбоната, силикатов и алюмосиликатов. Основные минералы бария – уже упоминавшиеся выше барит (сульфат бария), называемый также тяжелым или персидским шпатом, и витерит (карбонат бария). Мировые минерально-сырьевые ресурсы барита оценивались в 1999 в 2 млрд. тонн, значительная часть их сосредоточена в Китае (около 1 млрд. тонн) и в Казахстане (0,5 млрд. тонн). Большие запасы барита есть и в США, Индии, Турции, Марокко и Мексике. Российские ресурсы барита оцениваются в 10 миллионов тонн, его добыча ведется на трех основных месторождениях, расположенных в Хакасии, Кемеровской и Челябинской областях. Общая годовая добыча барита в мире составляет около 7 миллионов тонн, Россия производит 5 тыс. тонн и импортирует 25 тыс. тонн барита в год.
тонн и импортирует 25 тыс. тонн барита в год.
Получение.
Основным сырьем для получения бария и его соединений служат барит и, реже, витерит. Восстанавливая эти минералы каменным углем, коксом или природным газом, получают соответственно сульфид и оксид бария:
BaSO4 + 4C = BaS + 4CO
BaSO4 + 2CH4 = BaS + 2C + 4H2O
BaCO3 + C = BaO + 2CO
Металлический барий получают, восстанавливая его оксидом алюминия.
3BaO + 2Al = 3Ba + Al2O3
Впервые этот процеcc осуществил русский физико-химик Н.Н.Бекетов. Вот как он описывал свои опыты: «Я взял безводную окись бария и, прибавив к ней некоторое количество хлористого бария, как плавня, положил эту смесь вместе с кусками глиния (алюминия) в угленой тигель и накаливал его несколько часов. По охлаждении тигля я нашел в нем металлический сплав уже совсем другого вида и физических свойств, нежели глиний. Этот сплав имеет крупнокристаллическое строение, очень хрупок, свежий излом имеет слабый желтоватый отблеск; анализ показал, что он состоит на 100 ч из 33,3 бария и 66,7 глиния или, иначе, на одну часть бария содержал две части глиния. ..». Сейчас процесс восстановления алюминием проводят в вакууме при температурах от 1100 до 1250° C, при этом образующийся барий испаряется и конденсируется на более холодных частях реактора.
..». Сейчас процесс восстановления алюминием проводят в вакууме при температурах от 1100 до 1250° C, при этом образующийся барий испаряется и конденсируется на более холодных частях реактора.
Кроме того, барий можно получить электролизом расплавленной смеси хлоридов бария и кальция.
Простое вещество.
Барий – серебристо-белый ковкий металл, при резком ударе раскалывается. Температура плавления 727° С, температура кипения 1637° С, плотность 3,780 г/см3. При обычном давлении существует в двух аллотропных модификациях: до 375° C устойчив a-Ba с кубической объемно-центрированной решеткой, выше 375° С устойчив b-Ba. При повышенном давлении образуется гексагональная модификация. Металлический барий обладает высокой химической активностью, он интенсивно окисляется на воздухе, образуя пленку, содержащую BaO, BaO2 и Ba3N2, при незначительном нагревании или при ударе воспламеняется.
2Ba + O2 = 2BaO; Ba + O2 = BaO2; 3Ba + N2 = Ba3N2,
поэтому барий хранят под слоем керосина или парафина. Барий энергично реагирует с водой и растворами кислот, образуя гидроксид бария или соответствующие соли:
Барий энергично реагирует с водой и растворами кислот, образуя гидроксид бария или соответствующие соли:
Ba + 2H2O = Ba(OH)2 + H2
Ba + 2HCl = BaCl2 + H2
С галогенами барий образует галогениды, с водородом и азотом при нагревании – соответственно гидрид и нитрид.
Ba + Cl2 = BaCl2; Ba + H2 = BaH2
Металлический барий растворяется в жидком аммиаке с образованием темно-синего раствора, из которого можно выделить аммиакат Ba(NH3)6 – кристаллы с золотистым блеском, легко разлагающиеся с выделением аммиака. В этом соединении барий имеет нулевую степень окисления.
Применение в промышленности и науке.
Применение металлического бария весьма ограничено из-за его высокой химической активности, соединения бария используются гораздо шире. Сплав бария с алюминием – сплав альба, содержащий 56% Ba – основа геттеров (поглотителей остаточных газов в вакуумной технике). Для получения собственно геттера барий испаряют из сплава, нагревая его в вакуумированной колбе прибора, в результате на холодных частях колбы образуется «бариевое зеркало». В небольших количествах барий используется в металлургии для очистки расплавленных меди и свинца от примесей серы, кислорода и азота. Барий добавляют в типографские и антифрикционные сплавы, сплав бария с никелем используется для изготовления деталей радиоламп и электродов свечей зажигания в карбюраторных двигателях. Кроме того, есть нестандартные применения бария. Одно из них – создание искусственных комет: выпущенные с борта космического аппарата пары бария легко ионизируются солнечными лучами и превращаются в яркое плазменное облако. Первая искусственная комета была создана в 1959 во время полета советской автоматической межпланетной станции «Луна-1». В начале 1970-х германские и американские физики, проводя исследования электромагнитного поля Земли, выбросили над территорией Колумбии 15 килограмм мельчайшего порошка бария.
Для получения собственно геттера барий испаряют из сплава, нагревая его в вакуумированной колбе прибора, в результате на холодных частях колбы образуется «бариевое зеркало». В небольших количествах барий используется в металлургии для очистки расплавленных меди и свинца от примесей серы, кислорода и азота. Барий добавляют в типографские и антифрикционные сплавы, сплав бария с никелем используется для изготовления деталей радиоламп и электродов свечей зажигания в карбюраторных двигателях. Кроме того, есть нестандартные применения бария. Одно из них – создание искусственных комет: выпущенные с борта космического аппарата пары бария легко ионизируются солнечными лучами и превращаются в яркое плазменное облако. Первая искусственная комета была создана в 1959 во время полета советской автоматической межпланетной станции «Луна-1». В начале 1970-х германские и американские физики, проводя исследования электромагнитного поля Земли, выбросили над территорией Колумбии 15 килограмм мельчайшего порошка бария. Образовавшееся плазменное облако вытянулось вдоль линий магнитного поля, позволив уточнить их положение. В 1979 струи бариевых частиц использовали для изучения полярного сияния.
Образовавшееся плазменное облако вытянулось вдоль линий магнитного поля, позволив уточнить их положение. В 1979 струи бариевых частиц использовали для изучения полярного сияния.
Соединения бария.
Наибольший практический интерес представляют соединения двухвалентного бария.
Оксид бария (BaO): промежуточный продукт в производстве бария – тугоплавкий (температура плавления около 2020° C) белый порошок, реагирует с водой, образуя гидроксид бария, поглощает углекислый газ из воздуха, переходя в карбонат:
BaO + H2O = Ba(OH)2; BaO + CO2 = BaCO3
Прокаливаемый на воздухе при температуре 500–600° C, оксид бария реагирует с кислородом, образуя пероксид, который при дальнейшем нагревании до 700° C вновь переходит в оксид, отщепляя кислород:
2BaO + O2 = 2BaO2; 2BaO2 = 2BaO + O2
Так получали кислород вплоть до конца 19 в., пока не был разработан метод выделения кислорода перегонкой жидкого воздуха.
В лаборатории оксид бария можно получить прокаливанием нитрата бария:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
Сейчас оксид бария используется как водоотнимающее средство, для получения пероксида бария и изготовления керамических магнитов из феррата бария (для этого смесь порошков оксидов бария и железа спекают под прессом в сильном магнитном поле), но основное применение оксида бария – изготовление термоэмиссионных катодов. В 1903 молодой немецкий ученый Венельт проверял закон испускания электронов твердыми телами, открытый незадолго до этого английским физиком Ричардсоном. Первый из опытов с платиновой проволокой полностью подтвердил закон, но контрольный эксперимент не удался: поток электронов резко превышал ожидаемый. Поскольку свойства металла не могли измениться, Венельт предположил, что на поверхности платины есть какая-то примесь. Перепробовав возможные загрязнители поверхности, он убедился в том, что дополнительные электроны испускал оксид бария, входивший в состав смазки вакуумного насоса, используемого в эксперименте. Однако научный мир не сразу признал это открытие, так как его наблюдение не удавалось воспроизвести. Лишь почти через четверть века англичанин Колер показал, что для проявления высокой термоэлектронной эмиссии оксид бария нужно прогревать при очень низких давлениях кислорода. Объяснить это явление смогли только в 1935. Немецкий ученый Поль предположил, что электроны испускаются небольшой примесью бария в оксиде: при низких давлениях часть кислорода улетучивается из оксида, а оставшийся барий легко ионизируется с образованием свободных электронов, которые покидают кристалл при нагревании:
Однако научный мир не сразу признал это открытие, так как его наблюдение не удавалось воспроизвести. Лишь почти через четверть века англичанин Колер показал, что для проявления высокой термоэлектронной эмиссии оксид бария нужно прогревать при очень низких давлениях кислорода. Объяснить это явление смогли только в 1935. Немецкий ученый Поль предположил, что электроны испускаются небольшой примесью бария в оксиде: при низких давлениях часть кислорода улетучивается из оксида, а оставшийся барий легко ионизируется с образованием свободных электронов, которые покидают кристалл при нагревании:
2BaO = 2Ba + O2; Ba = Ba2+ + 2е
Правильность этой гипотезы была окончательно установлена в конце 1950-х советскими химиками А.Бунделем и П.Ковтуном, которые измерили концентрацию примеси бария в оксиде и сопоставили ее с потоком термоэмиссии электронов. Сейчас оксид бария является активной действующей частью большинства термоэмиссионных катодов. Так например, пучок электронов, формирующий изображение на экране телевизора или компьютерного монитора, испускается оксидом бария.
Гидроксид бария, октагидрат (Ba(OH)2·8H2O). Белый порошок, хорошо растворимый в горячей воде (больше 50% при 80° C), хуже в холодной (3,7% при 20° C). Температура плавления октагидрата 78° C, при нагревании до 130° C он переходит в безводный Ba(OH)2. Гидроксид бария получают растворяя оксид в горячей воде или нагревая сульфид бария в потоке перегретого пара. Гидроксид бария легко реагирует с углекислым газом, поэтому его водный раствор, называемый «баритовой водой» используют в аналитической химии в качестве реактива на CO2. Кроме того, «баритовая вода» служит реактивом на сульфат- и карбонат-ионы. Гидроксид бария применяется для удаления сульфат-ионов из растительных и животных масел и промышленных растворов, для получения гидроксидов рубидия и цезия, в качестве компонента смазок.
Карбонат бария (BaCO3). В природе – минерал витерит. Белый порошок, нерастворимый в воде, растворимый в сильных кислотах (кроме серной). При нагревании до 1000° С разлагается с выделением CO2:
При нагревании до 1000° С разлагается с выделением CO2:
BaCO3 = BaO + CO2
Карбонат бария добавляют в стекло для увеличения его коэффициента преломления, вводят в состав эмалей и глазурей.
Сульфат бария (BaSO4). В природе – барит (тяжелый или персидский шпат) – основной минерал бария – белый порошок (температура плавления около 1680° C), практически нерастворимый в воде (2,2 мг/л при 18° C), медленно растворяется в концентрированной серной кислоте.
С сульфатом бария издавна связано производство красок. Правда, вначале его использование носило криминальный характер: в измельченном виде барит подмешивали к свинцовым белилам, что значительно удешевляло конечный продукт и, одновременно, ухудшало качество краски. Тем не менее, такие модифицированные белила продавались по той же цене, что и обычные, принося значительную прибыль владельцам красильных заводов. Еще в 1859 в департамент мануфактур и внутренней торговли поступили сведения о жульнических махинациях ярославских заводчиков, добавлявших к свинцовым белилам тяжелый шпат, что «вводит потребителей в обман на счет истинного качества товара, причем поступила и просьба о воспрещении означенным заводчикам употребления шпата при выделке свинцовых белил». Но эти жалобы ни к чему не привели. Достаточно сказать, что в 1882 в Ярославле был основан шпатовый завод, который, в 1885 выпустил 50 тысяч пудов измельченного тяжелого шпата. В начале 1890-х Д.И.Менделеев писал: «…В подмесь к белилам на многих заводах примешивается барит, так как и привозимые из-за границы белила, для уменьшения цены, содержат эту подмесь».
Но эти жалобы ни к чему не привели. Достаточно сказать, что в 1882 в Ярославле был основан шпатовый завод, который, в 1885 выпустил 50 тысяч пудов измельченного тяжелого шпата. В начале 1890-х Д.И.Менделеев писал: «…В подмесь к белилам на многих заводах примешивается барит, так как и привозимые из-за границы белила, для уменьшения цены, содержат эту подмесь».
Сульфат бария входит в состав литопона – неядовитой белой краски с высокой кроющей способностью, широко востребованной на рынке. Для изготовления литопона смешивают водные растворы сульфида бария и сульфата цинка, при этом происходит обменная реакция и в осадок выпадает смесь мелкокристаллических сульфата бария и сульфида цинка – литопон, а в растворе остается чистая вода.
BaS + ZnSO4 = BaSO4Ї + ZnSЇ
В производстве дорогих сортов бумаги сульфат бария играет роль наполнителя и утяжелителя, делая бумагу белее и плотнее, его используют и в качестве наполнителя резин и керамики.
Более 95% добываемого в мире барита используется для приготовления рабочих растворов для бурения глубоких скважин.
Сульфат бария сильно поглощает рентгеновские и гамма-лучи. Это свойство широко используется в медицине для диагностики желудочно-кишечных заболеваний. Для этого пациенту дают проглотить суспензию сульфата бария в воде или его смесь с манной кашей – «бариевую кашу» и затем просвечивают рентгеновскими лучами. Те участки пищеварительного тракта, по которым проходит «бариевая каша», на снимке выглядят темными пятнами. Так врач может получить представление о форме желудка и кишок, определить место возникновения заболевания. Сульфат бария используется также для изготовления баритобетона, используемого при строительстве атомных электростанций и атомных заводов для защиты от проникающей радиации.
Сульфид бария (BaS). Промежуточный продукт в производстве бария и его соединений. Торговый продукт представляет собой серый рыхлый порошок, плохо растворимый в воде. Сульфид бария применяется для получения литопона, в кожевенной промышленности для удаления волосяного покрова со шкур, для получения чистого сероводорода. BaS – компонент многих люминофоров – веществ, светящихся после поглощения световой энергии. Именно его получил Касциароло, прокаливая барит с углем. Сам по себе сульфид бария не светится: необходимы добавки веществ-активаторов – солей висмута, свинца и других металлов.
BaS – компонент многих люминофоров – веществ, светящихся после поглощения световой энергии. Именно его получил Касциароло, прокаливая барит с углем. Сам по себе сульфид бария не светится: необходимы добавки веществ-активаторов – солей висмута, свинца и других металлов.
Титанат бария (BaTiO3). Одно из самых промышленно важных соединений бария – белое тугоплавкое (температура плавления 1616° C) кристаллическое вещество, нерастворимое в воде. Получают титанат бария сплавлением диоксида титана с карбонатом бария при температуре около 1300° C:
BaCO3 + TiO2 = BaTiO3 + CO2
Титанат бария – один из лучших сегнетоэлектриков (см. также СЕГНЕТОЭЛЕКТРИКИ), очень ценных электротехнических материалов. В 1944 советский физик Б.М.Вул обнаружил незаурядные сегнетоэлектрические способности (очень высокую диэлектрическую проницаемость) у титаната бария, который сохранял их в широком температурном диапазоне – почти от абсолютного нуля до +125° C. Это обстоятельство, а также большая механическая прочность и влагостойкость титаната бария способствовали тому, что он стал одним из самых важных сегнетоэлектриков, используемых, например, для изготовления электрических конденсаторов. Титанат бария, как и все сегнетоэлектрики, обладает и пьезоэлектрическими свойствами: изменяет свои электрические характеристики под действием давления. При действии переменного электрического поля в его кристаллах возникают колебания, в связи с чем их используют в пьезоэлементах, радиосхемах и автоматических системах. Титанат бария применяли при попытках обнаружить гравитационные волны.
Это обстоятельство, а также большая механическая прочность и влагостойкость титаната бария способствовали тому, что он стал одним из самых важных сегнетоэлектриков, используемых, например, для изготовления электрических конденсаторов. Титанат бария, как и все сегнетоэлектрики, обладает и пьезоэлектрическими свойствами: изменяет свои электрические характеристики под действием давления. При действии переменного электрического поля в его кристаллах возникают колебания, в связи с чем их используют в пьезоэлементах, радиосхемах и автоматических системах. Титанат бария применяли при попытках обнаружить гравитационные волны.
Другие соединения бария.
Нитрат и хлорат (Ba(ClO3)2) бария – составная часть фейерверков, добавки этих соединений придают пламени ярко-зеленую окраску. Пероксид бария входит в состав запальных смесей для алюминотермии. Тетрацианоплатинат(II) бария (Ba[Pt(CN)4]) светится под воздействием рентгеновских и гамма-лучей. В 1895 немецкий физик Вильгельм Рентген, наблюдая свечение этого вещества предположил существование нового излучения, названного впоследствии рентгеновским. Сейчас тетрацианоплатинатом(II) бария покрывают светящиеся экраны приборов. Тиосульфат бария (BaS2O3) придает бесцветному лаку жемчужный оттенок, а, смешав его с клеем, можно добиться полной имитации перламутра.
Сейчас тетрацианоплатинатом(II) бария покрывают светящиеся экраны приборов. Тиосульфат бария (BaS2O3) придает бесцветному лаку жемчужный оттенок, а, смешав его с клеем, можно добиться полной имитации перламутра.
Токсикология соединений бария.
Все растворимые соли бария ядовиты. Сульфат бария, применяемый при рентгеноскопии, практически нетоксичен. Смертельная доза хлорида бария составляет 0,8–0,9 г, карбоната бария – 2–4 г. При приеме внутрь ядовитых соединений бария возникают жжение во рту, боли в области желудка, слюнотечение, тошнота, рвота, головокружение, мышечная слабость, одышка, замедление пульса и падение артериального давления. Основной метод лечения отравлений барием – промывание желудка и употребление слабительных средств.
Основными источниками поступления бария в организм человека являются пища (особенно морепродукты) и питьевая вода. По рекомендации Всемирной организацией здравоохранения содержание бария в питьевой воде не должно превышать 0,7 мг/л, в России действуют гораздо более жесткие нормы – 0,1 мг/л.
Юрий Крутяков
описание и свойства металла, способ получения и сферы применения и опасность элемента
БАРИЙ
– химический элемент 2-й группы периодической системы, атомный номер 56, относительная атомная масса 137,33. Расположен в шестом периоде между цезием и лантаном. Природный барий состоит из семи стабильных изотопов с массовыми числами 130(0,101%), 132(0,097%), 134(2,42%), 135(6,59%), 136(7,81%), 137(11,32%) и 138 (71,66%). Барий в большинстве химических соединений проявляет максимальную степень окисления +2, но может иметь и нулевую. В природе барий встречается только в двухвалентном состоянии.
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/л. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Соединения бария.
Наибольший практический интерес представляют соединения двухвалентного бария.
Оксид бария
(
BaO
): промежуточный продукт в производстве бария – тугоплавкий (температура плавления около 2020° C) белый порошок, реагирует с водой, образуя гидроксид бария, поглощает углекислый газ из воздуха, переходя в карбонат:
BaO + h3O = Ba(OH)2; BaO + CO2 = BaCO3
Прокаливаемый на воздухе при температуре 500–600° C, оксид бария реагирует с кислородом, образуя пероксид, который при дальнейшем нагревании до 700° C вновь переходит в оксид, отщепляя кислород:
2BaO + O2 = 2BaO2; 2BaO2 = 2BaO + O2
Так получали кислород вплоть до конца 19 в., пока не был разработан метод выделения кислорода перегонкой жидкого воздуха.
В лаборатории оксид бария можно получить прокаливанием нитрата бария:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
Сейчас оксид бария используется как водоотнимающее средство, для получения пероксида бария и изготовления керамических магнитов из феррата бария (для этого смесь порошков оксидов бария и железа спекают под прессом в сильном магнитном поле), но основное применение оксида бария – изготовление термоэмиссионных катодов. В 1903 молодой немецкий ученый Венельт проверял закон испускания электронов твердыми телами, открытый незадолго до этого английским физиком Ричардсоном. Первый из опытов с платиновой проволокой полностью подтвердил закон, но контрольный эксперимент не удался: поток электронов резко превышал ожидаемый. Поскольку свойства металла не могли измениться, Венельт предположил, что на поверхности платины есть какая-то примесь. Перепробовав возможные загрязнители поверхности, он убедился в том, что дополнительные электроны испускал оксид бария, входивший в состав смазки вакуумного насоса, используемого в эксперименте. Однако научный мир не сразу признал это открытие, так как его наблюдение не удавалось воспроизвести. Лишь почти через четверть века англичанин Колер показал, что для проявления высокой термоэлектронной эмиссии оксид бария нужно прогревать при очень низких давлениях кислорода. Объяснить это явление смогли только в 1935. Немецкий ученый Поль предположил, что электроны испускаются небольшой примесью бария в оксиде: при низких давлениях часть кислорода улетучивается из оксида, а оставшийся барий легко ионизируется с образованием свободных электронов, которые покидают кристалл при нагревании:
В 1903 молодой немецкий ученый Венельт проверял закон испускания электронов твердыми телами, открытый незадолго до этого английским физиком Ричардсоном. Первый из опытов с платиновой проволокой полностью подтвердил закон, но контрольный эксперимент не удался: поток электронов резко превышал ожидаемый. Поскольку свойства металла не могли измениться, Венельт предположил, что на поверхности платины есть какая-то примесь. Перепробовав возможные загрязнители поверхности, он убедился в том, что дополнительные электроны испускал оксид бария, входивший в состав смазки вакуумного насоса, используемого в эксперименте. Однако научный мир не сразу признал это открытие, так как его наблюдение не удавалось воспроизвести. Лишь почти через четверть века англичанин Колер показал, что для проявления высокой термоэлектронной эмиссии оксид бария нужно прогревать при очень низких давлениях кислорода. Объяснить это явление смогли только в 1935. Немецкий ученый Поль предположил, что электроны испускаются небольшой примесью бария в оксиде: при низких давлениях часть кислорода улетучивается из оксида, а оставшийся барий легко ионизируется с образованием свободных электронов, которые покидают кристалл при нагревании:
2BaO = 2Ba + O2; Ba = Ba2+ + 2е
Правильность этой гипотезы была окончательно установлена в конце 1950-х советскими химиками А. Бунделем и П.Ковтуном, которые измерили концентрацию примеси бария в оксиде и сопоставили ее с потоком термоэмиссии электронов. Сейчас оксид бария является активной действующей частью большинства термоэмиссионных катодов. Так например, пучок электронов, формирующий изображение на экране телевизора или компьютерного монитора, испускается оксидом бария.
Бунделем и П.Ковтуном, которые измерили концентрацию примеси бария в оксиде и сопоставили ее с потоком термоэмиссии электронов. Сейчас оксид бария является активной действующей частью большинства термоэмиссионных катодов. Так например, пучок электронов, формирующий изображение на экране телевизора или компьютерного монитора, испускается оксидом бария.
Гидроксид бария, октагидрат
(
Ba(OH)2
·
8h3O
). Белый порошок, хорошо растворимый в горячей воде (больше 50% при 80° C), хуже в холодной (3,7% при 20° C). Температура плавления октагидрата 78° C, при нагревании до 130° C он переходит в безводный Ba(OH)2. Гидроксид бария получают растворяя оксид в горячей воде или нагревая сульфид бария в потоке перегретого пара. Гидроксид бария легко реагирует с углекислым газом, поэтому его водный раствор, называемый «баритовой водой» используют в аналитической химии в качестве реактива на CO2. Кроме того, «баритовая вода» служит реактивом на сульфат- и карбонат-ионы. Гидроксид бария применяется для удаления сульфат-ионов из растительных и животных масел и промышленных растворов, для получения гидроксидов рубидия и цезия, в качестве компонента смазок.
Гидроксид бария применяется для удаления сульфат-ионов из растительных и животных масел и промышленных растворов, для получения гидроксидов рубидия и цезия, в качестве компонента смазок.
Карбонат бария
(
BaCO3
). В природе – минерал витерит. Белый порошок, нерастворимый в воде, растворимый в сильных кислотах (кроме серной). При нагревании до 1000° С разлагается с выделением CO2:
BaCO3 = BaO + CO2
Карбонат бария добавляют в стекло для увеличения его коэффициента преломления, вводят в состав эмалей и глазурей.
Сульфат бария
(
BaSO4
)
.
В природе – барит (тяжелый или персидский шпат) – основной минерал бария – белый порошок (температура плавления около 1680° C), практически нерастворимый в воде (2,2 мг/л при 18° C), медленно растворяется в концентрированной серной кислоте.
С сульфатом бария издавна связано производство красок. Правда, вначале его использование носило криминальный характер: в измельченном виде барит подмешивали к свинцовым белилам, что значительно удешевляло конечный продукт и, одновременно, ухудшало качество краски. Тем не менее, такие модифицированные белила продавались по той же цене, что и обычные, принося значительную прибыль владельцам красильных заводов. Еще в 1859 в департамент мануфактур и внутренней торговли поступили сведения о жульнических махинациях ярославских заводчиков, добавлявших к свинцовым белилам тяжелый шпат, что «вводит потребителей в обман на счет истинного качества товара, причем поступила и просьба о воспрещении означенным заводчикам употребления шпата при выделке свинцовых белил». Но эти жалобы ни к чему не привели. Достаточно сказать, что в 1882 в Ярославле был основан шпатовый завод, который, в 1885 выпустил 50 тысяч пудов измельченного тяжелого шпата. В начале 1890-х Д.И.Менделеев писал: «…В подмесь к белилам на многих заводах примешивается барит, так как и привозимые из-за границы белила, для уменьшения цены, содержат эту подмесь».
Тем не менее, такие модифицированные белила продавались по той же цене, что и обычные, принося значительную прибыль владельцам красильных заводов. Еще в 1859 в департамент мануфактур и внутренней торговли поступили сведения о жульнических махинациях ярославских заводчиков, добавлявших к свинцовым белилам тяжелый шпат, что «вводит потребителей в обман на счет истинного качества товара, причем поступила и просьба о воспрещении означенным заводчикам употребления шпата при выделке свинцовых белил». Но эти жалобы ни к чему не привели. Достаточно сказать, что в 1882 в Ярославле был основан шпатовый завод, который, в 1885 выпустил 50 тысяч пудов измельченного тяжелого шпата. В начале 1890-х Д.И.Менделеев писал: «…В подмесь к белилам на многих заводах примешивается барит, так как и привозимые из-за границы белила, для уменьшения цены, содержат эту подмесь».
Сульфат бария входит в состав литопона – неядовитой белой краски с высокой кроющей способностью, широко востребованной на рынке. Для изготовления литопона смешивают водные растворы сульфида бария и сульфата цинка, при этом происходит обменная реакция и в осадок выпадает смесь мелкокристаллических сульфата бария и сульфида цинка – литопон, а в растворе остается чистая вода.
BaS + ZnSO4 = BaSO4Ї + ZnSЇ
В производстве дорогих сортов бумаги сульфат бария играет роль наполнителя и утяжелителя, делая бумагу белее и плотнее, его используют и в качестве наполнителя резин и керамики.
Более 95% добываемого в мире барита используется для приготовления рабочих растворов для бурения глубоких скважин.
Сульфат бария сильно поглощает рентгеновские и гамма-лучи. Это свойство широко используется в медицине для диагностики желудочно-кишечных заболеваний. Для этого пациенту дают проглотить суспензию сульфата бария в воде или его смесь с манной кашей – «бариевую кашу» и затем просвечивают рентгеновскими лучами. Те участки пищеварительного тракта, по которым проходит «бариевая каша», на снимке выглядят темными пятнами. Так врач может получить представление о форме желудка и кишок, определить место возникновения заболевания. Сульфат бария используется также для изготовления баритобетона, используемого при строительстве атомных электростанций и атомных заводов для защиты от проникающей радиации.
Сульфид бария
(
BaS
). Промежуточный продукт в производстве бария и его соединений. Торговый продукт представляет собой серый рыхлый порошок, плохо растворимый в воде. Сульфид бария применяется для получения литопона, в кожевенной промышленности для удаления волосяного покрова со шкур, для получения чистого сероводорода. BaS – компонент многих люминофоров – веществ, светящихся после поглощения световой энергии. Именно его получил Касциароло, прокаливая барит с углем. Сам по себе сульфид бария не светится: необходимы добавки веществ-активаторов – солей висмута, свинца и других металлов.
Титанат бария
(
BaTiO3
)
.
Одно из самых промышленно важных соединений бария – белое тугоплавкое (температура плавления 1616° C) кристаллическое вещество, нерастворимое в воде. Получают титанат бария сплавлением диоксида титана с карбонатом бария при температуре около 1300° C:
BaCO3 + TiO2 = BaTiO3 + CO2
Титанат бария – один из лучших сегнетоэлектриков (см
.
также
СЕГНЕТОЭЛЕКТРИКИ), очень ценных электротехнических материалов. В 1944 советский физик Б.М.Вул обнаружил незаурядные сегнетоэлектрические способности (очень высокую диэлектрическую проницаемость) у титаната бария, который сохранял их в широком температурном диапазоне – почти от абсолютного нуля до +125° C. Это обстоятельство, а также большая механическая прочность и влагостойкость титаната бария способствовали тому, что он стал одним из самых важных сегнетоэлектриков, используемых, например, для изготовления электрических конденсаторов. Титанат бария, как и все сегнетоэлектрики, обладает и пьезоэлектрическими свойствами: изменяет свои электрические характеристики под действием давления. При действии переменного электрического поля в его кристаллах возникают колебания, в связи с чем их используют в пьезоэлементах, радиосхемах и автоматических системах. Титанат бария применяли при попытках обнаружить гравитационные волны.
Получение
Основное сырьё для получения бария — баритовый концентрат (80—95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
BaSO4 + 4C → BaS + 4CO BaSO4 + 2Ch5 → BaS + 2C + 4h3O
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
BaS + 2h3O → Ba(OH)2 + h3S↑ BaS + h3O + CO2 → BaCO3 + h3S↑ BaCO3 → BaO + CO2
Получают металлический барий электролизом безводного расплава хлорида бария:
BaCl2 → Ba + Cl2
История открытия.
Также по теме:
БАРИТ
В 1602 Касциароло (болонский сапожник и алхимик) подобрал в окрестных горах камень, который настолько тяжелый, что Касциароло заподозрил в нем золото. Пытаясь выделить золото из камня, алхимик прокалил его с углем. Хотя выделить золото при этом не удалось, опыт принес явно обнадеживающие результаты: охлажденный продукт прокаливания светился в темноте красноватым цветом. Известие о столь необычной находке произвело настоящую сенсацию в алхимической среде и необычный минерал, получивший целый ряд названий – солнечный камень (Lapis solaris), болонский камень (Lapis Boloniensis), болонский фосфор (Phosphorum Boloniensis) стал участником разнообразных экспериментов. Но время шло, а золото и не думало выделяться, поэтому интерес к новому минералу постепенно пропал, и долгое время его считали видоизмененной формой гипса или извести. Лишь через полтора столетия, в 1774 известные шведские химики Карл Шееле и Юхан Ган пристально изучили «болонский камень» и установили, что в нем содержится некая «тяжелая земля». Позднее, в 1779, Гитон де Морво назвал эту «землю» барот (barote) от греческого слова «barue» – тяжелый, а в дальнейшем изменил название на барит (baryte). Под этим названием бариевая земля фигурировала в учебниках химии конца 18 – начала 19 вв. Так, например, в учебнике А.Л.Лавуазье (1789) барит входит в список солеобразующих землистых простых тел, причем приводится и другое название барита – «тяжелая земля» (terre pesante, лат.
Известие о столь необычной находке произвело настоящую сенсацию в алхимической среде и необычный минерал, получивший целый ряд названий – солнечный камень (Lapis solaris), болонский камень (Lapis Boloniensis), болонский фосфор (Phosphorum Boloniensis) стал участником разнообразных экспериментов. Но время шло, а золото и не думало выделяться, поэтому интерес к новому минералу постепенно пропал, и долгое время его считали видоизмененной формой гипса или извести. Лишь через полтора столетия, в 1774 известные шведские химики Карл Шееле и Юхан Ган пристально изучили «болонский камень» и установили, что в нем содержится некая «тяжелая земля». Позднее, в 1779, Гитон де Морво назвал эту «землю» барот (barote) от греческого слова «barue» – тяжелый, а в дальнейшем изменил название на барит (baryte). Под этим названием бариевая земля фигурировала в учебниках химии конца 18 – начала 19 вв. Так, например, в учебнике А.Л.Лавуазье (1789) барит входит в список солеобразующих землистых простых тел, причем приводится и другое название барита – «тяжелая земля» (terre pesante, лат. terra ponderosa). Содержащийся в минерале неизвестный пока металл стали называть барием (лат. – Barium). В русской литературе 19 в. также употреблялись названия барит и барий. Следующим известным минералом бария стал природный карбонат бария, открытый в 1782 Витерингом и названный впоследствии в его честь витеритом. Металлический барий был впервые получен англичанином Гэмфри Дэви в 1808 путем электролиза влажного гидроксида бария с ртутным катодом и последующим испарением ртути из амальгамы бария. Следует отметить, что в том же 1808 несколько раньше Дэви амальгаму бария получил шведский химик Йенс Берцелиус. Несмотря на свое название, барий оказался сравнительно легким металлом с плотностью 3,78 г/см3, поэтому в 1816 английский химик Кларк выступил с предложением отклонить название «барий» на том основании, что если бариевая земля (оксид бария) действительно тяжелее других земель (оксидов), то металл, наоборот, легче других металлов. Кларк хотел назвать этот элемент плутонием в честь древнеримского бога, властителя подземного царства Плутона, однако это предложение не встретило поддержки у других ученых и легкий металл продолжал именоваться «тяжелым».
terra ponderosa). Содержащийся в минерале неизвестный пока металл стали называть барием (лат. – Barium). В русской литературе 19 в. также употреблялись названия барит и барий. Следующим известным минералом бария стал природный карбонат бария, открытый в 1782 Витерингом и названный впоследствии в его честь витеритом. Металлический барий был впервые получен англичанином Гэмфри Дэви в 1808 путем электролиза влажного гидроксида бария с ртутным катодом и последующим испарением ртути из амальгамы бария. Следует отметить, что в том же 1808 несколько раньше Дэви амальгаму бария получил шведский химик Йенс Берцелиус. Несмотря на свое название, барий оказался сравнительно легким металлом с плотностью 3,78 г/см3, поэтому в 1816 английский химик Кларк выступил с предложением отклонить название «барий» на том основании, что если бариевая земля (оксид бария) действительно тяжелее других земель (оксидов), то металл, наоборот, легче других металлов. Кларк хотел назвать этот элемент плутонием в честь древнеримского бога, властителя подземного царства Плутона, однако это предложение не встретило поддержки у других ученых и легкий металл продолжал именоваться «тяжелым».
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
Ba + 2h3O → Ba(OH)2 + h3↑
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария Bah3, который, в свою очередь, с гидридом лития LiH даёт комплекс Li[Bah4].
Реагирует при нагревании с аммиаком:
6Ba + 2Nh4 → 3Bah3 + Ba3N2
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
Ba3N2 + 2CO → Ba(CN)2 + 2BaO
С жидким аммиаком даёт тёмно-синий раствор, из которого можно выделить аммиакат [Ba(Nh4)6], имеющий золотистый блеск и легко разлагающийся с отщеплением Nh4. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
[Ba(Nh4)6] → Ba(Nh3)2 + 4Nh4 + h3
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углём.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Предупреждение
Воздействие вещества на человека бывает опасным.
Барий, его растворимые соли токсичны:
- Отравление наступает при превышении безопасной концентрации.
- Особо опасны растворимые соли. Попадая в ЖКТ, они «высвобождаются». Затем провоцируют паралич сердца и смерть за несколько часов.
- Тяжелое отравление (попадание в организм 0,19-0,49 г растворимых солей металла) влечет смерть в течение 24 часов. 0,79-0,89 г вызывают мгновенную смерть.
- Среди симптомов интоксикации барием – расстройство речи, зрения, походки из-за паралича мышц. Плюс головокружение, одышка, шум в ушах.
На коже, слизистых оболочках металл оставляет химический ожог.
По стандартам РФ, барий относится ко 2-му классу опасности. Кубический дециметр воды (объем 10х10х10 см) не может содержать более 0,7 мг вещества.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора.
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Другие соединения бария.
Нитрат и хлорат (Ba(ClO3)2) бария – составная часть фейерверков, добавки этих соединений придают пламени ярко-зеленую окраску. Пероксид бария входит в состав запальных смесей для алюминотермии. Тетрацианоплатинат(II) бария (Ba[Pt(CN)4]) светится под воздействием рентгеновских и гамма-лучей. В 1895 немецкий физик Вильгельм Рентген, наблюдая свечение этого вещества предположил существование нового излучения, названного впоследствии рентгеновским. Сейчас тетрацианоплатинатом(II) бария покрывают светящиеся экраны приборов. Тиосульфат бария (BaS2O3) придает бесцветному лаку жемчужный оттенок, а, смешав его с клеем, можно добиться полной имитации перламутра.
Пероксид бария входит в состав запальных смесей для алюминотермии. Тетрацианоплатинат(II) бария (Ba[Pt(CN)4]) светится под воздействием рентгеновских и гамма-лучей. В 1895 немецкий физик Вильгельм Рентген, наблюдая свечение этого вещества предположил существование нового излучения, названного впоследствии рентгеновским. Сейчас тетрацианоплатинатом(II) бария покрывают светящиеся экраны приборов. Тиосульфат бария (BaS2O3) придает бесцветному лаку жемчужный оттенок, а, смешав его с клеем, можно добиться полной имитации перламутра.
Применение
Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов, а также купрат бария, применяются для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, BaO — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, BaO — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Применение в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Применение в промышленности и науке.
Применение металлического бария весьма ограничено из-за его высокой химической активности, соединения бария используются гораздо шире. Сплав бария с алюминием – сплав альба, содержащий 56% Ba – основа геттеров (поглотителей остаточных газов в вакуумной технике). Для получения собственно геттера барий испаряют из сплава, нагревая его в вакуумированной колбе прибора, в результате на холодных частях колбы образуется «бариевое зеркало». В небольших количествах барий используется в металлургии для очистки расплавленных меди и свинца от примесей серы, кислорода и азота. Барий добавляют в типографские и антифрикционные сплавы, сплав бария с никелем используется для изготовления деталей радиоламп и электродов свечей зажигания в карбюраторных двигателях. Кроме того, есть нестандартные применения бария. Одно из них – создание искусственных комет: выпущенные с борта космического аппарата пары бария легко ионизируются солнечными лучами и превращаются в яркое плазменное облако. Первая искусственная комета была создана в 1959 во время полета советской автоматической межпланетной станции «Луна-1». В начале 1970-х германские и американские физики, проводя исследования электромагнитного поля Земли, выбросили над территорией Колумбии 15 килограмм мельчайшего порошка бария.
Сплав бария с алюминием – сплав альба, содержащий 56% Ba – основа геттеров (поглотителей остаточных газов в вакуумной технике). Для получения собственно геттера барий испаряют из сплава, нагревая его в вакуумированной колбе прибора, в результате на холодных частях колбы образуется «бариевое зеркало». В небольших количествах барий используется в металлургии для очистки расплавленных меди и свинца от примесей серы, кислорода и азота. Барий добавляют в типографские и антифрикционные сплавы, сплав бария с никелем используется для изготовления деталей радиоламп и электродов свечей зажигания в карбюраторных двигателях. Кроме того, есть нестандартные применения бария. Одно из них – создание искусственных комет: выпущенные с борта космического аппарата пары бария легко ионизируются солнечными лучами и превращаются в яркое плазменное облако. Первая искусственная комета была создана в 1959 во время полета советской автоматической межпланетной станции «Луна-1». В начале 1970-х германские и американские физики, проводя исследования электромагнитного поля Земли, выбросили над территорией Колумбии 15 килограмм мельчайшего порошка бария. Образовавшееся плазменное облако вытянулось вдоль линий магнитного поля, позволив уточнить их положение. В 1979 струи бариевых частиц использовали для изучения полярного сияния.
Образовавшееся плазменное облако вытянулось вдоль линий магнитного поля, позволив уточнить их положение. В 1979 струи бариевых частиц использовали для изучения полярного сияния.
Воздействие на человека
Несмотря на активное использование бария в самых разных сферах, его биологическая роль пока мало изучена. К жизненно важным микроэлементам он не относится. Напротив, его воздействие на человеческий организм может быть смертельным.
В медицине применяется исключительно бариевый сульфат — это соединение нетоксично и нерастворимо. Что касается бариевых соединений, которые растворяются в воде, то их главная особенность — высокая токсичность. Абсолютно все они ядовиты и губительны для человеческого организма.
В зависимости от степени отравления бариевыми соединениями, человек может умереть всего за несколько часов (максимальный срок наступления летального исхода при сильном отравлении — сутки), поэтому крайне важно соблюдать максимальную осторожность при контакте с такими веществами и использовать их только по прямому назначению.
Свойства бария (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Барий |
| 102 | Прежнее название | |
| 103 | Латинское название | Barium |
| 104 | Английское название | Barium |
| 105 | Символ | Ba |
| 106 | Атомный номер (номер в таблице) | 56 |
| 107 | Тип | Металл |
| 108 | Группа | Щёлочноземельный металл |
| 109 | Открыт | Карл Вильгельм Шееле и Иоганн Готлиб Ган, Швеция, 1774 г. |
| 110 | Год открытия | 1774 г. |
| 111 | Внешний вид и пр. | Мягкий, вязкий, ковкий металл серебристо-белого цвета. Ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-барий с кубической объёмно-центрированной кристаллической решёткой, – β-барий |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,034 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00027 % |
| 124 | Содержание в организме человека (по массе) | 0,00003 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 137,327(7) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O8 P2 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 253 пм |
| 205 | Эмпирический радиус атома* | 215 пм |
| 206 | Ковалентный радиус* | 215 пм |
| 207 | Радиус иона (кристаллический) | Ba2+ 149 (6) пм, 156 (8) пм, 166 (10) пм, 175 (12) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 268 пм |
| 209 | Электроны, Протоны, Нейтроны | 56 электронов, 56 протонов, 81 нейтрон |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | +1, +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 0,89 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 502,85 кДж/моль (5,2116646(12) эВ) |
| 305 | Электродный потенциал | Ba2+ + 2e– → Ba, Eo = -2,905 В |
| 306 | Энергия сродства атома к электрону | 13,954(6) кДж/моль (0,14462(6) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 3,51 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 3,338 г/см3 (при температуре плавления 727 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 727 °C (1000 К, 1341 °F) |
| 403 | Температура кипения* | 1845 °C (2118 K, 3353 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 7,12 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 142 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,209 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 28,07 Дж/(K·моль) |
| 411 | Молярный объём | 39,1245 см³/моль |
| 412 | Теплопроводность | 18,4 Вт/(м·К) (при стандартных условиях), 18,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-барий |
| 512 | Структура решётки | Кубическая объёмно-центрированная |
| 513 | Параметры решётки | 5,020 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-39-3 |
Примечание:
205* Эмпирический радиус бария согласно [1] и [3] составляет 222 пм.
206* Ковалентный радиус бария согласно [1] и [3] составляет 215±11 пм и 198 пм соответственно.
401* Плотность бария согласно [3] и [4] составляет 3,5 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 3,76 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления бария согласно [3] составляет 728,85 °C (1002 K, 1343,93 °F).
403* Температура кипения бария согласно [3] и [4] составляет 1636,85 °C (1910 K, 2978,33 °F) и 1860 °C (2133,15 K, 3380 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) бария согласно [3] и [4] составляет 7,66 кДж/моль и 8,66 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) бария согласно [4] составляет 150,9 кДж/моль.
410* Молярная теплоёмкость бария согласно [3] составляет 28,1 Дж/(K·моль).
§ 13. СОЕДИНЕНИЯ БАРИЯ. Токсикологическая химия.
 В.Ф. Крамаренко
В.Ф. КрамаренкоПрименение и токсичность соединений бария. Из соединений бария токсикологическое значение имеют его гидроксид, хлорид, нитрат, карбонат, хлорат и др.
Гидроксид бария, (баритовая вода) применяется в стекольном производстве и в производстве керамических изделий. Хлорид бария используется в кожевенной промышленности, в сельском хозяйстве для уничтожения вредителей растений. Карбонат бария применяется для уничтожения грызунов, а также в керамическом и стекольном производствах. Отмечены случаи отравлений людей карбонатом бария, содержащемся в качестве примеси в сульфате бария. При наличии этой примеси в сульфате бария, применяемом для рентгеноскопии желудка, под влиянием соляной кислоты желудочного сока происходит растворение карбоната бария с образованием хлорида бария, который всасывается в кровь и вызывает отравление. Нитрат и хлорат бария применяются в пиротехнике. Ацетат бария нашел применение в ситценабивном производстве. Ряд соединений бария применяется в качестве реактивов.
Растворимые соединения бария, поступившие в организм через пищевой канал, всасываются в желудке и вызывают отравление.
Проникновению в кровь растворимых в воде соединений бария препятствуют находящиеся в желудке сульфаты некоторых металлов. При этом образуется нерастворимый сульфат бария, не проникающий в кровь из желудка.
Соединения бария раздражают слизистые оболочки пищевого канала. При отравлениях соединениями бария может наступить перерождение печени. Смерть от соединений бария наступает в результате сердечно-сосудистой недостаточности. Патологоанатомическая картина отравлений барием не характерна.
Соединения бария выделяются из организма главным образом через кишки. Следы этих соединений выводятся через почки и частично откладываются в костях. Сведения о содержании бария как нормальной составной части клеток и тканей организма в литературе отсутствуют.
Исследование минерализатов на наличие бария
В химико-токсикологическом анализе для обнаружения соединений бария используется осадок BaSO
4, который может быть в минерализатах, полученных после разрушения биологического материала смесью серной и азотной кислот или смесью серной, азотной и хлорной кислот. Кроме осадка сульфата бария в мине-рализате может быть и осадок сульфата свинца. В ряде случаев осадки сульфатов бария и свинца могут быть загрязнены небольшим количеством ионов железа, меди, цинка, кадмия, олова, хрома и др. Эти примеси можно удалить из осадков промыванием их серной кислотой и водой. При наличии в осадке примесей ионов олова их удаляют промыванием осадка соляной кислотой.
Кроме осадка сульфата бария в мине-рализате может быть и осадок сульфата свинца. В ряде случаев осадки сульфатов бария и свинца могут быть загрязнены небольшим количеством ионов железа, меди, цинка, кадмия, олова, хрома и др. Эти примеси можно удалить из осадков промыванием их серной кислотой и водой. При наличии в осадке примесей ионов олова их удаляют промыванием осадка соляной кислотой.
Исследование осадка сульфата бария производят после отделения его от осадка сульфата свинца. Для разделения этих осадков их обрабатывают горячим раствором ацетата аммония, подкисленным уксусной кислотой. Для приготовления этого раствора берут 50 мл насыщенного раствора ацетата аммония, прибавляют 3 мл ледяной уксусной кислоты и 47 мл воды.
Осадок смеси сульфатов бария и свинца промывают 15—20 мл 0,2 н. раствора серной кислоты, а затем 10 мл воды. Промытый осадок на фильтре 2—3 раза обрабатывают горячим раствором ацетата аммония, подкисленным уксусной кислотой. При этом осадок сульфата бария остается на фильтре, а осадок сульфата свинца переходит в раствор (см. гл. VI, § 14).
гл. VI, § 14).
В зависимости от величины осадка для растворения сульфата свинца берут 5—6 мл раствора ацетата аммония. При малых количествах осадка используется 1—2 мл указанного раствора.
Оставшийся на фильтре осадок используют для исследования его на наличие бария. С этой целью производят перекристаллизацию этого осадка в концентрированной серной кислоте, переводят указанный осадок в сульфид бария, а затем в иодат бария.
Перекристаллизация осадка сульфата бария.
Часть исследуемого осадка наносят на предметное стекло и слегка подсушивают. Затем к осадку прибавляют 2—3 капли концентрированной серной кислоты и нагревают до появления белых паров БОз. При нагревании серная кислота не должна растекаться на предметном стекле. Если в осадке находится сульфат бария, то через 10—20 мин после охлаждения смеси на предметном стекле появляются бесцветные кристаллы, имеющие форму прямоугольников с вытянутыми углами или форму линз, собранных в виде крестов. Предел обнаружения: 0,05 мкг бария.
Предел обнаружения: 0,05 мкг бария.
Реакция восстановления сульфата бария.
BaS + 2HCl + 2КIO 3 —> Ва(IO 3 ) 2 + H 2 S + 2KCl
Окрашивание пламени горелки в зеленый цвет и появление на предметном стекле бесцветных призматических кристаллов иодата бария, собранных в виде сфероидов, указывает на наличие бария в исследуемом осадке. Предел обнаружения: 0,03 мкг бария в пробе.
Предел обнаружения: 0,03 мкг бария в пробе.
Обнаружение ионов бария в его соединениях
Объектами исследования на наличие бария могут быть не только органы трупов и биологические жидкости, но и химические соединения этого металла, которые в народном хозяйстве широко используются для борьбы с вредителями сельскохозяйственных культур и для других целей.
Для обнаружения ионов бария в его соединениях применяют реакции с хроматом калия, серной кислотой, родизонатом натрия и др. Следует отметить, что с перечисленными реактивами дают осадки не только ионы бария, но и ионы стронция.
В связи с растворимостью осадка хромата бария в минеральных кислотах прибавляют ацетат натрия:
Образовавшаяся при этой реакции уксусная кислота не растворяет осадка хромата бария. Ионы стронция не мешают этой реакции, так как осадок хромата стронция растворяется в минеральных и уксусной кислотах.
Ионы стронция не мешают этой реакции, так как осадок хромата стронция растворяется в минеральных и уксусной кислотах.
Реакция с серной кислотой. От прибавления к ионам бария серной кислоты или растворимых в воде сульфатов выпадает белый осадок сульфата бария. Этой реакции мешают ионы стронция, которые в указанных условиях тоже дают белый осадок сульфата стронция, который не растворяется в кислотах.
Реакция с родизонатом натрия. Родизонат натрия с ионами бария образует красновато-коричневый осадок:
Этой реакции мешают ионы стронция, которые с родизонатом натрия тоже образуют красновато-коричневый осадок. Однако осадок родизоната стронция растворяется в соляной кислоте, а осадок родизоната бария под влиянием указанной кислоты переходит в нерастворимую кислую соль, имеющую ярко-красную окраску.
Выполнение реакции.
На фильтровальную бумагу наносят каплю нейтрального или слегка кислого раствора анализируемого вещества и прибавляют каплю 0,2 %-го водного раствора родизоната натрия. При этом на бумаге появляется интенсивное пятно красновато-коричневого цвета. От прибавления капли разбавленной соляной кислоты пятно родизоната бария приобретает ярко-красную окраску, а красновато-коричневое пятно родизоната стронция исчезает. Предел обнаружения: 0,25 мкг бария в пробе.
При этом на бумаге появляется интенсивное пятно красновато-коричневого цвета. От прибавления капли разбавленной соляной кислоты пятно родизоната бария приобретает ярко-красную окраску, а красновато-коричневое пятно родизоната стронция исчезает. Предел обнаружения: 0,25 мкг бария в пробе.
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
Напишите уравнения реакций, с которых можно осуществить цепочки превращений
Химия, 2022-03-16 07:24:13, thomsonrubi
Ответ
Ответ разместил: miro4ka4546
Объяснение:
…………………………….
Ответ
Ответ разместил: jdkdjdjjidjdjd
1.а)Ba+2h3O=Ba(OH)2+h3
б)Ba(OH)2+Pb(NO3)2=Pb(OH)2+Ba(NO3)2
2.а)2Na+2h3O=2NaOH+h3
NaOH+HNO3=NaNO3+h3O
б)2K+2h3O=2KOH+h3
2KOH+h3CO3=K2CO3+2h3O
в)2Cu+O2=2CuO
CuO+h3O=Cu(OH)2
Cu(OH)2=CuO+h3O (разлагается при нагревании)
Ответ
Ответ разместил: Софияcatwar
a) Na—NaOH—NaNO3
1)2Na+2h3O=h3+2NaOH
2)NaOH+HNO3=NaNO3+h3O
б)K—KOH—K2CO3
1)2K+2h3O=h3+2KOH
2)2KOH+CO2=h3O+K2CO3
в)Cu—CuO—CuCl2—Cu(OH)2—CuO
1)2Cu+O2=2CuO
2)CuO+2HCl=h3O+CuCl2
3)CuCl2+2KOH=2KCl+Cu(OH)2
4)Cu(OH)2=CuO+h3O
г)Ca—CaO—Ca(OH)2—CaCl2
1)2Ca+O2=2CaO
2)CaO+h3O=Ca(OH)2
3)Ca(OH)2+2HCl=CaCl2+2h3O
д)Zn—ZnO—Zn(NO3)2—Zn(OH)2—ZnSO4
1)2Zn+O2=2ZnO
2)ZnO+2HNO3=Zn(NO3)2+h3O
3)Zn(NO3)2+2KOH=2KNO3+Zn(OH)2
4)Zn(OH)2+h3SO4=2h3O+ZnSO4
e)Ba—Ba(OH)2— Ba(Ch4COO)2
1)Ba+2h3O=h3+Ba(OH)2
2)Ba(OH)2+2Ch4COOH=Ba(Ch4COO)2+2h3O
Ответ
Ответ разместил: Настя789032131
a)1) 2Na + 2h3O = 2NaOH + h3
2) NaOH+HNO3(разб. )=NaNO3+h3O
)=NaNO3+h3O
б) 1) 2K+2h3O=2KOH+h3
2)2KOH+h3CO3=K2CO3+2h3O
в) 1) 2Cu + O2 = 2CuO
2)CuO + 2HCl(разб.) = CuCl2 + h3O
3)CuCl2 + Ca(OH)2 = Cu(OH)2 + CaCl2
4)Cu(OH)2—t=CuO+h3O
г) 1)2Ca+O2= 2CaO
2)CaO + h3O = Ca(OH)2
3)Ca(OH)2+HCl
4)Ca(OH)2 + 2HCl(разб.) = CaCl2 + 2h3O
д) 1) 2Zn+O2=2ZnO
2)ZnO + 2HNO3 = Zn(NO3)2 + h3O
3)Zn(NO3)2 + 2TlOH(разб.) = Zn(OH)2 + 2TlNO3
4) Zn(OH)2+h3SO4=ZnSO4+2h3O
е) 1) Ba + 2h3O = Ba(OH)2 + h3
2)Ba(OH)2+ 2Ch4COOH= Ba(Ch4COO)2+2h3O
Ответ
Ответ разместил: ishoeva
а) 2Na + 2h3O = 2NaOH + h3
2NaOH + Mg(NO3)2 = 2NaNO3 + Mg(OH)2
б) 2KOH + MgCO3 = K2CO3 + Mg(OH)2
в) CuO + 2HCl = CuCl2 + h3O
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
г) CaO + 2h3O = Ca(OH)2 + h3O
Ca(OH)2 + 2HCl = CaCl2 + 2h3O
д) ZnO + 2HNO3 = Zn(NO3)2 + h3O
Zn(NO3)2 + 2NaOH = Zn(OH)2 + 2NaNO3
Ответ
Ответ разместил: мадя21
Объяснение:
1)Ba+2h3O=Ba(OH)2+h3
2)2Fe+6h3O=2Fe(OH)3+3h3
a)Na-NaOH-NaNO3
2Na+2h3O=2NaOH+h3
2Na+2HNO3=2NaNO3+h3
б)Cu-CuO-CuCl2-Cu(OH)2-CuO
Cu+O=CuO
CuO+2HCl=CuCl2+h3O
CuCl2+2h3O=Cu(OH)2+2HCl
Cu(OH)2=CuO+h3O
Ответ
Ответ разместил: lisaezhikova
решение задания по химии
Другие вопросы по: Химия
Втреугольнике авс угол с = 90 градусов, синус а = 3/4, ас = 6√7. найдите ав…
найдите ав…
Опубликовано: 26.02.2019 20:50
Ответов: 3
От чего легче избавиться в стаде кур-от рецессивного признака листовидного гребня или доминантного-оперенных ног?…
Опубликовано: 01.03.2019 00:40
Ответов: 2
Какую работу совершают пороховые газы для пули 9 гр. скорость 600 м/с…
Опубликовано: 02.03.2019 12:10
Ответов: 1
Первая машинистка перепечатает рукопись за 4 ч, а вторая, которая за 1 ч перепечатывает на 3 страницы меньше, чем первая, перепечатает ту же рукопись за 6 ч. сколько страниц в руко…
Опубликовано: 03.03.2019 00:00
Ответов: 3
Здвох міст назустріч одне одному виїхали мотоциклист і велосипедист швидкість мотоцикліста 64км год а велосипедиста у 4 рази менше вони зустрілися через 4 години яка відстань між м…
Опубликовано: 03.03.2019 09:40
Ответов: 2
Учеловека ген длинных ресниц доменирует над геном коротких ресниц. женщина с длинными ресницами, у отца которой были короткие ресницы, вышла замуж за мужчину с короткими ресницами….
женщина с длинными ресницами, у отца которой были короткие ресницы, вышла замуж за мужчину с короткими ресницами….
Опубликовано: 03.03.2019 09:40
Ответов: 1
Популярные вопросы
.(Олегу а лет, а света на 6 лет старше. во сколько раз олег младше светы)….
Опубликовано: 28.02.2019 14:50
Ответов: 3
Решить неравенство sqrt(5-4*x- x ²) *( x ²-2*x-3)…
Опубликовано: 28.02.2019 23:10
Ответов: 3
Вкаком слове верно выделена буква, обозначающая ударный гласный звук? процент эксперт занял оптовый?…
Опубликовано: 03.03.2019 02:20
Ответов: 2
Какое проверочное слово к слово трактористы. скажите?…
Опубликовано: 03.03.2019 02:40
Ответов: 3
Геологи маршрут длиной 75км. в первый день они всего маршрута, а во второй 4/25 всего маршрута. какой путь геологи за эти два дня?…
какой путь геологи за эти два дня?…
Опубликовано: 03.03.2019 08:50
Ответов: 2
Для ремонта квартиры купили 8 рулонов обоев, длиной по 10м 50см. израсходовали три четрёртых части купленных рулонов обоев. сколько метров обоев осталось? напишите пойжалусто по де…
Опубликовано: 03.03.2019 16:50
Ответов: 2
Ведро вмещает в себя 6 литров бензина. в такое же ведро вместо бензина, налито равное ( по массе) количество дёгтя. сколько литров дёгтя налито в ведро, если масса 1 литра бензина…
Опубликовано: 03.03.2019 19:20
Ответов: 3
Решить уравнение корень из 3tg2x+1=0…
Опубликовано: 03.03.2019 23:30
Ответов: 2
1.прочитайте. поставьте вопросы к прилагательным, укажите их падеж и род. мой брат рассказывал, как однажды ранним зимним утром вышел он из лесной избушки и на морозе сразу почувст.
Опубликовано: 04.03.2019 12:50
Ответов: 2
Рассмотрите на задней обложке тетради реконструкцию древнегреческой статуи богини. выполните и ответьте на вопросы. до наших дней статуя не сохранялась. её вид воссоздан по древним…
Опубликовано: 06.03.2019 17:50
Ответов: 2
Больше вопросов по предмету: Химия Случайные вопросы
Реакция нитрата бария сульфат калия
Запишите молекулярные и ионные уравнения реакций…
Нитрат бария + сульфат калия > сульфат бария + нитрат калия
Ba(NO3)2 +K2SO4=BaSO4+2KNO3
Якобы образуется карбонат бария, который легко перевести в нитрат. Якобы решающую роль в этой реакции играет … У Чувырина во втором томе, на 19 странице написано, что кипячением сульфата бария с карбонатом калия удается получить…
7. Вещество, которое в водном растворе полностью диссоциирует: А. оксид меди (II) Б. нитрат калия В. сульфат бария.

Нитрат калия KNO3<—>K(+)+NO3(-).
Напишите формулы следующих солей сульфата калия, нитрата бария, карбоната натрия, ортофосфата кальция, сульфата цинка, сульфида железа, хлорида … реакции взаимодействия карбоната бария с кремнеземом в присутствии водяного пара.
Нитрат калия, сульфит калия, сульфат калия, хлорид бария-выбрать то, которое не вступает в обменные реакции с остальными
Нитрат калия
Д нитрат калия фосфат натрия е сульфат цинка сульфид натрия. 4. Взаимодействие растворов солей с металлами.15 октября 2015
Сульфат калия + нитрат бария. как проводить єкспермент, есть ли катализатор, что куда добавлять, Формула не нужна
Это же качественная реакция, слить два раствора, осадок и выпадет, без всяких катализаторов.
Запишите молекулярные и ионные уравнения реакций, между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария.В чем суть обеих реакций? помогите решить. огромное спасибо…
Сколько грамм соли находиться в растворе после сливания растворов содержащих 2моль нитрата бария и 2моль сульфата калия.

404 грамм
2 сульфата калия и нитрата бария. … 2. Реакция обмена между растворами соляной кислоты и гидроксида бария проходит до конца за сч т взаимодействия ионов.15 апреля 2014
Вычислите массу сульфата бария выпадающего в осадок при сливании 522 г раствора нитрата бария и 522г сульфата калия
Http://lib.znate.ru/docs/index-206576.html?page=3
только измени цифры
Напишите уравнения возможных реакций между следующими веществами а нитратом серебра и хлоридом калия … д гидроксидом бария и сульфатом натрия. 3. Вычислите массу осадка, который образовался при взаимодействии растворов…
Какая масса осадка образуется при взаимодействии избытка раствора нитрата бария с 34,8 г раствора сульфата калия с
Нуу, где-то с пол-рюмки.
Вычислите массу осадка, который образовался при взаимодействии 522 г. Нитрата бария и 500 г. Сульфата калия. … Ba NO3 2 K2SO4— gt 2KNO3 BaSO4 Сначала определим сколько.молей того и другого вещества взяли для реакции n Ba NO3 2. ..
..
Помогите составить уравнения реакций
h3SO4+BaCL2=BaSO4( осадок) +2HCL
Na2SO4+Ba(NO3)2=BaSO4(осадок) +2NaNO3
K2SO4+NaNO3=реакция не идет
HCL+NaOH=NaCL+h3O
h3SO4+2NaOH=Na2SO4+2h3O
HCL+NaNO3=реакция не идет
это не меняет дела, реакция необратима, когда в результате образуется осадок, газ или малодиссоциирующее вещество (вода), так что все реакции, кроме последней подходят под ваш вопрос.
Рассчитайте, останется ли в растворе сульфат меди II после того, как закончится реакция. … 50. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г 15 % -ного раствора нитрата бария.
Абсолютно верно Вам все реакции написали. Только в 3-ей реакции требовалось записать уравнение реакции сульфата калия с нитратом натрия, а не нитратом бария.
K2SO4+2NaNO3=2KNO3+Na2SO4 (обе соли растворимы в воде. Осадка не образуется, поэтому следует ставить не знак равенства, а 2 разнонаправленные стрелочки) . Удачи!
Какая.
 масса.осадка.образуется при взаимодействии избытка раствора нитрата бария с 34,8 г раствора сульфата калия с массо
масса.осадка.образуется при взаимодействии избытка раствора нитрата бария с 34,8 г раствора сульфата калия с массоК2SO4+Ba(NO3)2=BaSO4 + 2KNO3
Ну раз не дописал условие, решай сам
Напишите уравнения реакций, с помощью которых можно осуществить цепочки превращений веществ а Барий гидроксид бария-нитрат бария-сульфат … д калий — гидроксид калия — хлорид калия — нитрат калия — сульфат калия — нитрат калия.
Как распознавать: сульфат цинка,нитрат бария,гидроксид калия, не используя реактивы?… …
Нитрат бария = сульфат калия.. плиииз,уравните реакцию ,и плииз укажите тип реакции)помогитее
Уравнение реакций между сульфатом калия и нитратом бария
K2SO4 + Ba(NO3)2 = 2KNO3 + BaSO4(осадок)
5. Необратимо протекает реакция ионного обмена между растворами1 серной кислоты и хлорида бария 2 сульфата натрия и карбоната калия 3 нитрата кал.
Расчитайте массу осадка в которой образуется привзаимодействии 200 гр. нитрата бария и 200гр. сульфата калия! помогите
Кульно)
1. нитратом бария и сульфатом калия 2. карбонатом калия и азотной кислотой. 2 К сокращенному ионному уравнению реакции подберите молекулярное.
нитратом бария и сульфатом калия 2. карбонатом калия и азотной кислотой. 2 К сокращенному ионному уравнению реакции подберите молекулярное.
Каким реактивом определяется ион аммония?сульфатом калия, или нитратом серебра,или гидроксидом калия,или хлоридом бария?
Нитратом серебра.
В результате реакции должен выпасть тёмный осадок азотнокислого серебра
Запиши уравнение осуществимых реакций в молекулярном и ионном виде между 1сульфид калия и соляная кислота 2сульфат калия и нитрат бария 3нитрат свинц.
Вещество, при помощи которого можно определить сульфат-ионы в растворе: калия перманганат, лакмус, бария нитрат?
Нитрат бария
Напишите уравнения реакций, с помощью которых можно осуществить цепочки превращений веществ а Барий гидроксид бария-нитрат бария-сульфат … д калий — гидроксид калия — хлорид калия — нитрат калия — сульфат калия — нитрат калия.
Нитрат бария
Нитрат бария
Шите это уравнениескажите пж молекулярное уравнение реакции между сульфатом калия и нитратом бария !!
K2SO4 + Ba(NO3)2 = 2KNO3 + BaSO4
Качественный анализ. 1. Какая реакция на ион калия является наиболее чувствительной? … 11. Какая реакция наиболее характерна для катиона бария? … 1 реакция с гексацианоферратом III калия 2 реакция с сульфидом натрия 3 …
1. Какая реакция на ион калия является наиболее чувствительной? … 11. Какая реакция наиболее характерна для катиона бария? … 1 реакция с гексацианоферратом III калия 2 реакция с сульфидом натрия 3 …
Сульфат бария-белый творожистый осадок (принцип Бертло протекания ионных реакций
Подскажите рецепт матирующей пасты. Есть компоненты. Бифторид аммония, сульфат бария, крахмал. Не знаю пропорции.
С какими из указанных веществ- медь, цинк, карбонат калия, сульфат калия, нитрат серебра(1), хлорид бария-
Вот
Zn + 2HCl = ZnCl2 + h3
K2CO3 + 2HCl = 2KCl + CO2 + h3O
AgNO3 + HCl = AgCl + HNO3
Реакция ионного обмена идет до конца между веществами 1 сульфатом калия и соляной кислотой 2 … Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между растворами сульфата цинка и нитрата бария равны 1 …
Срочно, нужна помощь по химии. Дайте название каждой соли Ba(NO3)2, K2SO4, Ca3(PO4)2, CaSiO3, NaF.
1)нитрат бария (или азотнокислый барий, либо бариевая селитра) ;
2)сульфат калия (или сернокислый калий) ;
3)(орто) фосфат кальция;
4)(мета) силикат кальция (или кремнекислый кальций) ;
5)фторид натрия.
Составьте ионное и молекулярное уравнение реакции серной кислоты с медью, цинком,карбоната калия, сульфатом калия, нитрата серебра, хлорида бария!
Как определить с помощью одного реактива сульфат алюминия, сульфат калия, сульфат магния?
Напишите формулы следующих солей:…
Я один прочитал в первый раз «соплей»?
Какая масса осадка образуется при взаимодействии избытка раствора нитрата бария с 34,8 г раствора сульфата калия с массовой долей растворенного веществ 5%?
Растворы и состояния вещества
Все ресурсы AP Chemistry
6 Диагностические тесты 225 практических тестов Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 … 10 11 12 13 14 15 16 17 18 Следующая →
AP Chemistry Help » Растворы и состояния вещества
Рассмотрим следующее сбалансированное уравнение диссоциации гидроксида бария в водном растворе.
К раствору добавляют 1М раствор нитрата бария. Какова растворимость гидроксида бария после этого добавления?
Какова растворимость гидроксида бария после этого добавления?
Возможные ответы:
Правильный ответ:
Пояснение:
Прежде чем решать вопрос о растворимости, вспомним принцип Ле Шателье. Нитрат бария представляет собой растворимую соль, которая полностью растворяется в растворе. Это означает, что перед растворением соли будет существовать одномолярная концентрация ионов бария. Поскольку мы добавили к продуктам реакции, мы можем предсказать, что равновесие будет смещено влево, и гидроксид бария будет менее растворим. Это изменение равновесия называется эффектом обычного иона.
Мы будем использовать таблицу ICE для определения растворимости соли.
I. Прежде чем соль начнет растворяться, в растворе имеется одномолярная концентрация ионов бария (из нитрата бария) без ионов гидроксида.
C. Поскольку каждая растворенная молекула гидроксида бария дает один ион бария и два гидроксид-иона, неизвестное увеличение каждого иона можно обозначить и соответственно. Обратите внимание, как увеличение иона бария будет добавлено к ранее добавленной одномолярной концентрации в растворе.
Поскольку каждая растворенная молекула гидроксида бария дает один ион бария и два гидроксид-иона, неизвестное увеличение каждого иона можно обозначить и соответственно. Обратите внимание, как увеличение иона бария будет добавлено к ранее добавленной одномолярной концентрации в растворе.
E. Теперь приравняем выражение растворимости к константе произведения растворимости.
Поскольку 1 намного больше, чем значение, которое мы получим для , мы можем считать значение в выражении для иона бария пренебрежимо малым. Это позволяет нам упростить уравнение до следующей установки.
Растворимость гидроксида бария без эффекта общего иона составляет 0,108 М. Обратите внимание, как уменьшилась растворимость соли, как это было предсказано вначале принципом Ле Шателье.
Сообщить об ошибке
У химика есть полностью насыщенный раствор химического вещества X, на дне которого находится твердое вещество X. Если она добавит химическое вещество, которое будет реагировать с водным X, что произойдет с твердым веществом?
Возможные ответы:
Из раствора выпадет больше твердого вещества
Слой осадка покроет твердое вещество
Твердое вещество изменит цвет
Ничего не изменится
Оно начнет растворяться в растворе
Правильный ответ:
Начнет растворяться в растворе
Пояснение:
Полностью насыщенный раствор находится в равновесии между твердым и водным состояниями, но это динамическое равновесие. По мере того, как реагирующий химикат реагирует с водным раствором X, все больше и больше твердого вещества будет растворяться в растворе.
По мере того, как реагирующий химикат реагирует с водным раствором X, все больше и больше твердого вещества будет растворяться в растворе.
Сообщить об ошибке
Парциальное давление произвольного газа в закрытой камере с бассейном с водой составляет 7,2 атм при 298К.
Константа закона Генри для .
Какова растворимость ?
Возможные ответы:
Ни один из доступных ответов
Правильный ответ: 5
Объяснение: Закон Генри может быть выражен: Где – постоянная закона Генри, а – парциальное давление газа над раствором. Мы можем подставить наши данные в это уравнение: Сообщить об ошибке Какова формула диссоциации ? Возможные ответы: Нет доступных ответов
Пояснение: состоит из двух типов ионов и . Сообщить об ошибке Рассмотрим следующее сбалансированное уравнение для растворимости гидроксида бария в водном растворе. Каково выражение равновесия для уравновешенной реакции? Возможные ответы: Правильный ответ: Пояснение: Записывая выражение равновесия для нерастворимой соли, помните, что в выражение не входят чистые твердые вещества и жидкости. Кроме того, коэффициенты для соединений в сбалансированной реакции становятся показателями для соединений в выражении равновесия. Учитывая обобщенную химическую реакцию, мы можем определить выражение константы равновесия. В нашей реакции реагент представляет собой чистое твердое вещество и не учитывается при расчете равновесия. Сообщить об ошибке Какое из показанных соединений наименее растворимо в воде? Возможные ответы: Правильный ответ: Объяснение: В этом вопросе нам предлагается определить соединение, которое наименее растворимо в воде-растворителе. предполагается растворимым, поскольку он поляризован. С неподеленной электронной парой на атоме азота и большой разницей электроотрицательности между азотом и каждым из трех атомов водорода аммиак легко растворяется в воде. Аналогичным образом ожидается, что он растворяется в воде, поскольку может ионизироваться. После растворения в воде может диссоциировать, превращаясь в и . И поскольку каждая из этих молекул несет заряд и, таким образом, очень стабилизирована в полярной среде, которую обеспечивает вода, процесс диссоциации чрезвычайно благоприятен. Практически по тем же причинам растворим в воде. Он может диссоциировать на один и два, благодаря чему легко растворяется в воде. А как насчет ? Разница в электроотрицательности между углеродом и хлором велика, поэтому ожидается, что соединение будет полярным, верно? Ну, не совсем так. Сообщить об ошибке Учитывать растворимость соединения . Если растворимость этого соединения представлена , то что из следующего равно константе произведения растворимости для ? Возможные ответы: Правильный ответ: Объяснение: В этом вопросе нам дается растворимость данного соединения, и нас просят определить константу произведения растворимости этого соединения. При решении задач на равновесие, связанных с растворимостью, полезно составить таблицы «ICE», которые обозначают начальное состояние, изменение и равновесие. Это означает, что начальные концентрации записываются в первой строке, затем изменение концентрации в следующей строке, а затем они суммируются в последней строке равновесия. Для начала напишем равновесное выражение для диссоциации этого соединения. Далее мы создаем таблицу ICE, как показано на рисунке ниже. Обратите внимание, что мы добавили один для свинца, но для хлорида. Это связано с тем, что образуется один свинец, но образуется два хлорида, как показано в реакции. Также обратите внимание, что мы не включаем концентрацию твердого тела. Следующим шагом будет запись выражения для константы равновесия. Помните, что твердые тела не появляются в выражении. Следующим шагом является вставка значений из таблицы ICE в это выражение. Наконец, нам просто нужно упростить выражение до следующего. Сообщить об ошибке Что из следующего будет осадком в следующей реакции? 2KCl + Ca(OH) 2 → 2KOH + CaCl 2 Possible Answers: CaCl 2 Ca Ca(OH) 2 KOH Не образует осадка Правильный ответ: Не образует осадка Объяснение: Хотя растворимость гидроксида кальция Ca(OH) 2 довольно низкая, он является реагентом и не образует осадка. Твердый гидроксид кальция добавляют к водному раствору хлорида калия KCl. Во время реакции гидроксид кальция превратится в гидроксид калия (KOH) и хлорид кальция (CaCl 2 ), оба из которых полностью растворимы. В конце реакции осадка не наблюдается. Сообщить об ошибке растворен в воде. Какая из следующих солей даст осадок при добавлении к раствору сульфата серебра? Возможные ответы: Правильный ответ: Объяснение: Этот вопрос требует понимания принципов растворимости и того, какие комбинации ионов приведут к образованию осадков. Если хлорид натрия растворяется в этом растворе, катионы серебра и анионы хлора объединяются, в результате чего образуется белый кристаллический осадок хлорида серебра. Сообщить об ошибке Какое из следующих соединений не растворяется в воде? Возможные ответы: Правильный ответ: Пояснение: Ключом к растворимости является запоминание правил растворимости. Мы знаем, что все соединения щелочных металлов растворимы. К ним относятся калий, литий и натрий, исключая три ответа. Мы также знаем, что растворимы все хлоридные соли, кроме солей серебра, свинца и ртути. Все гидроксидные соединения обычно нерастворимы, но соли щелочных металлов и аммония сделают их растворимыми. Щелочноземельные металлы делают гидроксиды малорастворимыми. Сообщить об ошибке ← Назад 1 2 … 10 11 12 13 14 15 16 17 18 Далее → Уведомление об авторских правах 6
225 практических тестов
Вопрос дня
Карточки
Учитесь по концепции Барий — это элемент с атомным номером 56. Он обозначается буквой «Ba». Это пятый элемент группы II, который является щелочноземельным металлом. Барий в свободном состоянии в природе не встречается из-за его высокой реакционной способности. Барий является сильным основным оксидом, его степень окисления +1, +2. Что такое азот? Азот — это элемент с атомным номером 7. Что такое кислород? Кислород — это элемент с атомным номером 8. Он обозначается буквой «О». Это элемент группы халькогенов, высокореактивный неметалл. Кислород является сильным окислителем и имеет степень окисления -2, -1, 0, +1, +2. Нитрат бария представляет собой неорганическое соединение, также известное как динитрат бария, нитробарит или даже соль бария. Соль бария обычно находится в кристаллическом состоянии белого цвета. Соединение является негорючим по своей природе. Но, при использовании в качестве окислителя, горит зеленым пламенем и может взорваться из-за длительного воздействия пламени. Соединение нитрата бария образуется путем соединения двух частей нитрата и одной части бария. Молекулярная формула нитрата бария = Ba(NO 3 ) 2 Структурная формула соединения дает позиционную структуру атомов в состав. Структура нитрата бария указана как Свойства нитрата бария Производство нитрата бария может осуществляться двумя различными способами. Процессы инициируются исходными компонентами бария. Процесс I В первом процессе в качестве источника используется карбонат бария. Для производства нитрата бария следуют следующие этапы; Процесс II Во втором процессе в качестве источника используется сульфид бария. Для производства нитрата бария сульфид бария (BaS) смешивают с азотной кислотой (HNO 3 ). А при высоких температурах нитрат бария разлагается на оксид бария, нитрит и кислород. 2Ba(NO 3 ) 2 => 2BaO + 2NO 2 + O 2 Использование нитрата бария Вопрос 1. Каков показатель преломления нитрата бария? Ответ: Показатель преломления нитрата бария равен 1,565. Вопрос 2. Какая реакция протекает при разложении нитрата бария? Ответ: Когда допускается высокая температура нитрата бария(Ba(NO 3 ) 2 ), он разлагается на оксид бария, нитрит и кислород. 2Ba(NO 3 ) 2 =>2BaO + 4NO 2 + O 2 Вопрос 3. Каково влияние нитрата бария на здоровье человека? Ответ: Нитрат бария влияет на здоровье человека: Вопрос 4. Назовите взрывчатое вещество, в котором используется нитрат бария. Ответ: Нитрат бария используется в заряде ВВ «SR 365». Вопрос 5. Перечислите стадии производства нитрата бария. Ответ: Этапы производства нитрата бария: Вопрос 6. Что произойдет, если азотнокислый барий будет подвергаться длительному воздействию пламени? Ответ: Нитрат бария является негорючим веществом, но способствует процессу горения горючих веществ. Вопрос 7. Что такое катионы и анионы нитрата бария? Ответ: Нитрат бария состоит из катионов бария Ba 2+ и нитрат-анионов NO 3- . Автор: Ханс-Юрген Шварц 2
 При диссоциации образуется:
При диссоциации образуется: Чтобы иметь возможность ответить на этот вопрос, важно понимать, что, как правило, подобное растворяется в подобном. Другими словами, поскольку вода является полярной молекулой, лучше всего растворяются в воде те соединения, которые сами либо полярны, либо несут суммарный заряд.
Чтобы иметь возможность ответить на этот вопрос, важно понимать, что, как правило, подобное растворяется в подобном. Другими словами, поскольку вода является полярной молекулой, лучше всего растворяются в воде те соединения, которые сами либо полярны, либо несут суммарный заряд. Здесь следует провести очень важное различие. Тот факт, что связь внутри молекулы полярна, не означает, что сама молекула полярна. Конечно, связь между углеродом и хлором действительно полярная. Но помните, нам также необходимо учитывать форму молекулы. представляет собой тетраэдрическую молекулу. В результате каждый из атомов хлора направлен в сторону от центрального атома углерода в форме тетраэдра. Из-за этого все отдельные диполи углерод-хлор (от каждой связи) компенсируют друг друга. В результате этого суммарный дипольный момент этого соединения становится равным нулю и, таким образом, не имеет полярности. А поскольку полярность этого соединения равна нулю, нельзя ожидать, что оно очень хорошо растворится в воде.
Здесь следует провести очень важное различие. Тот факт, что связь внутри молекулы полярна, не означает, что сама молекула полярна. Конечно, связь между углеродом и хлором действительно полярная. Но помните, нам также необходимо учитывать форму молекулы. представляет собой тетраэдрическую молекулу. В результате каждый из атомов хлора направлен в сторону от центрального атома углерода в форме тетраэдра. Из-за этого все отдельные диполи углерод-хлор (от каждой связи) компенсируют друг друга. В результате этого суммарный дипольный момент этого соединения становится равным нулю и, таким образом, не имеет полярности. А поскольку полярность этого соединения равна нулю, нельзя ожидать, что оно очень хорошо растворится в воде.

 Практически все ионные соединения, содержащие аммоний, натрий и нитраты, растворимы в воде. Большинство ионных соединений, содержащих хлор, растворимы, за исключением катионов серебра, ртути и свинца.
Практически все ионные соединения, содержащие аммоний, натрий и нитраты, растворимы в воде. Большинство ионных соединений, содержащих хлор, растворимы, за исключением катионов серебра, ртути и свинца. Таким образом, хлорид серебра не растворяется.
Таким образом, хлорид серебра не растворяется. Все ресурсы AP Chemistry
Формула нитрата бария. Структура, свойства, применение, примеры вопросов
 Он обозначается буквой «N». Это элемент 15 группы, который является неметаллом. Это самый легкий элемент группы. Азот является сильным кислотным оксидом, и его степень окисления равна -3, -2, -1, 0, +1, +2, +3, +4, +5.
Он обозначается буквой «N». Это элемент 15 группы, который является неметаллом. Это самый легкий элемент группы. Азот является сильным кислотным оксидом, и его степень окисления равна -3, -2, -1, 0, +1, +2, +3, +4, +5. Нитрат бария
Молекулярная формула
 Следовательно, молекулярная формула нитрата бария дается как
Следовательно, молекулярная формула нитрата бария дается как Структурная формула
Процесс производства нитрата бария


Примеры вопросов

 Следовательно, нитрат бария может привести к взрыву при длительном воздействии пламени.
Следовательно, нитрат бария может привести к взрыву при длительном воздействии пламени. Иммобилизация солей — Saltwiki
Содержание
- 1 Бариевый метод
- 1.1 Конверсия гипса
- 1.2 Конверсия сульфата магния
- 2 Обработка гексафторсиликатом свинца
- 3 веб-ссылки
- 4 Литература
Бариевый метод
Так называемый «бариевый» метод основан на том факте, что при добавлении растворимого соединения бария к раствору, содержащему растворимые сульфатные соли, малорастворимый сульфат бария выпадает в осадок и «иммобилизуется» при заданной температуре. крайне низкая растворимость. Однако от противоионов исходного и добавленного соединения бария могут остаться другие растворимые соли. Однако они могут быть менее разрушительными.
Однако они могут быть менее разрушительными.
Конверсия гипса
Вышеупомянутый подход используется для конверсии гипса [1] , в частности, для образования высолов и корок гипса, в сульфат бария. Он использовался в течение нескольких лет [Hammer:1996] Title: Salze und Salzbehandlung in der Konservierung von Wandmalerei und Architekturoberfläche.
Автор: Hammer, Ivo
и доказал свою эффективность при правильном использовании.
Переработка гипса [2] лучше всего выполнять в пять этапов [Matteini:1991] Название: В обзоре: Оценка флорентийских методов сохранения настенной живописи, основанных на использовании минеральных обработок
Автор: Matteini, Мауро
:
1. Растворение гипса
CaSO 4 •2H 2 O + (NH 4 ) 2 CO 3 → (NH 4 )
6 Ca + CO 9 6 4 SO 9 2 0265 3 + 2Н 2 О
Первым этапом является нанесение припарки, содержащей карбонат аммония, на обрабатываемую поверхность. Это приводит к превращению относительно нерастворимого гипса в растворимый сульфат аммония, который частично мигрирует в припарки. Оставшийся сульфат аммония со временем мигрирует и распределяется в материале. В результате реакции также образуется карбонат кальция (кальцит), и это будет иметь консолидирующий эффект. Однако любой кальцит, образующийся на поверхности, должен быть тщательно удален, чтобы избежать отбеливающего эффекта. Любой избыток карбоната аммония разлагается на газообразный аммиак, углекислый газ и воду. Следует учитывать, что карбонат аммония может изменить декоративную роспись, содержащую белковые добавки.
Это приводит к превращению относительно нерастворимого гипса в растворимый сульфат аммония, который частично мигрирует в припарки. Оставшийся сульфат аммония со временем мигрирует и распределяется в материале. В результате реакции также образуется карбонат кальция (кальцит), и это будет иметь консолидирующий эффект. Однако любой кальцит, образующийся на поверхности, должен быть тщательно удален, чтобы избежать отбеливающего эффекта. Любой избыток карбоната аммония разлагается на газообразный аммиак, углекислый газ и воду. Следует учитывать, что карбонат аммония может изменить декоративную роспись, содержащую белковые добавки.
2. Осаждение нерастворимых солей
(NH 4 ) 2 SO 4 + Ba(OH) 2 → BaSO 4 ↓ + 2NH 3 + 6 O 2
5
Вторым этапом является наложение припарки, содержащей гидроксид бария. Растворимый сульфат аммония в субстрате будет реагировать с образованием малорастворимого сульфата бария. Противоионы, гидроксил и аммоний будут испаряться в виде аммиака и воды.
Противоионы, гидроксил и аммоний будут испаряться в виде аммиака и воды.
3. Первая консолидирующая реакция
Ba(OH) 2 + CO 2 → BaCO 3 ↓ + h3O
Любой избыток гидроксида бария будет реагировать с окружающим углекислым газом с образованием карбоната бария. Это имеет консолидирующий эффект.
4. Вторая консолидирующая реакция
Ba(OH) 2 + CaCO 3 → BaCO 3 ↓+ Ca(OH) 2
Поверхность зерен кальцита превращается в гель гидроксида кальция, в то время как карбонат бария может также накапливаться на других кристаллах.
5. Ca(OH) 2 + CO 2 → CaCO 3 ↓+ H 2 O
Любой образовавшийся гидроксид кальция рекарбонатизируется, увеличивая консолидирующий эффект. Реакции 4 и 5 еще недостаточно изучены и требуют дальнейшего изучения.
ВАЖНОЕ ПРИМЕЧАНИЕ:
Метод не следует использовать в присутствии высокой концентрации нитратов или органических связующих . Этот подход не обеспечивает клейкий эффект .
Этот подход не обеспечивает клейкий эффект .
Нитраты приводят к образованию малорастворимого нитрата бария, что приводит к его видимой кристаллизации на поверхности. Органические связующие в темперных или масляных картинах не переносят высокую щелочность гидроксида бария, что приводит к их гидролизу или омылению. Matteini [Matteini:1991] Название: В обзоре: оценка флорентийских методов сохранения настенной живописи, основанных на использовании минеральных обработок
Автор: Маттейни, Мауро
придерживается мнения, что в старых картинах эти органические связующие в значительной степени трансформировались в неорганические соединения, такие как оксалат кальция, и указанные выше реакции не обязательно будут иметь место при использовании этого метода. поэтому можно оправдать.
Преобразование сульфата магния
Аналогичным образом, сульфат магния также может быть преобразован в труднорастворимый сульфат бария и в идеале стать карбонатом магния, обезвреживая повреждающую соль [Friese. etal:1999] Название: Salze im Mauerwerk — Möglichkeiten zur Entsalzung und zur Salzumwandlung
etal:1999] Название: Salze im Mauerwerk — Möglichkeiten zur Entsalzung und zur Salzumwandlung
Автор: Friese, Peter; Проц, А.
.
Обработка гексафторсиликатом свинца
В прошлом для предотвращения миграции солей в свежую штукатурку иногда рекомендовался другой метод преобразования, основанный на использовании гексафторсиликата свинца, при коммерческих реставрационных штукатурках/растворах, который по-немецки называется Sanierputze. Коммерческие реставрационные штукатурки содержат водоотталкивающие вещества, в основном олеат натрия (который вместе с штукатуркой превращается в олеат кальция) или стереат цинка. Гидрофобность штукатурки предотвратит проникновение в нее солей, а значит, прослужит дольше. Следует принять во внимание, что эти коммерческие реставрационные штукатурки были разработаны в основном для старых фермерских домов, стены которых имеют тенденцию пропитываться солями. Штукатурка наносится с обеих сторон, так что соли «запираются» внутри стены, которая остается влажной из-за гигроскопичности солей, но штукатурки остаются сухими из-за своей гидрофобности. Разные производители предлагают различные комбинации. Наиболее важные из них производятся на основе гексафторсиликата свинца. Также предлагаются агенты, содержащие барий.
Разные производители предлагают различные комбинации. Наиболее важные из них производятся на основе гексафторсиликата свинца. Также предлагаются агенты, содержащие барий.
Несмотря на то, что была установлена определенная эффективность обработки, необходимо подчеркнуть, что растворимые соли свинца представляют опасность для рабочей силы и окружающей среды, и их следует избегать. По этой причине следует попытаться добиться того же эффекта (предотвращения быстрой миграции солей в новую штукатурку) за счет использования добавок в штукатурную смесь для уменьшения размеров пор и придания ей гидрофобности. Для этого обычно используют соединения силиката натрия и метилсиликонат/флюат калия, т. е. соли гексафторкремниевой кислоты.
Это уменьшит миграцию соли на поверхность установленного рендера. Однако при применении рендера могут возникнуть некоторые проблемы. В качестве активных ингредиентов
Гексафторсиликат свинца реагирует с сульфатными и хлоридными соединениями в сложных реакциях с образованием множества продуктов, почти все из которых труднорастворимы или нерастворимы.
Реакция может быть следующей:
Na 2 SO 4 (т) + PbSiF 6 (т) → PbSO 4 (ссл)+ 902 )
NA 2 CO 3 (S) + PBSIF 6 (S) → PBCO 3 (IS) + NA 2 SIF 4 66666666666666666666666666666666666666.66666666666666666666666. 2 666666666666666666666666666666666666. 2 . (т) + PbSiF 6 (т) → PbSO 4 (скл) + MgSiF 6 (скл)
2NaCl (т) + PbSiF 6 (т) → PbCl 2 (ссл) + Na 2 SiF 6 (ссл)
(ссл — мало растворим; с — нерастворим; растворим)
Веб-ссылки
- ↑ http://www.fead-gmbh.de/Naturstein%20Gips.html, gesehen 17.01.2011
- ↑ http://www.baufachinformation.de/denkmalpflege.jsp?md=1988017124771, дата публикации 17.01.2011
Литература
[Friese. etal:1999] etal:1999] | Фризе, Питер; Протц, А. (1999): Salze im Mauerwerk — Möglichkeiten zur Entsalzung und zur Salzumwandlung. В: Venzmer, H. (eds.): Entfeuchtung/Entsalzung 10. Hanseatische Sanierungstage FAS — Schriftenreihe Heft 10, 211-230 | ||
| [Hammer:1996] | 9 Hammer (Ivoze Hammer, 6 Salze, | 9): Salzbehandlung in der Konservierung von Wandmalerei und Architekturoberfläche.. В: Pursche, Юрген (ред.): Salzschäden an Wandmalereien, Bayerisches Landesamt für Denkmalpflege , 81-106 | |
| [Matteini:1991] | Matteini, Mauro (1991): Обзор: оценка флорентийских методов сохранения настенной живописи, основанных на использовании минеральных обработок. В: Кэтер, Шарон (ред.): Сохранение настенных росписей: материалы симпозиума, организованного Институтом искусств Кутраулда и Институтом консервации Гетти, Лондон, 13-16 июля 1987 г., Институт консервации Гетти , 137 -148 |
Производитель сульфата бария | Поставщики хлорида бария Экспортер
Каталог
Прейскурант
Как производитель, поставщик, экспортер химических соединений в Индии, Южной Африке, Зимбабве, Мозамбике, Нигерии, Новой Зеландии, Судане, Норвегии, Гане, Уганде, Швеции и многих других странах. мы предоставляем вам лучший ассортимент сульфата бария, карбоната, нитрата бария, хлорида бария, бромида, хромата, гидроксида бария, пероксида бария, оксалата бария, пероксида, ацетата бария и фторида бария с эффективной и своевременной доставкой.
мы предоставляем вам лучший ассортимент сульфата бария, карбоната, нитрата бария, хлорида бария, бромида, хромата, гидроксида бария, пероксида бария, оксалата бария, пероксида, ацетата бария и фторида бария с эффективной и своевременной доставкой.
Ацетат бария
Ацетат бария (Ba(C2h4O2)2) представляет собой соль бария(II) и уксусной кислоты.
Бромид бария
Бромид бария представляет собой химическое соединение с формулой BaBr2. Подобно хлориду бария, он хорошо растворяется в воде и токсичен в водном растворе.
Хромат бария
Этот кристаллический порошок хромата бария желтого цвета содержит химические вещества барий и хром. Это соединение растворимо в кислотах, но нерастворимо в воде. Хромат бария легко воспламеняется. вещество и следует использовать с осторожностью. Технические характеристики этого соединения следующие:
- Формула: BaCrO4
- МВт: 253,35
- Номер CAS: 10294-40-3
- Хромат бария: мин.
 98%
98% - Класс: технический
Карбонат бария
Карбонат бария (BaCO3), также известный как витерит, представляет собой химическое соединение, используемое в крысином яде, кирпичах, керамической глазури и цементе.
Хлорид бария
Чтобы удовлетворить различные требования наших клиентов, мы обеспечиваем хлорид бария.
Характеристики:- Увеличенный срок хранения
- Превосходная эффективность
- Надежность
- Оптимальное качество
- Без вредных воздействий
Наши клиенты могут помочь от нас Хлориду Бария, который поставлен от некоторых известных продавцов рынка. Хлорид бария представляет собой химическое соединение бария и хлора. Они могут храниться в обычном
комнатная температура.
Они могут храниться в обычном
комнатная температура.
Фторид бария
Фторид бария (BaF2) представляет собой химическое соединение бария и фтора. Это твердое вещество, которое может быть прозрачным кристаллом. Встречается в природе в виде минерала франкдиксонита 9.0005
Гидроксид бария
Гидроксид бария представляет собой химическое соединение с формулой Ba(OH)2. Также известный как барит или баритовая вода, это одно из основных соединений бария. Белый гранулированный моногидрат является обычным коммерческая форма
Нитрат бария
Препарат Exakt- Препарат Exact
- Хорошо обработано
- В гигиенической упаковке
- Более длительный срок хранения
- Эффективность
- Безопасен в использовании
Нитрат бария с химической формулой Ba(NO3)2 представляет собой соль бария и ион нитрата. Нитрат бария существует в виде белого твердого вещества при комнатной температуре. Он растворим в воде и, как и другие растворимые бариевые
соединений, является токсичным и требует осторожного обращения. Встречается в природе в виде редкого минерала нитробарита.
Нитрат бария существует в виде белого твердого вещества при комнатной температуре. Он растворим в воде и, как и другие растворимые бариевые
соединений, является токсичным и требует осторожного обращения. Встречается в природе в виде редкого минерала нитробарита.
Оксалат бария
Оксалат бария, бариевая соль щавелевой кислоты, представляет собой белый порошок без запаха, который иногда используется в качестве зеленого пиротехнического красителя, как правило, в специализированных пиротехнических составах, содержащих магний.
Пероксид бария
Мы способствуем предложению премиальной качественной Перекиси Бария. Наша данная перекись бария сформулирована из химических составов оптимального качества нашими экспертами согласно нормам стандартов. Этот барий
перекись используется в качестве отбеливателя и при производстве перекиси водорода. Наряду с этим при условии, что пероксид бария доступен в различных вариантах упаковки в соответствии с требованиями клиентов.
Наряду с этим при условии, что пероксид бария доступен в различных вариантах упаковки в соответствии с требованиями клиентов.
- Чистота
- Эффективность
- Точный состав
Сульфат бария
Сульфат бария (или сульфат) — неорганическое соединение с химической формулой BaSO4. Это белое кристаллическое вещество без запаха, нерастворимое в воде. Встречается в виде минерала барита, основной коммерческий источник бария и материалов, полученных из него. Белый непрозрачный внешний вид и его высокая плотность используются в его основных областях применения.
Химические продукты
- Алюминиевый компаунд
- Соединение аммония
- Соединение сурьмы
- Соединение бария
- Соединение висмута
- Борная кислота
- Соединение кадмия
- Соединение кальция
- Цетрамид
- Химическое соединение
- Химический элемент
- Соединение меди
- Соединение меди
- Соединение железа
- Соединение железа
- Пищевые добавки
- Желатинообразное вещество
- Порошок жевательной резинки
- Неорганическое соединение
- Лабораторные химикаты
- Лабораторное оборудование
- Соединение свинца
- Соединение лития
- Соединение марганца
- Соединение магния
- Токарная обработка магниевого металла
- Соединение ртути
- Красители и растворы для микроскопии
- Натуральное масло
- Соединение никеля
- Органическое соединение
- Соединение калия
- Специальные химикаты
- Соединение серебра
- Натрий Часть I
- Натрий Часть II
- Натрий Часть III
- Соединение стронция
- Соединение цинка
Раствор хлорида бария, 10% нейтрализованный
БЕСПЛАТНАЯ ДОСТАВКАБесплатная доставка для всех заказов на сумму более 100000 индийских рупий.
Артикул:
RXSOL-60-6263-250
Количество продукта в упаковке:
Единица использования продукта:
Жидкость в бутылке
Договориться о цене
Места доставки продукта:
Visakhapatnam, Vijayawada, Kakinada, Gangavaram, Krishnapatnam, Rawa, Nellore, Rajahmundry
Категория:
Тестовый комплект для Water-62
. Очищенный и хорошо сбалансированный 10% раствор хлорида бария химически играет роль во время теста на сульфат, осаждаясь в виде кристаллов сульфата бария одинакового размера.
Описание продукта:
Высокоочищенный и хорошо сбалансированный 10%-ный раствор хлорида бария торговой марки RXSOL химически играет роль во время теста на сульфат, чтобы осаждаться в виде кристаллов сульфата бария одинакового размера.
Другой продукт с более высокой концентрацией ::: Насыщенный раствор хлорида бария
Метод испытания сульфита хлоридом бария основан на осаждении сульфат-иона в солянокислой среде хлоридом бария таким образом, чтобы образовались кристаллы сульфата бария одинакового размера. Раствор сульфата глицерина используется для поддержания надлежащего размера кристаллов, а для получения воспроизводимого результата необходим контроль времени перемешивания и ожидания. Результирующая мутность измеряется при длине волны, чувствительной к мутности, на фотометре. Заглушка служит для частичного устранения помех, вызванных цветом и взвешенными веществами.
Раствор сульфата глицерина используется для поддержания надлежащего размера кристаллов, а для получения воспроизводимого результата необходим контроль времени перемешивания и ожидания. Результирующая мутность измеряется при длине волны, чувствительной к мутности, на фотометре. Заглушка служит для частичного устранения помех, вызванных цветом и взвешенными веществами.
Щелкните здесь, чтобы ознакомиться с процедурой тестирования ::: rxmarine.com/SULFATE-TEST-KIT
Применение продукта:
Руководство по процедурам тестирования воды (полный набор методов лабораторных испытаний со стандартным соотношением реагентов в составе ::: доступно у нас по цене 2700 индийских рупий или 54 доллара США или 207 дирхамов ОАЭ
Процедура продукта:
Необходимое оборудование ::: Фотометр с фильтром в комплекте с лабораторной посудой в ассортименте.
Требуемые химикаты
Раствор сульфата глицерина
Раствор хлорида бария (натуральный)
Стандарт сульфата
Процедура испытания
В этой процедуре используется длина волны 420 нм и кювета со световым путем примерно 10 мм. Сначала подготовьте калибровочную кривую для фотометра, используя последовательные разведения сульфатного стандарта, чтобы адекватно охватить диапазон содержания сульфата в испытуемых образцах. С разбавлениями стандарта следует обращаться точно так же, как показано ниже для анализа проб воды. С помощью пластиковой градуировки на 50 мл добавьте 50 мл образца в стеклянную колбу на 125 мл. Внесите в колбу пипеткой 10 мл раствора сульфата глицерина и взболтайте раствор. Внесите в колбу пипеткой 5 мл дистиллированной воды, взболтайте раствор и используйте этот раствор для установки фотометра на нулевое поглощение. Слейте раствор и промойте колбу дистиллированной водой. Во вторую пробу объемом 50 мл введите пипеткой 10 мл раствора сульфата глицерина и взболтайте. Доведите температуру образца до 70–75°F и пипеткой внесите 5 мл нейтрального раствора хлорида бария в ту же колбу. Перемешайте раствор, вращая резиновую лопатку между ладонями на умеренной скорости ровно пять секунд. Подождите ровно пять минут, а затем измерьте оптическую плотность на фотометре.
Сначала подготовьте калибровочную кривую для фотометра, используя последовательные разведения сульфатного стандарта, чтобы адекватно охватить диапазон содержания сульфата в испытуемых образцах. С разбавлениями стандарта следует обращаться точно так же, как показано ниже для анализа проб воды. С помощью пластиковой градуировки на 50 мл добавьте 50 мл образца в стеклянную колбу на 125 мл. Внесите в колбу пипеткой 10 мл раствора сульфата глицерина и взболтайте раствор. Внесите в колбу пипеткой 5 мл дистиллированной воды, взболтайте раствор и используйте этот раствор для установки фотометра на нулевое поглощение. Слейте раствор и промойте колбу дистиллированной водой. Во вторую пробу объемом 50 мл введите пипеткой 10 мл раствора сульфата глицерина и взболтайте. Доведите температуру образца до 70–75°F и пипеткой внесите 5 мл нейтрального раствора хлорида бария в ту же колбу. Перемешайте раствор, вращая резиновую лопатку между ладонями на умеренной скорости ровно пять секунд. Подождите ровно пять минут, а затем измерьте оптическую плотность на фотометре.
Расчет результатов Концентрация сульфата в частях на миллион в виде SO4 получается на основе подготовленной калибровочной кривой сульфата.
Ограничения теста
Цвет или большое количество взвешенных веществ будут мешать этому методу, но некоторые взвешенные вещества могут быть удалены путем фильтрации. Также наличие окраски и взвешенных веществ в некоторой степени компенсируется холостой пробой. Кремнезем в количестве более 500 частей на миллион будет мешать, а в образцах, содержащих большое количество органического материала, удовлетворительное осаждение сульфата бария может оказаться невозможным.
Примечание к продукту:
Технические характеристики продукта:
Размер упаковки продукта:
100 мл, 250 мл, 500 мл, упаковка 1 л. Этот раствор используется для — Метод испытания сульфита с хлоридом бария основан на осаждении сульфат-иона в среде соляной кислоты с хлоридом бария таким образом, чтобы образовались кристаллы сульфата бария одинакового размера. Раствор сульфата глицерина используется для поддержания надлежащего размера кристаллов, а для получения воспроизводимого результата необходим контроль времени перемешивания и ожидания. Результирующая мутность измеряется при длине волны, чувствительной к мутности, на фотометре. Заглушка служит для частичного устранения помех, вызванных цветом и взвешенными веществами
Раствор сульфата глицерина используется для поддержания надлежащего размера кристаллов, а для получения воспроизводимого результата необходим контроль времени перемешивания и ожидания. Результирующая мутность измеряется при длине волны, чувствительной к мутности, на фотометре. Заглушка служит для частичного устранения помех, вызванных цветом и взвешенными веществами
Псевдоним продукта:
Раствор хлорида бария
Артикул:
Карбонат бария | Поставщик и производитель | Visakhapatnam India
Купить Индийский поставщик хлорида бария в штате Андхра-Прадеш, Индия
Борат бария | Поставщик и производитель | Вишакхапатнам Индия
где купить хлорид бария в вишакхапатнам Индия
Поставщик хлорида бария Дистрибьютор Производитель в вишакхапатнам Индия
Хлорид бария Поставщик Производитель висахапатнам Индия
Поставщик хлорида бария Дистрибьютор Производитель в Вишакхапатнам, Индия
Поставщик гидроксида бария Дистрибьютор Производитель в Вишакхапатнам, Индия
Поставщик нитрата бария Дистрибьютор Производитель в Вишакхапатнам, Индия
Сульфат бария Производитель, экспортер, дистрибьютор, поставщик в Вишакхапатнам Индия
Нитрат бария Экспортер, Дистрибьютор, Поставщик в Вишакхапатнаме, Индия.
Сульфат бария Производитель, экспортер, дистрибьютор, поставщик в Вишакхапатнам, Индия.
Безводный хлорид бария Производитель, экспортер, дистрибьютор, поставщик в Вишакхапатнаме, Индия.
Хлорид бария Производитель, экспортер, дистрибьютор, поставщик в Вишакхапатнам, Индия.
Производитель хлорида олова, экспортер, дистрибьютор, поставщик в Вишакхапатнаме, Индия.
Сульфат бария Производитель, экспортер, дистрибьютор, поставщик в Вишакхапатнам, Индия.
Производители бромида бария, поставщики, экспортеры, производители в Вишакхапатнаме, Индия.
Производители, поставщики, экспортеры, производители ацетата бария в Вишакхапатнаме, Индия.
Иодид бария BaI2 производители, поставщики, экспортеры, производители в Вишакхапатнаме, Индия.
Производители азида бария, поставщики, экспортеры, производители в Вишакхапатнаме, Индия.
Оксид бария, BaO, производители бария, поставщики, экспортеры, производители в Вишакхапатнаме, Индия.
Производители гидроксида бария, поставщики, экспортеры, производители в Вишакхапатнаме, Индия.
Производители, поставщики, экспортеры, производители сульфата бария в Вишакхапатнаме, Индия.
Производители титаната бария, поставщики, экспортеры, производители в Вишакхапатнаме, Индия.
Дистрибьюторы, производители, экспортеры и поставщики хлорида бария в Индии
Дистрибьюторы, производители, экспортеры и поставщики хлорида бария в Индии
Дистрибьюторы, производители, экспортеры и поставщики сульфата бария в Индии
Дистрибьюторы, производители нитрата бария , экспортеры и поставщики в Индии
Дистрибьюторы, производители, экспортеры и поставщики сульфата бария в Индии
Дистрибьюторы, производители, экспортеры и поставщики титаната бария (BTO) в Индии Соль стронция
Горячая линия
+86-27-85305818
Свяжитесь с нами
Сульфат бария
Сульфат бария (природный, осажденный)
Номер КАС: 7727-43-7
Молекулярная формула: BaSO 4 , молекулярный вес: 233,39
Свойство: орторомбические бесцветные кристаллы или белый аморфный порошок.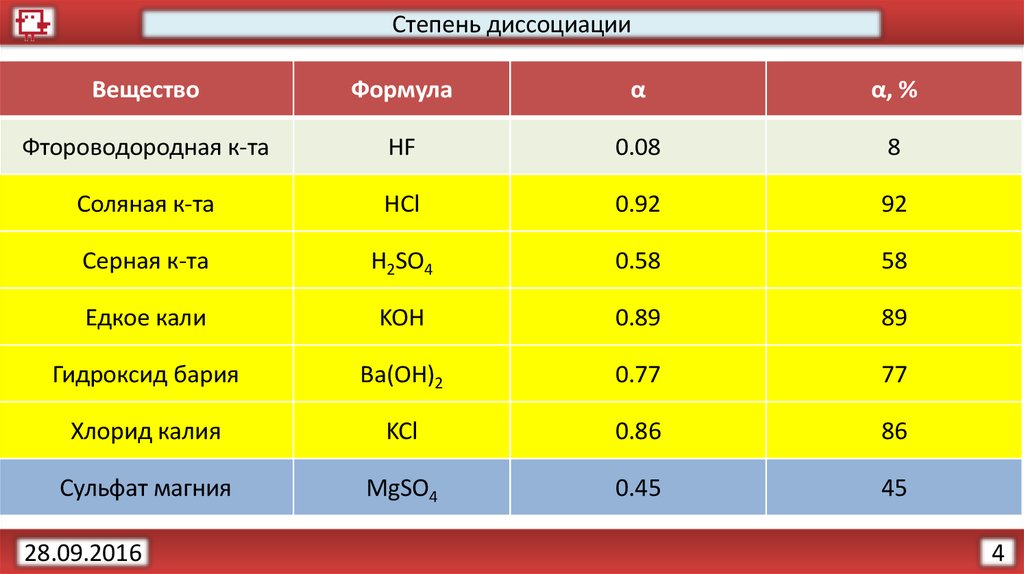 Практически нерастворим в воде, этаноле и кислоте, растворим в горячей концентрированной серной кислоте.
Практически нерастворим в воде, этаноле и кислоте, растворим в горячей концентрированной серной кислоте.
Использование: в основном используется в красках, чернилах, красках для плакатов, косметике, полимерной смоле в качестве наполнителей и утяжелителя хлорэтана. Не только как наполнитель в резинотехнических изделиях, но и как армирующий агент. Уточняющий агент в производстве стекла, пеногасящий эффект при монтаже и увеличение блеска. Неорганическая промышленность для производства других солей бария, таких как гидроксид бария, карбонат бария, хлорид бария и другое сырье. Промышленное производство печатных форм под дерево для нанесения грунтовки и модуляции краски. Органический синтез как производство зеленых пигментов и цветных лаков, физическая упаковка.
Фасовка: 25 кг или 1000 кг упакованы в полиэтиленовый тканый мешок с подкладкой.
1. ОСАЖДЕННЫЙ МАРКА
БАРИЯ СУЛЬФАТ ОСАДАННЫЙ (ОТЛИЧНЫЙ)
ОСМОТР ОСНОВАН НА GB/T2899-2008
Предметы | Стандарт | |
BaSO4 (по сухому) | 98% мин. | |
Водорастворимый | 0,30% макс. | |
Влага | 0,30% макс. | |
Крупность (остаток на сите 325 мкм) | 0,20% макс. | |
Маслоабсорбция | 10%-30% | |
Летучесть при 105℃, %≤ | 0,30% макс. | |
Железо(Fe) | 0,004% макс. | |
Значение рН (суспензия 100 г/л) | 6,5-9.0 | |
Белизна | 94,0% мин. | |
Гранулометрический состав | ≤10 мкм | 80% мин. |
≤5 мкм | 60% мин. | |
≤2 мкм | 25 % мин. | |
2. БАРИТ ПОРОШОК
ОСМОТР ОСНОВАН НА GB/T2899-82

 98%
98%


