Оксиды — получение и свойства
Хотелось бы дать возможно более
простое определение оксида — это
соединение элемента с кислородом. Но
существуют кислоты и соли. Рассмотрим
соединения h3O2 и BaO2. Перекись
водорода является слабой кислотой
(она диссоциирует в воде давая ионы
водорода и анионы HO2- и O2-2).
Пероксид бария — это бариевая соль
перекиси водорода. У молекул h3O2 и
BaO2 есть кислородный мостик -O-O-,
поэтому степень окисления кислорода в
этих соединениях -1. В неорганической
химии обычно пероксиды к классу
оксидов не относят и поэтому
необходимо уточнить определение
оксида таким образом, чтобы
пероксиды в этот класс не попадали.
Фтор самый активный неметалл и вслед
за ним идет кислород. Формальная
степень окисления атома кислорода в
оксиде фтора +2, а во всех других
оксидах -2. Следовательно, оксидами
называют соединения элементов с
кислородом, в которых кислород
проявляет формальную степень
окисления равную -2 (за исключением
оксида фтора, где она равна +2).
Один и тот же химический элемент
может образовывать с кислородом не
один оксид, а несколько, например, у
азота известны оксиды N2O, NO, N2O3,
NO2, N2O4, N2O5. Во всех этих оксидах
степень окисления у кислорода -2, а у
азота, соответственно, +1, +2, +3, +4,
+4 и +5. У двух оксидов: NO2 и N2O4
степен окисления азота и кислорода
совпадают. В названии веществ
отражается история развития химии
как науки. В период накопления
экспериментальных данных в химии
названия веществ отражали либо
способ их получения (жженая
магнезия: MgCO3 ® MgO + CO2), либо
характер воздействия на человека
(N2O — веселящий газ), либо сферу
применения (пурпурно-красная краска
«сурик» — Pb3O4) и т.д. По мере того как
все большее число людей изучало
химию, по мере того как все большее
число веществ надо было
охарактеризовать и запомнить
возникла необходимость просто
словами называть формулу вещества.
Получение оксидов
При изучении данной главы особое внимание будет уделено взаимосвязи «родственных» веществ из разных классов.
Как получить оксиды из простых веществ? Их окислением:
2Mg + O2 = 2MgO, 2C + O2 = 2CO, C + O2 = CO2.
Рассмотрим лишь принципиальную возможность получения оксида из простых веществ. Получение CO и CO2 будет рассмотрено в разделе «Углерод».
Можно ли получить оксиды из оксидов? Да:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2.
Можно ли получить оксиды из гидроксидов ? Да:
Ca(OH)2 CaO + h3O, h3CO3 = CO2 + h3O.
Можно ли получить оксиды из солей ? Да:
CaCO3 CaO + CO2,
2Cu(NO3)2 = 2CuO + 4NO2 + O2.
Свойства оксидов
Если посмотреть внимательно реакции, написанные выше, то те из них, в которых оксиды встречались в левой части уравнения, будут говорить нам о свойствах оксидов. Эти общие для всех оксидов свойства относятся к окислительно-восстановительным процессам:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2, Al + Fe2O3 = Al2O3 + Fe, C + Fe2O3 = CO + 2FeO.
Но тем не менее, свойства оксидов обычно рассматриваются с учетом их классификации.
Свойства основных оксидов
Прежде всего надо показать, что отвечающие им гидроксиды являются основаниями:
CaO + h3O = Ca(OH)2, Ca(OH)2 = Ca2+ + 2OH-,
т.е. оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой дают растворимые в воде основания, которые называются щелочами.
Основные оксиды, реагируя с кислотными или амфотерными оксидами, дают соли:
CaO + SO3 = CaSO4,
BaO + Al2O3 = Ba(AlO2)2.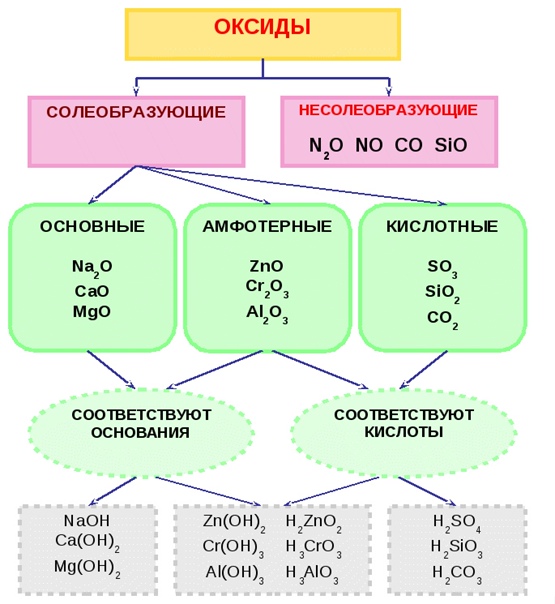
Основные оксиды, реагируя с кислотными или амфотерными гидроксидами, дают соли:
CaO + h3SO4 = CaSO4 + h3O, K2O + Zn(OH)2 = K2ZnO2 + h3O.
Основные оксиды, реагируя с кислыми солями, дают средние соли:
CaO + Ca(HCO3)2 = 2CaCO3 + h3O.
Основные оксиды, реагируя с нормальными солями, дают основные соли:
MgO + MgCl2 + h3O = 2Mg(OH)Cl.
Свойства кислотных оксидов
Отвечающие кислотным оксидам гидроксиды являются кислотами:
SO3 + h3O = h3SO4, h3SO4 = 2H+ + SO42- .
Многие кислотные оксиды, растворяясь в воде, дают кислоты. Но есть и такие кислотные оксиды, которые не растворяются в воде и с ней не взаимодействуют: SiO2.
Кислотные оксиды, реагируя с основными или амфотерными оксидами, дают соли:
SiO2 + CaO = CaSiO3, 3SO3 + Al2O3 = Al2(SO4)3.
Кислотные оксиды, реагируя с основными или амфотерными гидроксидами, дают соли:
SO3 + Ca(OH)2 = CaSO4 + h3O,
SO3 + Zn(OH)2 = ZnSO4 + h3O.
Кислотные оксиды, реагируя с основными солями, дают средние соли.
Кислотные оксиды, реагируя с нормальными солями, дают кислые соли:
CO2 + CaCO3 + h3O = Ca(HCO3)2.
Свойства амфотерных оксидов
Отвечающие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH)2 = Zn2+ + 2OH-, h3ZnO2 = 2H+ + ZnO22-.
Амфотерные оксиды не растворяются в вводе.
Амфотерные оксиды, реагируя с основными или с кислотными оксидами, дают соли:
Al2O3 + K2O = 2KAlO2, Al2O3 + 3SO3 = Al2(SO4)3.
Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH = K2ZnO2 + h3O, ZnO + h3SO4 = ZnSO4 + h3O.
Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Классификация и свойства оксидов
Как вы уже знаете, все вещества делятся на простые и сложные. В свою очередь сложные вещества делятся на четыре класса: оксиды, основания, кислоты и соли. Каждое из неорганических соединений так или иначе является представителем какого-либо одного класса веществ, хотя есть и исключения. Так, например, пероксид бария BaO
Каждое из неорганических соединений так или иначе является представителем какого-либо одного класса веществ, хотя есть и исключения. Так, например, пероксид бария BaO
Оксидами же называются сложные вещества, состоящие из двух элементов, один из которых кислород, т.е. оксид – это соединение элемента с кислородом.
Название оксидов образуется от названия элемента, входящего в состав оксида. Например, BaO – оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой. Например, FeO – оксид железа (I), Fe2О3 – оксид железа (III).
Элементы, обладающие постоянной валентностью, образуют только основные, кислотные или амфотерные оксиды. Элементы с переменной валентностью могут образовывать различные оксиды.
Все оксиды делятся на солеобразующие и несолеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями.
По своим химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H2SO4 = CuSO4 + H2O
Растворимые в воде основные оксиды (оксиды металлов I и IIA группы из периодической системы) вступают в реакцию с водой, образуя основания:
CaO + H2O = Ca(OH) 2
Большинство основных оксидов с водой не взаимодействуют, но им также соответствуют основания, которые можно получить косвенным путем.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na2O + SO3 = Na2SO4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами.
Многие кислотные оксиды соединяются с водой, образуя кислоты:
N2O3 + H2O = 2HNO2
SO3 + H2O = H2SO4
Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.
Кислотные оксиды реагируют с основными оксидами с образованием соли:
CO2 + CaO = CaCO3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + Ba(ОН)2= BaCO3 + H2
OАмфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например – Al2O3, Cr2O3, MnO2; Fe2O3 ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O (при нагревании)
ZnO + 2NaOH + H2O= Na2[Zn(OH)4] (в растворе)
Так как далеко не все амфотерные оксиды растворимы в воде, то доказать амфотерность таких оксидов заметно сложнее. Например, оксид алюминия (III) в реакции сплавления его с дисульфатом калия проявляет основные свойства, а при сплавлении с гидроксидами – кислотные:
Al2O3 + 3K2S2O7 = 3K2SO4 + A12(SO4)3
Al2O3 + 2KOH = 2KAlO2 + H2O
У различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) – Fe2O3 – обладает преимущественно основными свойствами.
Способы получения оксидов из простых веществ – это либо прямая реакция элемента с кислородом:
2Ca + O2 = 2CaO
либо разложение сложных веществ:
а) оксидов
4CrO3 = 2Cr2O3 + 3O2
б) гидроксидов
Ca(OH)2 = CaO + H2O
в) кислот
H2CO3 = H2O + CO2
г) солей
CaCO3 = CaO +CO2
А также взаимодействие кислот – окислителей с металлами и неметаллами:
Cu + 4HNO3(конц) = Cu(NO3) 2 + 2NO2 + 2H2O
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
Самоподготовка к ЕГЭ и ЦТ по химии» src=»https://www.youtube.com/embed/y41Tt5AN8iw?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»> Самоподготовка к ЕГЭ и ЦТ по химии» src=»https://www.youtube.com/embed/HF3mDzB6Vnw?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
WebElements Periodic Table » Барий » пероксид бария
- Формула: BaO 2
- Формула системы Хилла: Ba 1 O 2
- Регистрационный номер CAS: [1304-29-6]
- Вес формулы: 169,326
- Класс: оксид
- Цвет: серо-белый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 450°C (разлагается до BaO + O 2 )
- Температура кипения:
- Плотность: 4960 кг·м -3
Ниже приведены некоторые синонимы перекиси бария :
- бария пероксид
- бария(II) пероксид
Степень окисления бария в перекиси бария составляет 2 .
Синтез
Пероксид бария можно получить путем реакции кислорода или воздуха с оксидом бария.
2BaO + O 2 → 2BaO 2 (с)
Элементный анализ
В таблице показано процентное содержание элементов для BaO 2 (пероксид бария).
| Элемент | % |
|---|---|
| Ба | 81.10 |
| О | 18,90 |
Изотопная схема BaO
2На приведенной ниже диаграмме показана расчетная изотопная картина для формулы BaO 2 с наиболее интенсивным ионом, установленным на 100%.
Ссылки
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.
 Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997. - Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , Джон Вили и сыновья, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лид, (редактор) в справочнике по химии и физике Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.

- Дж.В. Меллор в Всесторонний трактат по неорганической и теоретической химии , тома 1-16, Longmans, Лондон, Великобритания, 1922-1937.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1–3, Chapman & Hall, Лондон, Великобритания, 1992.
Изучите периодические свойства по этим ссылкам
неорганическая химия — степень окисления кислорода в BaO2
спросил
Изменено 7 лет, 4 месяца назад
Просмотрено 18 тысяч раз
$\begingroup$
Согласно книге для бинарных соединений, сначала мы присваиваем элементу с большей электроотрицательностью его степень окисления (кислород всегда -2, кроме пероксидов). Итак, у нас есть
-2 х2 =-2. Таким образом, каждый кислород будет иметь степень окисления -2. В книге написано, что ответ -1.
Итак, у нас есть
-2 х2 =-2. Таким образом, каждый кислород будет иметь степень окисления -2. В книге написано, что ответ -1.
Единственное, о чем я могу думать, так это о том, что поскольку барий является щелочным металлом, его степень окисления +2, поэтому каждый кислород будет равен -1. Но, это противоречит само себе, потому что в правилах. В нем говорится, что для бинарного соединения «элементу с большей электроотрицательностью присваивается отрицательная степень окисления, равная его заряду в простых ионных соединениях элемента». 9{2-}}$ ионы. Степень окисления Ba равна +II, а степень окисления каждого из атомов кислорода в перекисном анионе равна -I. Это согласуется с зарядом пероксидного аниона ($2 \times -1 = -2$), а поскольку $\ce{BaO2}$ является нейтральным соединением, сумма всех степеней окисления равна 0. Более того, существует еще больше исключения из приведенного выше эмпирического правила, например, супероксидный анион-радикал $\ce{O2-}$ с дробным числом окисления $-\frac{1}{2}$ или диоксигенильный катион $\ce{ O2+}$ с формальной степенью окисления $+\frac{1}{2}$ для каждого кислорода. 9{2-}}$. Заряд оксидного аниона составляет $2-$, поэтому степень окисления кислорода в этих соединениях равна -II.
9{2-}}$. Заряд оксидного аниона составляет $2-$, поэтому степень окисления кислорода в этих соединениях равна -II.
$\endgroup$
2
$\begingroup$
Числа окисления являются чрезвычайно полезной формой химического учета, но их не следует рассматривать как нечто реально существующее. Например, вполне возможны дробные степени окисления, но у вас не может быть половины электрона. Число аноксидации +7 приписывается хлору в перхлоратах, но мысль о том, что вы могли бы оторвать 7 электронов от атома хлора, немыслима (сложите первые 7 потенциалов ионизации). Именно вторая часть приведенной вами цитаты вводит в заблуждение и во многих случаях неверна. В первую очередь следует иметь в виду, что степень окисления данного элемента в соединении — это заряд, который он будет иметь 9.0124 IF соединение было полностью ионным. Знак заряда зависит от относительной электроотрицательности связывающих атомов.

 Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.