Гидроксид бария Википедия
| Гидроксид бария | |
|---|---|
| Общие | |
| Систематическое наименование | Гидроксид бария |
| Хим. формула | Ba(OH)2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 171,35474 г/моль |
| Плотность | 4,5 (20 °C) |
| Термические свойства | |
| Т. плав. | 408 °C |
| Т. кип. | 780 °C |
| Т. разл. | 1000 °C |
| Энтальпия образования | -950 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 3,89 (20 °C) |
| Классификация | |
| Рег. номер CAS | 17194-00-2 |
| PubChem | 6093286 |
| Рег. номер EINECS | 241-234-5 |
| SMILES | [OH-].[OH-].[Ba+2] |
| InChI | 1S/Ba.2h3O/h;2*1h3/q+2;;/p-2RQPZNWPYLFFXCP-UHFFFAOYSA-L |
| RTECS | CQ9200000 |
| ChEBI | 32592 |
| Номер ООН | <— номер UN —> |
| ChemSpider | 26408 и 21169506 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокси́д ба́рия (е́дкий бари́т) — неорганическое соединение, проявляющее сильные основные свойства. Химическая формула — Ba(OH)2. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Содержание
- 1 Свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Примечания
- 6 Литература
Свойства[ | код]
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение[ | код]
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba
ru-wiki.ru
Физические и химические свойства оснований
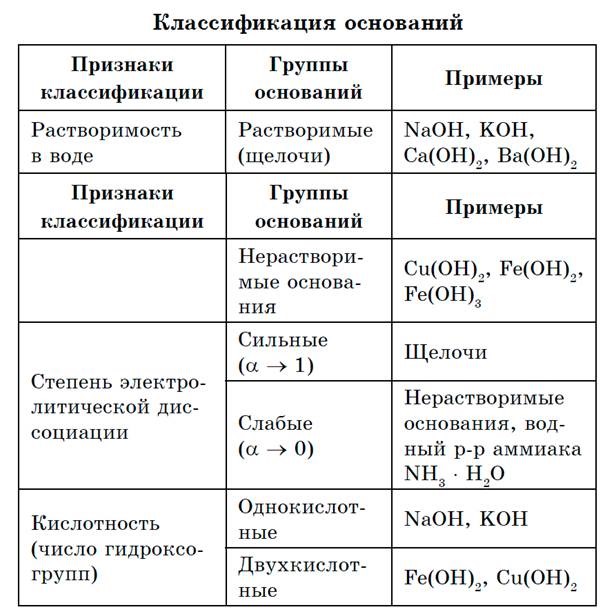
Все неорганические основания классифицируют на растворимые в воде (щелочи) – NaOH, KOH и нерастворимые в воде (Ba(OH)2, Ca(OH)2). В зависимости от проявляемых химических свойств среди оснований выделяют амфотерные гидроксиды.
Химические свойства оснований
При действии индикаторов на растворы неорганических оснований происходит изменение их окраски, так, при попадании в раствор основания лакмус приобретает синюю окраску, метилоранж – жёлтую, а фенолфталеин – малиновую.
Неорганические основания способны реагировать с кислотами с образованием соли и воды, причем, нерастворимые в воде основания взаимодействуют только с растворимыми в воде кислотами:
Cu(OH)2↓ + H2SO4 = CuSO4 +2H2O;
NaOH + HCl = NaCl + H2O.
Нерастворимые в воде основания термически неустойчивы, т.е. при нагревании они подвергаются разложению с образованием оксидов:
2Fe(OH)3 = Fe2O3 + 3 H2O;
Mg(OH)2 = MgO + H2O.
Щелочи (растворимые в воде основания) взаимодействуют с кислотными оксидами с образованием солей:
NaOH + CO2 = NaHCO3.
Щелочей также способны вступать в реакции взаимодействия (ОВР) с некоторыми неметаллами:
2NaOH + Si + H2O → Na2SiO3 +H2↑.
Некоторые основания вступают в реакции обмена с солями:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓.
Амфотерные гидроксиды (основания) проявляют также свойства слабых кислот и реагируют с щелочами:
Al(OH)3 + NaOH = Na[Al(OH)4].
К амфотерным основаниям относятся гидроксиды алюминия, цинка. хрома (III) и др.
Физические свойства оснований
Большинство оснований – твердые вещества, которые характеризуются различной растворимостью в воде. Щелочи – растворимые в воде основания – чаще всего твердые вещества белого цвета. Нерастворимые в воде основания могут иметь различную окраску, например, гидроксид железа (III)- твердое вещество бурого цвета, гидроксид алюминия – твердое вещество белого цвета, а гидроксид меди (II) – твердое вещество голубого цвета.
Получение оснований
Основания получают разными способами, например, по реакции:
— обмена
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4;
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓;
— взаимодействия активных металлов или их оксидов с водой
2Li + 2H2O→ 2LiOH +H2↑;
BaO + H2O→ Ba(OH)2↓;
— электролиза водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2↑.
Примеры решения задач
ru.solverbook.com
Гидроксид бария — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Гидроксид бария | |
| Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field ‘wikibase’ (a nil value). | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид бария |
| Хим. формула | Ba(OH)2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 171,35474 г/моль |
| Плотность | 4,5 (20 °C) |
| Термические свойства | |
| Т. плав. | 408 °C |
| Т. кип. | 780 °C |
| Т. разл. | 1000 °C |
| Энтальпия образования | -950 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 3,89 (20 °C) |
| Классификация | |
| Рег. номер CAS | 17194-00-2 |
| PubChem | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field ‘wikibase’ (a nil value). |
| Рег. номер EINECS | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field ‘wikibase’ (a nil value). |
| SMILES |
[http://chemapps.stolaf.edu/jmol/jmol.php?model=%3Cstrong%20class%3D%22error%22%3E%3Cspan%20class%3D%22scribunto-error%22%20id%3D%22mw-scribunto-error-13%22%3E%D0%9E%D1%88%D0%B8%D0%B1%D0%BA%D0%B0%20Lua%3A%20callParserFunction%3A%20function%20%26quot%3B%23property%26quot%3B%20was%20not%20found.%3C%2Fspan%3E%3C%2Fstrong%3E Ошибка Lua: callParserFunction: function «#property» was not found.] |
| InChI |
[http://chemapps.stolaf.edu/jmol/jmol.php?&model=InChI=%3Cstrong%20class%3D%22error%22%3E%3Cspan%20class%3D%22scribunto-error%22%20id%3D%22mw-scribunto-error-16%22%3E%D0%9E%D1%88%D0%B8%D0%B1%D0%BA%D0%B0%20Lua%3A%20callParserFunction%3A%20function%20%26quot%3B%23property%26quot%3B%20was%20not%20found.%3C%2Fspan%3E%3C%2Fstrong%3E Ошибка Lua: callParserFunction: function «#property» was not found.] [https://www.ncbi.nlm.nih.gov/sites/entrez?cmd=search&db=pccompound&term=%22%3Cstrong%20class%3D%22error%22%3E%3Cspan%20class%3D%22scribunto-error%22%20id%3D%22mw-scribunto-error-19%22%3E%D0%9E%D1%88%D0%B8%D0%B1%D0%BA%D0%B0%20Lua%3A%20callParserFunction%3A%20function%20%26quot%3B%23property%26quot%3B%20was%20not%20found.%3C%2Fspan%3E%3C%2Fstrong%3E%22%5BInChIKey%5D |
| Кодекс Алиментариус | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field ‘wikibase’ (a nil value). |
| RTECS | CQ9200000 |
| Номер ООН | <— номер UN —> |
| ChemSpider | Ошибка Lua в Модуль:Wikidata на строке 170: attempt to index field ‘wikibase’ (a nil value). |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокси́д ба́рия (е́дкий бари́т) — неорганическое соединение, проявляющее сильные основные свойства. Химическая формула — Ba(OH) 2. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{Ba + 2\ H_2O \longrightarrow \ Ba(OH)_2 + \ H_2 \uparrow}
2. Взаимодействие оксида бария с водой:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{BaO + \ H_2O \longrightarrow \ Ba(OH)_2}
3. Взаимодействие сульфида бария с горячей водой:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{BaS + 2\ H_2O \longrightarrow \ Ba(OH)_2 + \ H_2S \uparrow}
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{Ba(OH)_2 + 2\ HCl \longrightarrow \ BaCl_2 + 2\ H_2O}
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{Ba(OH)_2 + \ H_2SO_4 \longrightarrow \ BaSO_4 \downarrow + 2\ H_2O}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{Ba(OH)_2 + \ CO_2 \longrightarrow \ BaCO_3 \downarrow + \ H_2O}
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{Ba(OH)_2 + \ SO_3 \longrightarrow \ BaSO_4 \downarrow + \ H_2O}
Применение
Применяют гидроксид бария в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы), для очистки растительных масел и животных жиров, как компонент смазок, для удаления SO42− (сульфат-ионов) из промышленных растворов, получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов.
Напишите отзыв о статье «Гидроксид бария»
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Отрывок, характеризующий Гидроксид бария
– Куда?– тихо спросил мальчик. – Нам теперь некуда идти…Я не могла этого дольше выносить и решила поговорить с этой несчастной, цеплявшейся друг за друга, перепуганной парой детей, которых судьба вдруг, ни за что, ни про что, вышвырнула в какой-то чужой и совершенно им непонятный мир. И я могла только лишь попробовать представить, как страшно и дико всё это должно было быть, особенно этой маленькой крошке, которая ещё вообще понятия не имела о том, что такое смерть…
Я подошла к ним ближе и тихо, чтобы не напугать, сказала:
– Давайте поговорим, я могу вас слышать.
– Ой, Видас, видишь, она нас слышит!!! – заверещала малышка. – А ты кто? Ты хорошая? Ты можешь сказать маме, что нам страшно?..
Слова лились сплошным потоком из её уст, видимо она очень боялась, что я вдруг исчезну и она не успеет всего сказать. И тут она опять посмотрела на скорую помощь и увидела, что активность врачей удвоилась.
– Смотрите, смотрите, они сейчас нас всех увезут – а как же мы?!. – в ужасе лепетала, совершенно не понимая происходящего, малышка.
Я чувствовала себя в полном тупике, так как первый раз столкнулась с только что погибшими детьми и понятия не имела, как им всё это объяснить. Мальчик вроде бы что-то уже понимал, а вот его сестра была так страшно напугана происходящим, что её маленькое сердечко не хотело понимать ничего вообще…
На какой-то момент я совершенно растерялась. Мне очень хотелось её успокоить, но я никак не могла найти нужных для этого слов и, боясь сделать хуже, пока молчала.
Вдруг из скорой помощи появилась фигура мужчины, и я услышала как одна из медсестёр кому-то крикнула: «Теряем, теряем!». И поняла, что следующим расставшимся с жизнью видимо был отец…
– Ой, па-апочка!!! – радостно запищала девчушка. – А я уже думала, ты нас оставил, а ты здесь! Ой, как хорошо!..
Отец, ничего не понимая, оглядывался по сторонам, как вдруг увидев своё израненное тело и хлопочущих вокруг него врачей, схватился обеими руками за голову и тихо взвыл… Было очень странно наблюдать такого большого и сильного взрослого человека в таком диком ужасе созерцавшего свою смерть. Или может, именно так и должно было происходить?.. Потому, что он, в отличие от детей, как раз-то и понимал, что его земная жизнь окончена и сделать, даже при самом большом желании, уже ничего больше нельзя…
– Папа, папочка, разве ты не рад? Ты же можешь видеть нас? Можешь ведь?.. – счастливо верещала, не понимая его отчаяния, дочка.
А отец смотрел на них с такой растерянностью и болью, что у меня просто разрывалось сердце…
– Боже мой, и вы тоже?!.. И вы?.. – только и мог произнести он. – Ну, за что же – вы?!
В машине скорой помощи три тела уже были закрыты полностью, и никаких сомнений больше не вызывало, что все эти несчастные уже мертвы. В живых осталась пока одна только мать, чьему «пробуждению» я честно признаться, совсем не завидовала. Ведь, увидев, что она потеряла всю свою семью, эта женщина просто могла отказаться жить.
o-ili-v.ru
Основания: классификация и химические свойства
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
|
Сильные основания |
Слабые основания |
|
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) |
Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Основания — классификация, получение и свойства » HimEge.ru
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
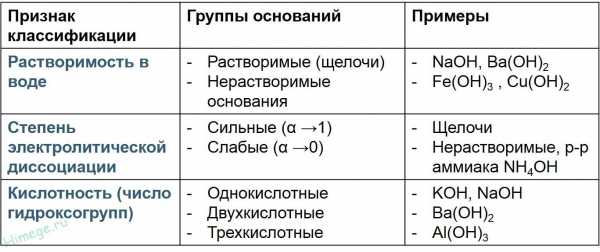
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
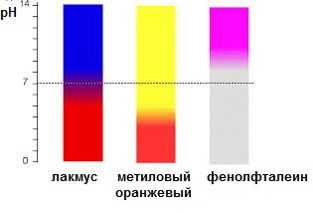 1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
NaOH = Na+ + OH—.
Многоосновные основания диссоциируют ступенчато:
Ba(OH)2 = BaOH+ + OH—,
BaOH+ = Ba2+ + OH—,
суммарное уравнение:
Ba(OH)2 = Ba2+ + 2OH—.
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
OH— + H+ = H2O.
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
Ba(OH)2 + HCl = BaOHCl + H2O,
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O,
4) Взаимодействие с солями
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4,
2Fe3+ + 6OH— = 2Fe(OH)3.
5) Термическое разложение
Cu(OH)2 = CuO + H2O,
2Fe(OH)3 = Fe2O3 + 3H2O .
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
2LiOH = Li2O + H2O.
6)Взаимодействие с неметаллами
6KOH + 3S = K2SO3 + 2K2S + 3H2O,
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
himege.ru
Гидроксид бария — Википедия РУ
Свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba(OH)2+ h3↑{\displaystyle {\mathsf {Ba+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие оксида бария с водой:
BaO+ h3O⟶ Ba(OH)2{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие сульфида бария с горячей водой:
BaS+2 h3O⟶ Ba(OH)2+ h3S↑{\displaystyle {\mathsf {BaS+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Ba(OH)2+2 HBr⟶ BaBr2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HBr\longrightarrow \ BaBr_{2}+2\ H_{2}O}}}
Ba(OH)2+ h3SO4⟶ BaSO4↓+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ H_{2}O}}}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Ba(OH)2+ CO2⟶ BaCO3↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
Ba(OH)2+ SO3⟶ BaSO4↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
Применение
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
http-wikipediya.ru
Свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
|
Амфотерный гидроксид (основная и кислотная форма) |
Комплексный ион |
|
|
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
Be(OH)2 / H2BeO2 |
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
|
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания — твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2диссоциирует по двум ступеням:
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | 535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
2Al + 2OH–+ 6H2О ® 2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2® Na2CO3 + H2O 2OH–+ CO2 ® CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3® 2NaOH + BaCO3¯ Ba2+ + CO32– ® BaCO3¯.
Л.А. Яковишин
www.sev-chem.narod.ru