Химическая связь — основные виды, типы и характеристики
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный
— происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.

На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
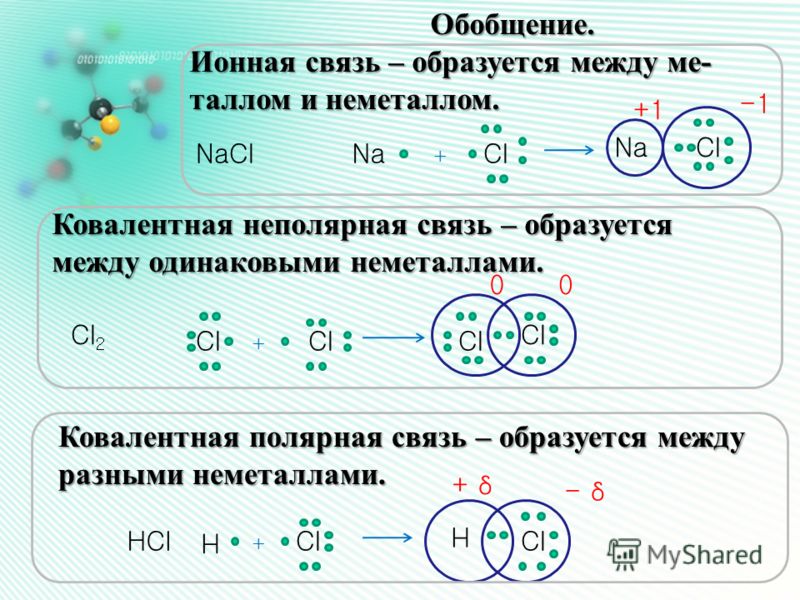
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.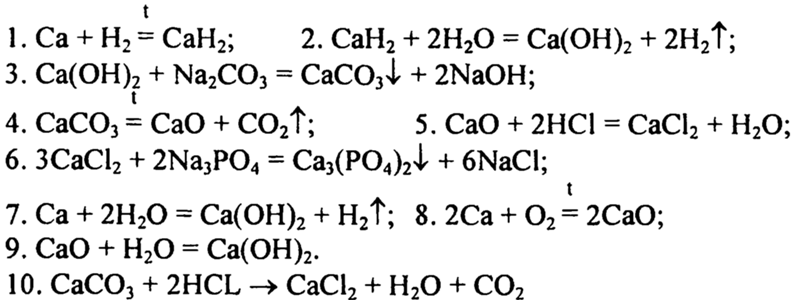
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H 2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь | Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Задание 7 ОГЭ по химии
8 ноября 2022
В закладки
Обсудить
Жалоба
TG 4ЕГЭ
ОГЭ по химии
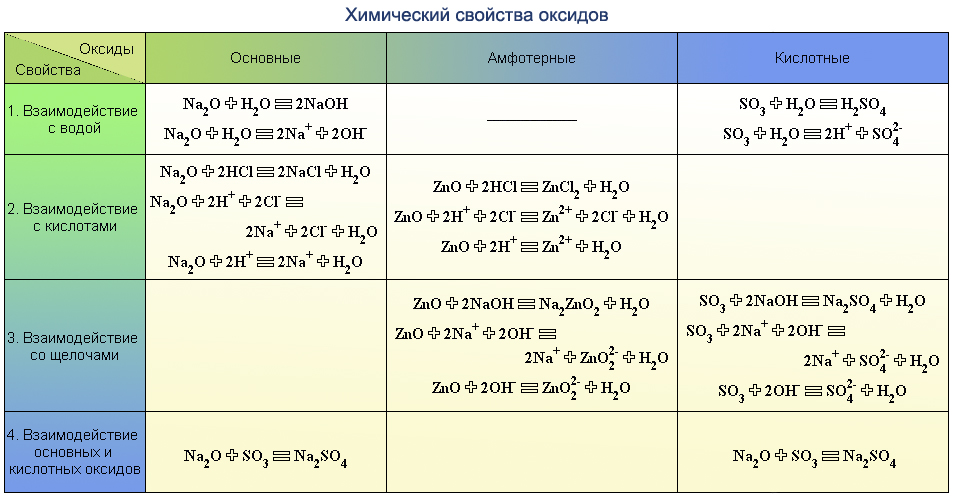
Классификация и номенклатура неорганических веществ.
Теория: 7him-t.pdf
Практика: 7him.docx | 7him.pdf
1. Из предложенного перечня веществ выберите кислотный оксид и основание.
1) CO
2) Mg(OH)2
3) SO2
4) NaClO4
5) Al(OH)3
Запишите в поле ответа сначала номер кислотного оксида, а затем номер основания.
2. Из предложенного перечня веществ выберите кислотный оксид и щёлочь.
1) HCl
2) Ca(OH)2
3) NO
4) SO2
5) Cu(OH)2
Запишите в поле ответа сначала номер кислотного оксида, а затем номер щёлочи.
3. Из предложенного перечня веществ выберите кислотный оксид и кислоту.
1) NO
2) Ca(OH)2
3) CO2
4) HClO4
5) KMnO4
Запишите в поле ответа сначала номер кислотного оксида, а затем номер кислоты.
4. Из предложенного перечня веществ выберите основный оксид и кислоту.
1) HClO4
2) NH4NO3
3) CaO
4) SO2
5) Fe(OH)3
Запишите в поле ответа сначала номер основного оксида, а затем номер кислоты.
5. Из предложенного перечня веществ выберите кислотный оксид и щёлочь.
1) H3PO4
2) NO
3) P2O5
4) NaOH
5) Cu(OH)2
Запишите в поле ответа сначала номер кислотного оксида, а затем номер щёлочи.
6. Из предложенного перечня веществ выберите оснόвный оксид и основание.
1) ZnO
2) Al(OH)3
3) Ba(OH)2
4) CO
5) K2O
Запишите в поле ответа сначала номер оснόвного оксида, а затем номер основания.
7. Из предложенного перечня веществ выберите основание и кислоту.
1) Al(OH)3
2) Ca(OH)2
3) HF
4) MgO
5) CH4
Запишите в поле ответа сначала номер основания, а затем номер кислоты.
8. Из предложенного перечня веществ выберите амфотерный оксид и амфотерный гидроксид.
1) Ag2O
2) NO2
3) ZnO
4) Al(OH)3
5) Ba(OH)2
Запишите в поле ответа сначала номер амфотерного оксида, а затем номер амфотерного гидроксида.
9. Из предложенного перечня веществ выберите кислотный оксид и кислоту.
1) Na2SO3
2) Be(OH)2
3) Cl2O7
4) H2S
5) NO
Запишите в поле ответа сначала номер кислотного оксида, а затем номер кислоты.
10. Из предложенного перечня веществ выберите несолеобразующий оксид и амфотерный оксид.
1) Cr2O3
2) CaO
3) P2O5
4) N2O
5) CO2
Ответы
1) 32
2) 42
3) 34
4) 31
5) 34
6) 53
7) 23
8) 34
9) 34
10) 41
Источник: vk.com/club193731091
Рассчитать pH насыщенного раствора при заданном Ksp
Рассчитать pH насыщенного раствора при заданном KspРасчет pH насыщенного раствора при заданном K
spНазад в меню равновесия
Имейте в виду, что эта задача не требует сосредоточенности. Мы знаем K sp и знаем, что раствор насыщен. Этой информации будет достаточно.
Внимание: вам нужно знать о K sp И кислотно-щелочные идеи для решения этой проблемы. Если вам не хватает одного или другого из этих навыков, просто имейте в виду, что вы можете немного потрудиться в своем понимании этого типа проблемы.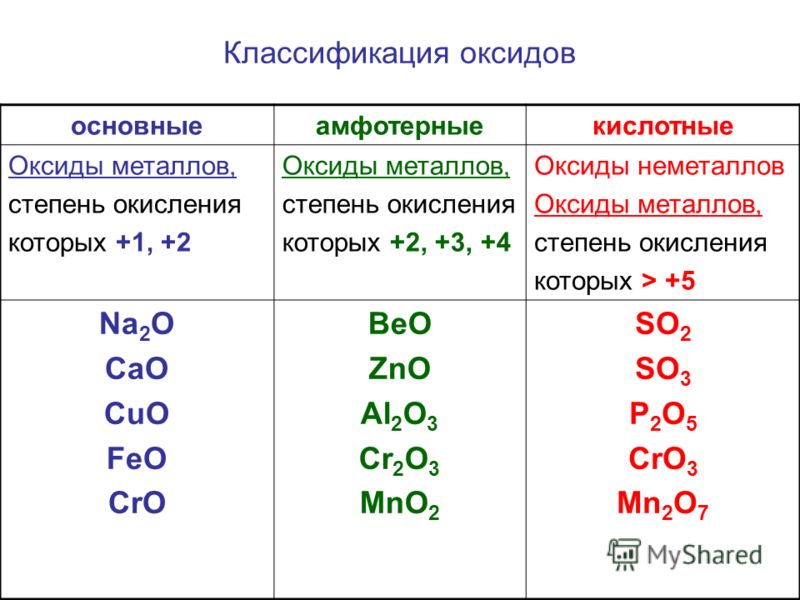
Чтобы решить задачу, мы должны сначала вычислить [OH¯]. Для этого мы будем использовать выражение K sp , а затем, в конце, мы будем использовать кислотно-основные концепции для получения pH.
Последнее примечание: K sp почти всегда приводятся в справочных источниках при 25,0 °C. Все задачи в этом руководстве выполняются при температуре 25,0 °C. Если вы столкнулись с проблемой, когда указанная температура была другой, вероятно, просто эталонный источник дал K sp , который по какой-то причине не был при 25,0 °C.
Пример #1: Рассчитайте pH насыщенного раствора AgOH, K sp = 2,0 x 10¯ 8
Решение:
AgOH ⇌ Ag + + OH¯K sp = [Ag + ] [OH¯]
2,0 x 10¯ 8 = (с) (с)
с = 1,4 x 10¯ 4 M (это [OH¯])
pOH = -log [OH¯] = -log 1,4 x 10¯ 4 = 3,85
На самом деле я взял отрицательный логарифм 1,414 .
. . х 10¯ 4 ; Я не использовал только 1.4
Поскольку pH + pOH = 14, мы имеем pH = 14 − 3,85 = 10,15
Пример #2: Рассчитать pH насыщенного раствора Mg(OH) 2 , K sp = 5,61 x 10¯ 12
Решение:
Mg(OH) 2 ⇌ Mg 2+ + 2 OH¯К sp = [Mg 2+ ] [OH¯] 2
5,61 x 10¯ 12 = (s) (2s) 2 = 4s 3
с = 1,12 х 10¯ 4 М
Это важный момент: мы вычислили ‘s’, а НЕ [OH¯]. Это значение равно «2 с».
[ОН¯] = 2,24 х 10¯ 4 М
рОН = -log 2,24 x 10¯ 4 = 3,650
pH = 14 − 3,650 = 10,350
Пример #3: Рассчитайте pH насыщенного раствора Ba(OH) 2 , K sp = 5,0 x 10¯ 3 .
Решение:
5,0 x 10¯ 3 = (с) (2с) 2с = 0,10772 М
2s = [ОН¯] = 0,21544 М
рОН = 10¯ 0,21544 = 0,67
pH = 14 − 0,67 = 13,33
Пример № 4: Каков pH насыщенного раствора Al(OH) 3 ? K sp Al(OH) 3 составляет 1,80 x 10¯ 33 . (Между прочим, есть довольно небольшая разница в сообщаемых значениях K sp для Al(OH) 3 . Я не знаю, почему это должно быть так, но я чувствовал, что это следует упомянуть, чтобы вы не не считаю необходимым написать мне по электронной почте и сказать, что я использую неправильное значение K sp .)
(Между прочим, есть довольно небольшая разница в сообщаемых значениях K sp для Al(OH) 3 . Я не знаю, почему это должно быть так, но я чувствовал, что это следует упомянуть, чтобы вы не не считаю необходимым написать мне по электронной почте и сказать, что я использую неправильное значение K sp .)
Решение:
1) Напишите выражение K sp для Al(OH) 3 :
К sp = [Al 3+ ] [OH¯] 3
2) Решите выражение K sp для концентрации гидроксида:
1,8 x 10¯ 33 = (s) (3s) 3s = 2,85744 x 10¯ 9 M
3) Определите pOH, затем pH:
pOH = −log 2,85744 x 10¯ 9 = 8,544pH = 14 − 8,544 = 5,456
4) ЭТО НЕПРАВИЛЬНО!! Обратите внимание, что вы добавили в раствор основание (Al(OH) 3 ) и получили кислый pH. ЭТОГО НЕ МОЖЕТ БЫТЬ!!
ЭТОГО НЕ МОЖЕТ БЫТЬ!!
5) Ошибка в том, что в этой ситуации мы не можем игнорировать вклад гидроксида от воды (который составляет 1,00 x 10¯ 7 M). Обычно можем, но не в этом случае. Приблизительный ответ можно получить, сложив два вклада гидроксида вместе:
1,00 x 10¯ 7 M + 2,85744 x 10¯ 9 M = 1,0285744 x 10¯ 7 M
6) Теперь сделайте pOH и pH:
pOH = −log 1,0285744 x 10¯ 7 = 6,988рН = 14 — 6,988 = 7,012
БУХ!! Это было близко!!
Пример #5: Рассчитать pH насыщенного раствора Cu(OH) 2 , K sp = 1,6 x 10¯ 19
Решение:
1) Напишите химическое уравнение:
Cu(OH) 2 ⇌ Cu 2+ + 2 OH¯
2) Напишите выражение K sp :
K sp = [Cu 2+ ] [OH¯] 21,6 x 10¯ 19 = (s) (2s) 2
s = 3,42 x 10¯ 7 M
3) Это важный момент: мы вычислили ‘s’, а НЕ [OH¯]. Значение, которое мы хотим, представлено «2s».
Значение, которое мы хотим, представлено «2s».
[ОН¯] = 6,84 х 10¯ 7 МpOH = -log 6,84 x 10¯ 7 = 6,165
pH = 14 − 6,165 = 7,835
4) Естественный вклад гидроксида от ионизации молекул воды составляет 1,00 x 10¯ 7 M. Каков новый рН, если принять во внимание гидроксид из воды?
(6,84 x 10¯ 7 M) + (1,00 x 10¯ 7 M) = 7,84 x 10¯ 7 MpOH = -log 7,84 x 10¯ 7 = 6,106
pH = 14 − 6,016 = 7,894
5) Добавление двух количеств гидроксида дает только приблизительную оценку. Более точная картина может возникнуть только при более сложных расчетах, которые выходят за рамки этого веб-сайта.
Следующие три примера представлены в форме X(OH) 2 . Это те, которые чаще всего задают в тестах и в рабочих листах. Рассчитайте рН насыщенного раствора:
Пример #6: Ca(OH) 2 , K sp = 7,9 x 10¯ 6 (pH = 12,10)
Пример #7: Mn(OH) 2 , K sp = 4,6 x 10¯ 14 (ответ не предоставлен)
Пример #8: Ni(OH) 2 , K sp = 2,8 x 10¯ 16 (ответ не предоставлен)
Назад в меню равновесия
aqion — онлайн-калькулятор pH
Добавьте 1, 2 или 3 реагента в воду:
Reac 1
Выберите . ..(Nh5)2CO3(Nh5)2Cr2O7(Nh5)2CrO4(Nh5)2HPO4(Nh5)2SO3(Nh5)2SO4(Nh5)2SeO4(Nh5)3PO4Al(NO3)3Al(OH)3Al2(SO4)3Al2O3Al2O3( CaO)3AlCl3AlF3AsI3Ba(NO3)2Ba(OH)2BaBr2BaCO3BaCl2BaF2BaI2BaSBaSO4Be(OH)2BeCl2BeF2BeSO4Ch3OCO2Ca(h3PO4)2Ca(HCO3)2Ca(NO3)2Ca(OH)2Ca3(PO4)2CaCO3CaCO3MgOCaCl2CaHPO4CaMg(CO3)2CaMoO4CaOCaOAl2O3CaOMgOCaSO4Cd(NO3)2Cd(OH)2CdBr2CdCO3CdCl2CdF2CdI2CdSO4Co(NO3) 2Co(OH)2CoCO3CoCl2CoF2CoSO4Cr(NO3)2Cr(NO3)3Cr(OH)3CrCl3CrK(SO4)2CrOHSO4Cu(NO3)2Cu(OH)2Cu3(PO4)2CuBr2CuCO3CuClCuCl2CuF2CuICuSO4Fe(HS)2Fe(NO3)2Fe(NO3)3Fe(OH)2Fe( OH)3Fe2(SO4)3FeCl2FeCl3FeF3FeHPO4FeMoO4FeNh5(SO4)2:2h3OFeSO4h3CO3h3CrO4h3MoO4h3Oh3O2h3Sh3SO3h3SO4h3Seh3SeO3h3SeO4h4AsO3h4AsO4h4BO3h4PO4h5SiO4HBrHClHClO3HClO4HCyanateHCyanideHFHIHNO2HNO3Hg(NO3)2Hg(OH)2HgBr2HgCl2HgSO4K2CO3K2CO3K2Cr2O7K2CrO4K2HPO4K2MoO4K2SO3K2SO4K2SeO4K3FeCyanide6K3PO4K4FeCyanide6KAl(SO4)2:12h3OKBrKClKCyanideKFKh3PO4KHCO3KIKMnO4KNO2KNO3KNO3KOHLiOHMg(NO3)2Mg(OH)2MgCO3MgCl2MgHPO4MgMoO4MgNh5PO4:6h3OMgOMgSO3MgSO4Mn(NO3)2Mn(NO3)2MnCO3MnCl2MnSO4Nh4Nh5Br Nh5ClNh5CyanideNh5h3PO4Nh5HCO3Nh5HSO3Nh5HSO4Nh5INh5MnO4Nh5NO3Nh5OHNa2B4O7:10h3ONa2CO3Na2Cr2O7Na2CrO4Na2HAsO4Na2HPO4Na2SNa2SO3Na2SO3Na2SO4Na2SeO4Na2SiO3Na3AsO4Na3PO4NaAl(OH)4NaAlO2NaBrNaClNaClO3NaClO4NaCyanideNaFNah3AsO4Nah3PO4NaHCO3NaHSNaHSO3NaHSO4NaNO2NaNO3NaOHNi(NO3)2Ni(OH)2NiBr2NiCO3NiCl2NiSO4Pb(BrO3)2Pb(NO3)2Pb(OH)2PbBr2PbCO3PbCl2PbF2PbI2PbSO4SO2SO3SeO2SeO3SnCl2SnCl4SnF2SnSO4Sr(NO3)2Sr(OH)2SrCO3SrCl2SrSO4U(OH)4U(SO4)2UO2CO3UO2Cl2UO2F2UO2HPO4UO2SO4Zn(NO3)2Zn(OH) 2ZnBr2ZnCO3ZnCl2ZnI2ZnSO4
..(Nh5)2CO3(Nh5)2Cr2O7(Nh5)2CrO4(Nh5)2HPO4(Nh5)2SO3(Nh5)2SO4(Nh5)2SeO4(Nh5)3PO4Al(NO3)3Al(OH)3Al2(SO4)3Al2O3Al2O3( CaO)3AlCl3AlF3AsI3Ba(NO3)2Ba(OH)2BaBr2BaCO3BaCl2BaF2BaI2BaSBaSO4Be(OH)2BeCl2BeF2BeSO4Ch3OCO2Ca(h3PO4)2Ca(HCO3)2Ca(NO3)2Ca(OH)2Ca3(PO4)2CaCO3CaCO3MgOCaCl2CaHPO4CaMg(CO3)2CaMoO4CaOCaOAl2O3CaOMgOCaSO4Cd(NO3)2Cd(OH)2CdBr2CdCO3CdCl2CdF2CdI2CdSO4Co(NO3) 2Co(OH)2CoCO3CoCl2CoF2CoSO4Cr(NO3)2Cr(NO3)3Cr(OH)3CrCl3CrK(SO4)2CrOHSO4Cu(NO3)2Cu(OH)2Cu3(PO4)2CuBr2CuCO3CuClCuCl2CuF2CuICuSO4Fe(HS)2Fe(NO3)2Fe(NO3)3Fe(OH)2Fe( OH)3Fe2(SO4)3FeCl2FeCl3FeF3FeHPO4FeMoO4FeNh5(SO4)2:2h3OFeSO4h3CO3h3CrO4h3MoO4h3Oh3O2h3Sh3SO3h3SO4h3Seh3SeO3h3SeO4h4AsO3h4AsO4h4BO3h4PO4h5SiO4HBrHClHClO3HClO4HCyanateHCyanideHFHIHNO2HNO3Hg(NO3)2Hg(OH)2HgBr2HgCl2HgSO4K2CO3K2CO3K2Cr2O7K2CrO4K2HPO4K2MoO4K2SO3K2SO4K2SeO4K3FeCyanide6K3PO4K4FeCyanide6KAl(SO4)2:12h3OKBrKClKCyanideKFKh3PO4KHCO3KIKMnO4KNO2KNO3KNO3KOHLiOHMg(NO3)2Mg(OH)2MgCO3MgCl2MgHPO4MgMoO4MgNh5PO4:6h3OMgOMgSO3MgSO4Mn(NO3)2Mn(NO3)2MnCO3MnCl2MnSO4Nh4Nh5Br Nh5ClNh5CyanideNh5h3PO4Nh5HCO3Nh5HSO3Nh5HSO4Nh5INh5MnO4Nh5NO3Nh5OHNa2B4O7:10h3ONa2CO3Na2Cr2O7Na2CrO4Na2HAsO4Na2HPO4Na2SNa2SO3Na2SO3Na2SO4Na2SeO4Na2SiO3Na3AsO4Na3PO4NaAl(OH)4NaAlO2NaBrNaClNaClO3NaClO4NaCyanideNaFNah3AsO4Nah3PO4NaHCO3NaHSNaHSO3NaHSO4NaNO2NaNO3NaOHNi(NO3)2Ni(OH)2NiBr2NiCO3NiCl2NiSO4Pb(BrO3)2Pb(NO3)2Pb(OH)2PbBr2PbCO3PbCl2PbF2PbI2PbSO4SO2SO3SeO2SeO3SnCl2SnCl4SnF2SnSO4Sr(NO3)2Sr(OH)2SrCO3SrCl2SrSO4U(OH)4U(SO4)2UO2CO3UO2Cl2UO2F2UO2HPO4UO2SO4Zn(NO3)2Zn(OH) 2ZnBr2ZnCO3ZnCl2ZnI2ZnSO4
ммоль/мг/л
Реак 2 (Nh5)2CO3(Nh5)2Cr2O7(Nh5)2CrO4(Nh5)2HPO4(Nh5)2SO3(Nh5)2SO4(Nh5)2SeO4(Nh5)3PO4Al(NO3)3Al(OH)3Al2(SO4)3Al2O3Al2O3(CaO)3AlCl3AlF3AsI3Ba(NO3 )2Ba(OH)2BaBr2BaCO3BaCl2BaF2BaI2BaSBaSO4Be(OH)2BeCl2BeF2BeSO4Ch3OCO2Ca(h3PO4)2Ca(HCO3)2Ca(NO3)2Ca(OH)2Ca3(PO4)2CaCO3CaCO3MgOCaCl2CaHPO4CaMg(CO3)2CaMoO4CaOCaOAl2O3CaOMgOCaSO4Cd(NO3)2Cd(OH)2CdBr2CdCO3CdCl2CdF2CdI2CdSO4Co(NO3)2Co(OH)2CoCO3CoCl2CoF2CoSO4Cr (NO3)2Cr(NO3)3Cr(OH)3CrCl3CrK(SO4)2CrOHSO4Cu(NO3)2Cu(OH)2Cu3(PO4)2CuBr2CuCO3CuClCuCl2CuF2CuICuSO4Fe(HS)2Fe(NO3)2Fe(NO3)3Fe(OH)2Fe(OH)3Fe2(SO4) )3FeCl2FeCl3FeF3FeHPO4FeMoO4FeNh5(SO4)2:2h3OFeSO4h3CO3h3CrO4h3MoO4h3Oh3O2h3Sh3SO3h3SO4h3Seh3SeO3h3SeO4h4AsO3h4AsO4h4BO3h4PO4h5SiO4HBrHClHClO3HClO4HCyanateHCyanideHFHIHNO2HNO3Hg(NO3)2Hg(OH)2HgBr2HgCl2HgSO4K2CO3K2CO3K2Cr2O7K2CrO4K2HPO4K2MoO4K2SO3K2SO4K2SeO4K3FeCyanide6K3PO4K4FeCyanide6KAl(SO4)2:12h3OKBrKClKCyanideKFKh3PO4KHCO3KIKMnO4KNO2KNO3KNO3KOHLiOHMg(NO3)2Mg(OH)2MgCO3MgCl2MgHPO4MgMoO4MgNh5PO4:6h3OMgOMgSO3MgSO4Mn(NO3)2Mn(NO3)2MnCO3MnCl2MnSO4Nh4Nh5BrNh5ClNh5CyanideNh 5h3PO4Nh5HCO3Nh5HSO3Nh5HSO4Nh5INh5MnO4Nh5NO3Nh5OHNa2B4O7:10h3ONa2CO3Na2Cr2O7Na2CrO4Na2HAsO4Na2HPO4Na2SNa2SO3Na2SO3Na2SO4Na2SeO4Na2SiO3Na3AsO4Na3PO4NaAl(OH)4NaAlO2NaBrNaClNaClO3NaClO4NaCyanideNaFNah3AsO4Nah3PO4NaHCO3NaHSNaHSO3NaHSO4NaNO2NaNO3NaOHNi(NO3)2Ni(OH)2NiBr2NiCO3NiCl2NiSO4Pb(BrO3)2Pb(NO3)2Pb(OH)2PbBr2PbCO3PbCl2PbF2PbI2PbSO4SO2SO3SeO2SeO3SnCl2SnCl4SnF2SnSO4Sr(NO3)2Sr(OH)2SrCO3SrCl2SrSO4U(OH)4U(SO4)2UO2CO3UO2Cl2UO2F2UO2HPO4UO2SO4Zn(NO3)2Zn(OH) 2ZnBr2ZnCO3ZnCl2ZnI2ZnSO4
ммоль/мг/л
Реак 3 (Nh5)2CO3(Nh5)2Cr2O7(Nh5)2CrO4(Nh5)2HPO4(Nh5)2SO3(Nh5)2SO4(Nh5)2SeO4(Nh5)3PO4Al(NO3)3Al(OH)3Al2(SO4)3Al2O3Al2O3(CaO)3AlCl3AlF3AsI3Ba(NO3 )2Ba(OH)2BaBr2BaCO3BaCl2BaF2BaI2BaSBaSO4Be(OH)2BeCl2BeF2BeSO4Ch3OCO2Ca(h3PO4)2Ca(HCO3)2Ca(NO3)2Ca(OH)2Ca3(PO4)2CaCO3CaCO3MgOCaCl2CaHPO4CaMg(CO3)2CaMoO4CaOCaOAl2O3CaOMgOCaSO4Cd(NO3)2Cd(OH)2CdBr2CdCO3CdCl2CdF2CdI2CdSO4Co(NO3)2Co(OH)2CoCO3CoCl2CoF2CoSO4Cr (NO3)2Cr(NO3)3Cr(OH)3CrCl3CrK(SO4)2CrOHSO4Cu(NO3)2Cu(OH)2Cu3(PO4)2CuBr2CuCO3CuClCuCl2CuF2CuICuSO4Fe(HS)2Fe(NO3)2Fe(NO3)3Fe(OH)2Fe(OH)3Fe2(SO4) )3FeCl2FeCl3FeF3FeHPO4FeMoO4FeNh5(SO4)2:2h3OFeSO4h3CO3h3CrO4h3MoO4h3Oh3O2h3Sh3SO3h3SO4h3Seh3SeO3h3SeO4h4AsO3h4AsO4h4BO3h4PO4h5SiO4HBrHClHClO3HClO4HCyanateHCyanideHFHIHNO2HNO3Hg(NO3)2Hg(OH)2HgBr2HgCl2HgSO4K2CO3K2CO3K2Cr2O7K2CrO4K2HPO4K2MoO4K2SO3K2SO4K2SeO4K3FeCyanide6K3PO4K4FeCyanide6KAl(SO4)2:12h3OKBrKClKCyanideKFKh3PO4KHCO3KIKMnO4KNO2KNO3KNO3KOHLiOHMg(NO3)2Mg(OH)2MgCO3MgCl2MgHPO4MgMoO4MgNh5PO4:6h3OMgOMgSO3MgSO4Mn(NO3)2Mn(NO3)2MnCO3MnCl2MnSO4Nh4Nh5BrNh5ClNh5CyanideNh 5h3PO4Nh5HCO3Nh5HSO3Nh5HSO4Nh5INh5MnO4Nh5NO3Nh5OHNa2B4O7:10h3ONa2CO3Na2Cr2O7Na2CrO4Na2HAsO4Na2HPO4Na2SNa2SO3Na2SO3Na2SO4Na2SeO4Na2SiO3Na3AsO4Na3PO4NaAl(OH)4NaAlO2NaBrNaClNaClO3NaClO4NaCyanideNaFNah3AsO4Nah3PO4NaHCO3NaHSNaHSO3NaHSO4NaNO2NaNO3NaOHNi(NO3)2Ni(OH)2NiBr2NiCO3NiCl2NiSO4Pb(BrO3)2Pb(NO3)2Pb(OH)2PbBr2PbCO3PbCl2PbF2PbI2PbSO4SO2SO3SeO2SeO3SnCl2SnCl4SnF2SnSO4Sr(NO3)2Sr(OH)2SrCO3SrCl2SrSO4U(OH)4U(SO4)2UO2CO3UO2Cl2UO2F2UO2HPO4UO2SO4Zn(NO3)2Zn(OH) 2ZnBr2ZnCO3ZnCl2ZnI2ZnSO4
ммоль/мг/л
Допускается осаждение минералов
Равновесие с атмосферным CO 2 («Открытая система»)
Очистить все
Кислотные реагенты
90
| (NH 4 ) 2 Cr 2 O 7 | дихромат аммония |
| (NH 4 ) 2 SeO 4 | селенат аммония |
| (НХ 4 ) 2 СО 4 | сульфат аммония |
| Ал(НО 3 ) 3 | нитрат алюминия |
| Ал(ОН) 3 | гидроксид алюминия |
| Al2(SO 4 ) 3 | сульфат алюминия |
| AlCl 3 | хлорид алюминия |
| AlF 3 | фторид алюминия |
| АСИ 3 | йодид мышьяка(III) (мышьяковистый . .. .. |
| BeCl 2 | хлорид бериллия |
| BeF 2 | фторид бериллия |
| BeSO 4 | сульфат бериллия |
| Ca(H 2 ПО 4 ) 2 | кальция дигидрофосфат |
| СН 2 О | 1/6 глюкозы |
| СО 2 | двуокись углерода |
| CrCl 3 | хлорид хрома(III) |
| CrK(SO 4 ) 2 | хромовые алюмы |
| CrOHSO 4 | сульфат гидроксида хрома(III) |
| Cu(№ 3 ) 2 | нитрат меди(II) (нитрит меди… |
| CuBr 2 | бромид меди(II) (медный бр… |
| CuCl 2 | хлорид меди(II) (д… |
| CuF 2 | фторид меди(II) (медный. .. .. |
| CuSO4 | сульфат меди(II) (медная сера… |
| Fe(№ 3 ) 3 | нитрат железа(III) |
| Fe2(SO 4 ) 3 | сульфат железа(III) |
| FeCl 2 | железа(II) хлорид (хлор железа… |
| FeCl 3 | железа(III) хлорид |
| FeF 3 | фторид железа(III) |
| FeNH 4 (SO 4 ) 2 :2H 2 O | железо амм. сульфат (железа алаун) |
| FeSO 4 | сульфат железа(II) |
| H 2 CO 3 | угольная кислота |
| H 2 CrO 4 | хромовая кислота |
| H 2 MoO 4 | молибденовая кислота (MoO3:h3O) |
| В 2 Ю | сероводород |
| Н 2 Се | селенид водорода |
| Н 2 СеО 3 | селенистая кислота |
| H 2 SeO 4 | селеновая кислота |
| H 2 SO 3 | сернистая кислота |
| H 2 SO 4 | серная кислота |
| Н 3 АсО 3 | мышьяковистая кислота |
| Н 3 АсО 4 | мышьяковая кислота |
| Н 3 ВО 3 | борная кислота |
| H 3 Заказ на покупку 4 | ортофосфорная кислота |
| H 4 SiO 4 | кремниевая кислота |
| HBr | бромистоводородная кислота |
| HCl | соляная кислота |
| Гицианат | изоциановая кислота, HOCN |
| Гидроцианид | синильная кислота, HCN |
| ВЧ | фтористоводородная кислота |
| Hg(NO 3 ) 2 | нитрат ртути(II) |
| HgCl 2 | хлорид ртути(II) |
| HgSO 4 | сульфат ртути(II) |
| Привет | йодистоводородная кислота |
| HNO 2 | азотистая кислота |
| HNO 3 | азотная кислота |
| К 2 Cr 2 O 7 | дихромат калия |
| КН 2 ПО 4 | дигидрофосфат калия |
| Na 2 Cr 2 O 7 | дихромат натрия |
| Нет данных 2 SO 3 | сульфит натрия |
| NaH 2 AsO 4 | дигидроарсенат натрия |
| NaH 2 ПО 4 | дигидрофосфат натрия |
| NaHSO 3 | гидросульфит натрия |
| NaHSO 4 | гидросульфат натрия |
| НХ 4 Бр | бромид аммония |
| NH 4 Класс | хлорид аммония (салмиак) |
| NH 4 H 2 Заказ на покупку 4 | дигидрофосфат аммония |
| NH 4 HSO 4 | гидросульфат аммония |
| НХ 4 I | иодид аммония |
| NH 4 НЕТ 3 | нитрат аммония |
| Ni(НО 3 ) 2 | нитрат никеля(II) |
| Pb(BrO 3 ) 2 | бромат свинца(II) |
| Pb(NO 3 ) 2 | нитрат свинца(II) |
| PbBr 2 | бромид свинца(II) |
| PbCl 2 | хлорид свинца(II) |
| ПбФ 2 | фторид свинца(II) |
| ПБИ 2 | йодид свинца(II) |
| PbSO 4 | сульфат свинца(II) |
| СеО 2 | диоксид селена |
| СеО 3 | триоксид селена |
| СО 2 | диоксид серы |
| СО 3 | триоксид серы |
| У(СО 4 ) 2 | урана(IV) сульфат |
| UO 2 Класс 2 | уранилхлорид |
| UO 2 CO 3 | уранилкарбонат |
| UO 2 SO 4 | уранилсульфат |
| Zn(NO 3 ) 2 | нитрат цинка |
| ZnBr 2 | бромид цинка |
| ZnCl 2 | хлорид цинка |
| ЦНИ 2 | йодид цинка |
Основные реагенты
80
| (NH 4 ) 2 CO 3 | карбонат аммония |
| (NH 4 ) 2 CrO 4 | хромат аммония |
| (NH 4 ) 2 HPO 4 | гидрофосфат аммония |
| (NH 4 ) 2 SO 3 | сульфит аммония |
| (NH 4 ) 3 Заказ на поставку 4 | фосфат аммония |
| Al 2 O 3 (CaO) 3 | трехкальциевый алюминат |
| Ва(ОН) 2 | гидроксид бария |
| БаСО 3 | карбонат бария |
| БаИ 2 | иодид бария |
| БаС | сульфид бария |
| Ве(ОН) 2 | гидроксид бериллия |
| Ca(HCO 3 ) 2 | гидрокарбонат кальция |
| Са(ОН) 2 | гидроксид кальция (известь, CaO:H. .. .. |
| Ca 3 (PO 4 ) 2 | фосфат кальция |
| СаСО 3 | карбонат кальция (кальцит) |
| CaCO 3 MgO | полуобожженный доломит |
| CaHPO 4 | гидрофосфат кальция |
| CaMg(CO 3 ) 2 | доломит (минерал) |
| CaMoO 4 | молибдат кальция (повеллит) |
| СаО | негашеная известь |
| CaOAl 2 O 3 | алюминат кальция |
| CaOMgO | обожженный доломит |
| Cd(OH) 2 | гидроксид кадмия |
| CdCO 3 | карбонат кадмия |
| Cr(OH) 3 | гидроксид хрома(III) |
| Cu(OH) 2 | гидроксид меди(II) |
| Fe(HS) 2 | железо(II) сероводород |
| Fe(OH) 2 | железа(II) гидроксид (железо-гидр. .. .. |
| Fe(OH) 3 | железа(III) гидроксид (железо-гидр… |
| FeHPO 4 | гидрофосфат железа(III) |
| Hg(OH) 2 | ртути(II) гидроксид |
| К 2 СО 3 | карбонат калия |
| К 2 CrO 4 | хромат калия |
| К 2 ГПО 4 | гидрофосфат калия |
| К 2 МО 4 | молибдат калия |
| К 2 СО 3 | сульфит калия |
| К 3 Заказ на поставку 4 | фосфат калия |
| KAl(SO 4 ) 2 :12H 2 O | сульфат алюминия калия |
| КНСО 3 | гидрокарбонат калия |
| КМНО 4 | перманганат калия |
| КНО 2 | нитрит калия |
| КОН | гидроксид калия (едкий р. .. .. |
| LiOH | гидроксид лития |
| Мг(ОН) 2 | гидроксид магния (MgO:h3O) |
| MgCO 3 | карбонат магния |
| МгГПО 4 | гидрофосфат магния |
| MgMoO 4 | молибдат магния |
| MgO | оксид магния |
| MgSO 3 | сульфит магния |
| MnCO 3 | марганца(II) карбонат |
| Na 2 B 4 O 7 :10H 2 O | борат натрия (бура) |
| Na 2 CO 3 | карбонат натрия (кальцинированная сода) |
| Na 2 CrO 4 | хромат натрия |
| Na 2 HAsO 4 | гидроарсенат динатрия |
| Нет 2 ГПО 4 | гидрофосфат динатрия |
| Нет 2 С | сульфид натрия |
| Na 2 SiO 3 | метасиликат натрия |
| Na 3 AsO 4 | арсенат натрия |
| На 3 Заказ на покупку 4 | тринатрийфосфат |
| NaAl(OH) 4 | алюминат натрия |
| NaAlO 2 | алюминат натрия |
| NaHCO 3 | гидрокарбонат натрия |
| NaHS | сероводород натрия |
| NaOH | гидроксид натрия |
| НХ 3 | аммиак |
| NH 4 Цианид | цианид аммония |
| NH 4 HCO 3 | гидрокарбонат аммония |
| NH 4 MnO 4 | перманганат аммония |
| НХ 4 ОХ | гидроксид аммония (Nh4:h3O) |
| Ni(ОН) 2 | гидроксид никеля(II) |
| NiCO 3 | карбонат никеля(II) |
| Pb(OH) 2 | гидроксид свинца(II) |
| PbCO 3 | карбонат свинца(II) |
| Sr(OH) 2 | гидроксид стронция |
| SrCO 3 | карбонат стронция |
| U(ОН) 4 | гидроксид урана(IV) |
| Zn(ОН) 2 | гидроксид цинка |
| ZnCO 3 | карбонат цинка |
| ZnSO 4 | сульфат цинка |
Нейтральные реагенты
49



 . . х 10¯ 4 ; Я не использовал только 1.4
. . х 10¯ 4 ; Я не использовал только 1.4