Аргон: применение, получение, история — «ИСКРОЛАЙН»
Авторы:
сотрудники компанииАналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аргон – элемент с атомной массой 39,944 и порядковым номером 18. Принадлежит к 8-ой группе главной подгруппы таблицы Менделеева, относится к благородным инертным одноатомным газам. Не обладает ни запахом, ни цветом, ни вкусом. Негорючий и невзрывоопасный.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном. Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Получение Аргона
Аргон — наиболее распространенный в воздухе инертный газ. В 1 м3 содержится примерно 0,09 см3 ксенона, 1,1 см3 криптона, 5,2 см3 гелия, 18,2 см3 неона, 9000 см3 аргона.
В атмосфере Земли аргон занимает третье место. На первом – азот, на втором — кислород. В процентном отношении это примерно 0,93% по объёму или 1.3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
Получение и промышленное производство этого газа происходит как выделение сопутствующего газа при добыче азота и кислорода из атмосферного воздуха. Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Кроме того, аргон получают при производстве аммиака. Доочистку аргона осуществляют по технологии гидрирования с платиновым катализатором или адсорбционным методом с использованием молекулярных сит или активного угля.
Применение Аргона
Основными потребителями аргона являются:
Металлургия. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше. Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Спектральный анализ и метрология. В данной сфере аргон наиболее часто используется как газ-носитель, инертная среда и плазмообразующий газ в контрольно-измерительных приборах, а также при производстве поверочных газовых смесей (ПГС) для различных газоанализаторов.
В данной сфере применения чистота аргона имеет ключевое значение. Даже при минимальных отклонениях качества аргона от соответствующих ГОСТов и ТУ, регламентированных для использования в конкретных приборах, изменяются условия работы и анализа, что приводит к серьезным искажениям результатов измерений, нарушению работоспособности оборудования, снижению качества продукции, снижению ресурса фильтров и, как следствие, серьезным экономическим убыткам.
Для предотвращения вышеописанного, могут использоваться специализированные фильтры, а также установки доочистки аргона (инертных газов) лабораторного или промышленного назначения.
Так как наша компания занимается разработкой и производством спектрометров, применение аргона в этих приборах мы решили рассмотреть более подробно. Ниже в статье этому будет посвящена отдельная глава.
Ниже в статье этому будет посвящена отдельная глава.
Прочие сферы применения. Огнетушительные установки, заполнение стеклопакетов и поддув сухих гидрокостюмов водолазов для лучшей теплоизоляции, в медицине — очистка разрезов при хирургическом вмешательстве, в химической промышленности — инертная среда для нестабильных на воздухе соединений, а так же в прочих областях промышленности.
Продолжение >
Аргон | это… Что такое Аргон?
| 18 | Аргон |
Ar 39,948 | |
| 3s23p6 | |
Арго́н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440-37-1) — инертный одноатомный газ без цвета, вкуса и запаха.
Простое вещество аргон (CAS-номер: 7440-37-1) — инертный одноатомный газ без цвета, вкуса и запаха.
Содержание
|
История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырек газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[3][4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырек газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[3][4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота[3].
Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота[3].
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос[3][4].
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)[4].
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней[3].
Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней[3].
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа[3].
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[3].
Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[3].
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[3].
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов[3].
Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов[3].
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %)[3][4]. Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон[3].
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии[3].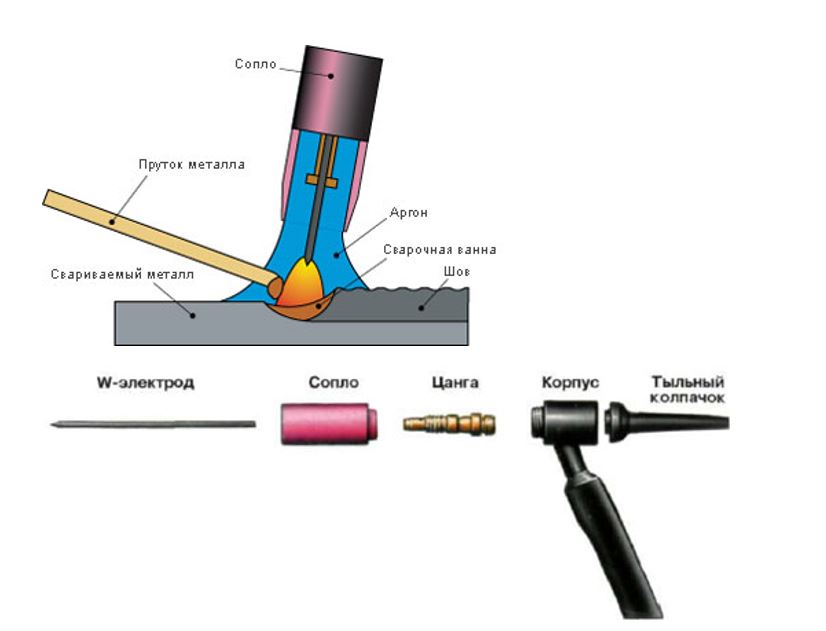
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность[3].
Распространённость
Во Вселенной
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе[6].
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения[7].
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе[4][7], его запасы в атмосфере оцениваются в 4·1014 т[2][4]. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона)[4][7].
Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона)[4][7].
Содержание аргона в литосфере — 4·10−6 % по массе[2]. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10−5 — 9,7·10−5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т[7].
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа[2].
Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа[2].
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. Плотность при нормальных условиях составляет 1,7839 кг/м3
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние.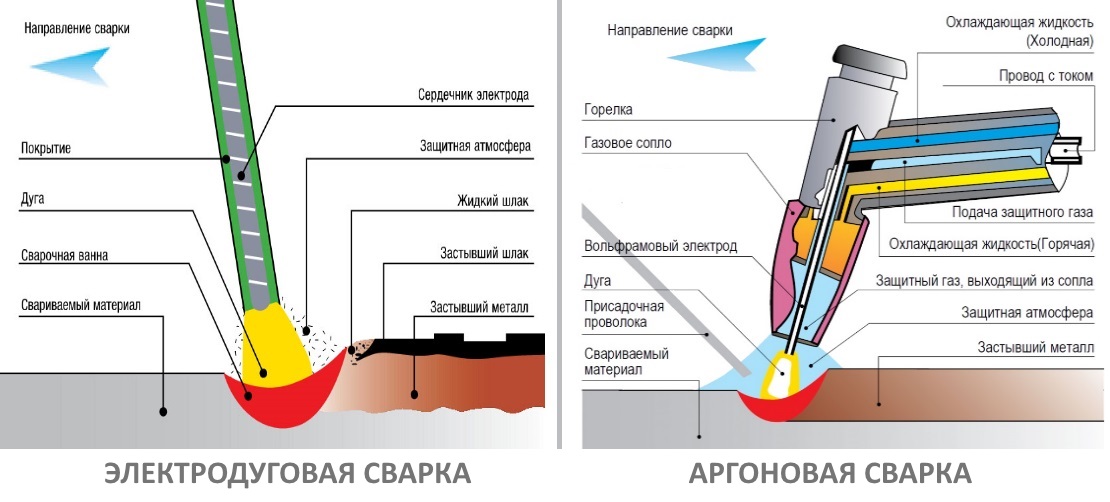 Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO[8]. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы
Основная статья: Изотопы аргона
Спектр аргона
Аргон представлен в земной атмосфере тремя стабильными изотопами: [4][7]. Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона[7].
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
Применение
Заполненная аргоном и парами ртути газоразрядная трубка
Ниже перечислены области применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т.
 п.) как металлов (например, титана), так и неметаллов
п.) как металлов (например, титана), так и неметаллов - в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
- в медицине во время операций для очистки воздуха и разрезов, так как аргон почти не образует химических соединений
- в качестве составной части атмосферы эксперимента Марс-500[9] с целью снижения уровня кислорода для предотвращения пожара на борту космического корабля при путешествии на Марс
- из-за низкой теплопроводности аргон применяется в дайвинге для поддува сухих гидрокостюмов, однако есть ряд недостатков:
- высокая цена газа (кроме этого нужна отдельная система для аргона)
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа[10].
Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа[10].
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания)[11].
Примечания
- ↑ 1 2 3 Size of argon in several environments (англ.). www.webelements.com. Проверено 6 августа 2009.
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 194. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Финкельштейн Д.
 Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 30-38. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 30-38. — 200 с. — («Наука и технический прогресс»). — 19 000 экз. - ↑ 1 2 3 4 5 6 7 8 Фастовский В.Г., Ровинский А.Е., Петровский Ю.В. Глава первая. Открытие. Происхождение. Распространенность. Применение // Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3-13. — 352 с. — 2400 экз.
- ↑ Mary Elvira Weeks. XVIII. The inert gases // Discovery of the elements : collected reprints of a series of articles published in the Journal of Chemical Education. — 3rd ed. rev. — Kila, MT: Kessinger Publishing, 2003. — P. 286-288. — 380 p. — ISBN 0766138720 9780766138728
- ↑ Argon: geological information (англ.). www.webelements.
 com. Проверено 9 августа 2009.
com. Проверено 9 августа 2009. - ↑ 1 2 3 4 5 6 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76-110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Science Magazine: Sign In | Science/AAAS
- ↑ Снежана Шабанова Инертные опыты на людях. Проект «Марс-500» (16 апреля 2008).
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Архивировано из первоисточника 21 августа 2011. Проверено 6 августа 2009.
- ↑ Argon (Ar) — Chemical properties, Health and Environmental effects (англ.
 ). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 6 августа 2009.
). www.lenntech.com. Архивировано из первоисточника 22 августа 2011. Проверено 6 августа 2009.
Ссылки
- Аргон // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907. Статья Вуколова С. П.
- CTPETT (Strutt), Дж. У., лорд Рэлей (Lord Rayleigh)
- Аргон на Webelements
- Аргон в Популярной библиотеке химических элементов
- Химия инертных газов — библиотечка журнальных статей «Всякая всячина»
- Термодинамические и переносные свойства аргона
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Аргон | Свойства, использование, атомный номер и факты
аргон
Посмотреть все СМИ
- Ключевые люди:
- сэр Уильям Рамзи Лорд Рэлей
- Похожие темы:
- химический элемент благородный газ воздух аргон-40
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
аргон (Ar) , химический элемент, инертный газ группы 18 (благородные газы) периодической таблицы, наиболее распространенный на Земле и наиболее часто используемый в промышленности из благородных газов.
По распространенности в космосе аргон занимает примерно 12-е место среди химических элементов. Аргон составляет 1,288 % атмосферы по весу и 0,934 % по объему и содержится в горных породах. Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента земного аргона соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 при распаде калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента земного аргона соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 при распаде калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Аргон выделяют в больших масштабах путем фракционной перегонки жидкого воздуха. Он используется в газонаполненных электрических лампочках, радиолампах и счетчиках Гейгера. Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Газообразный аргон конденсируется в бесцветную жидкость при –185,8 °C (–302,4 °F) и в кристаллическое твердое вещество при –1890,4 ° C (-308,9 ° F). Газ нельзя сжижать под давлением выше температуры -122,3 ° C (-188,1 ° F), и в этот момент для его сжижения требуется давление не менее 48 атмосфер. При 12 ° C (53,6 ° F) 3,94 объема газообразного аргона растворяются в 100 объемах воды. Электрический разряд в аргоне при низком давлении выглядит бледно-красным, а при высоком давлении — сине-стальным.
Самая внешняя (валентная) оболочка аргона имеет восемь электронов, что делает ее чрезвычайно стабильной и, таким образом, химически инертной. Атомы аргона не соединяются друг с другом; также не наблюдалось их химического соединения с атомами любого другого элемента. Атомы аргона были механически захвачены в подобных клеткам полостях среди молекул других веществ, как, например, в кристаллах льда или органического соединения гидрохинона (называемого клатратами аргона).
| −185,7 ° C (−302,3 ° F) | |
| Плотность (1 атм, 0 ° C) | 1,784 г/литр |
|---|---|
| Состояние окисления. | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 |
The Editors of Encyclopaedia BritannicaThis article was последний раз переработанный и обновленный Эриком Грегерсеном.
Факты об аргоне | Живая наука
Газ аргон используется при дуговой сварке. (Изображение предоставлено: chinahbzyg | Shutterstock ) Аргон — инертный элемент без цвета и запаха — один из благородных газов. Этот элемент, используемый в люминесцентных лампах и при сварке, получил свое название от греческого слова, означающего «ленивый», в честь того, как мало он вступает в реакцию с образованием соединений.
На Земле подавляющее большинство аргона представляет собой изотоп аргон-40, который возникает в результате радиоактивного распада калия-40, согласно Chemicool. Но в космосе аргон образуется в звездах, когда два ядра водорода или альфа-частицы сливаются с кремнием-32. В результате получается изотоп аргон-36. (Изотопы элемента имеют различное количество нейтронов в ядре.)
Хотя аргон инертен, он далеко не редкость; по данным Королевского химического общества (RSC), он составляет 0,94 процента атмосферы Земли. По расчетам Chemicool, это составляет 65 триллионов метрических тонн, и это число увеличивается со временем по мере распада калия-40.
Только факты
По данным Национальной лаборатории линейных ускорителей Джефферсона, свойства аргона:
- Атомный номер (количество протонов в ядре): 18
- Атомный символ (в Периодической таблице элементов): Ar
- Атомный вес (средняя масса атома): 39,948
- Плотность: 0,0017837 грамм на кубический сантиметр
- Фаза при комнатной температуре: Газ
- Температура плавления: минус 308,83 градуса по Фаренгейту (минус 189,35 градуса по Цельсию)
- Температура кипения: минус 302,53 F (минус 185,85 C)
- Количество изотопов (атомов одного и того же элемента с разным числом нейтронов): 25; 3 стабильных
- Наиболее распространенные изотопы: Ar-40 (99,6035 процента естественного содержания), Ar-40 (0,0629 процента естественного содержания), Ar-36 (0,3336 процента естественного содержания)
Использование инертного газа
Первый намек на существование аргона появился в 1785 году, когда британский ученый Генри Кавендиш сообщил о кажущейся инертной части воздуха, по данным RSC. Кавендиш не мог понять, что это за таинственный 1 процент; открытие произошло более века спустя, в 1894 году. Работая одновременно и в общении с лордом Рэлеем (Джон Уильям Струтт), шотландский химик Уильям Рэмси идентифицировал и описал загадочный газ. Они разделили Нобелевскую премию по химии в 1904 за открытие. Аргон также привел к другим моментам озарения для Рэмси. По данным организации, присуждающей Нобелевскую премию, при исследовании этого элемента он также обнаружил гелий. Понимая, что родственные элементы, вероятно, существуют, он быстро нашел неон, криптон и ксенон.
Кавендиш не мог понять, что это за таинственный 1 процент; открытие произошло более века спустя, в 1894 году. Работая одновременно и в общении с лордом Рэлеем (Джон Уильям Струтт), шотландский химик Уильям Рэмси идентифицировал и описал загадочный газ. Они разделили Нобелевскую премию по химии в 1904 за открытие. Аргон также привел к другим моментам озарения для Рэмси. По данным организации, присуждающей Нобелевскую премию, при исследовании этого элемента он также обнаружил гелий. Понимая, что родственные элементы, вероятно, существуют, он быстро нашел неон, криптон и ксенон.
Поскольку аргон инертен, он используется в промышленных процессах, требующих инертной атмосферы. Примеры, по данным газоснабжающей компании Praxair, включают сварку специальных сплавов и производство полупроводниковых пластин. Аргон также является хорошим изолятором, поэтому его часто закачивают в сухие гидрокостюмы для глубоководных погружений, чтобы согреть дайвера.
Еще одно применение аргона — сохранение исторических памятников. Газом обрабатывают важные документы, такие как карта мира 1507 года, хранящаяся в Библиотеке Конгресса, и копия Великой хартии вольностей, хранящаяся в Национальном архиве США. В отличие от реактивного кислорода, аргон не разрушает бумагу или чернила на деликатных документах.
Газом обрабатывают важные документы, такие как карта мира 1507 года, хранящаяся в Библиотеке Конгресса, и копия Великой хартии вольностей, хранящаяся в Национальном архиве США. В отличие от реактивного кислорода, аргон не разрушает бумагу или чернила на деликатных документах.
Кто знал?
- Неоновые огни, которые светятся синим, на самом деле содержат аргон, по словам Билла Конкэннона, художника по неоновой вывеске из Крокетта, Калифорния. (Сам неон излучает оранжево-красное свечение.)
- Аргон также используется в лазерных технологиях, включая эксимерный лазер на фториде аргона (ArF), который используется для проведения операций LASIK или ФРК для коррекции зрения. По данным Оптического общества, в 1981 году Рангасвами «Шри» Шринивасан из IBM испытал один из этих лазеров на оставшейся ко Дню Благодарения кости индейки и обнаружил его потенциал в качестве хирургического инструмента для деликатных операций.

- В сентябре 2014 года исследователи обнаружили, что загрязненные подземные воды в Пенсильвании и Техасе поступают не из-за метода добычи нефти, известного как гидроразрыв пласта, а из негерметичных обсадных труб. Они сделали это открытие, закачав аргон и другие индикаторы инертных газов в скважины, где они смешались с метаном.
- Аргон претерпел некоторые изменения: в 1957 году Международный союз теоретической и прикладной химии (IUPAC) изменил его атомный символ с «А» на сегодняшний «Ar».
Текущие исследования
В течение многих лет благородный газ ксенон изучался как лечение травм головного мозга. Ксенон, однако, дорог, поэтому исследователи обращаются к его двоюродному брату благородному газу, аргону, как к потенциальной альтернативе.
Область исследований еще молода, но эксперименты на клеточных культурах и животных позволяют предположить, что однажды аргон можно будет использовать для ограничения повреждения головного мозга после травм или кислородного голодания. В одном обзоре, опубликованном в журнале Medical Gas Research в феврале 2014 года, было обнаружено, что в большинстве случаев обработка аргоном значительно снижает гибель клеток головного мозга — на 15–25 процентов, — сказал Дерек Новранги, один из авторов статьи и докторант в Лома Линда. Университетская школа медицины в Калифорнии.
В одном обзоре, опубликованном в журнале Medical Gas Research в феврале 2014 года, было обнаружено, что в большинстве случаев обработка аргоном значительно снижает гибель клеток головного мозга — на 15–25 процентов, — сказал Дерек Новранги, один из авторов статьи и докторант в Лома Линда. Университетская школа медицины в Калифорнии.
Пока никто не понимает, почему аргон имеет такой эффект. Клетки мозга общаются с помощью химических веществ, называемых нейротрансмиттерами, и нейрорецепторов, которые подходят друг к другу, как замок и ключ. Скорее всего, сказал Новранги Live Science, газ воздействует на эти нейрорецепторы, в частности, на рецептор NMDA (что означает N-метил-D-аспартат для нейротрансмиттера, который он получает) или рецептор ГАМК (что означает гамма-аминомасляная кислота). Каким-то образом аргон, поглощаемый этими рецепторами, предотвращает самоуничтожение клеток в ответ на повреждение головного мозга.
В исследованиях газообразный аргон либо непосредственно воздействуют на клетки в чашке для культивирования, которые находятся в состоянии стресса, например, в среде, лишенной кислорода и глюкозы, либо смешивают с кислородом в лицевой маске для исследований на животных. Затем исследователи подсчитывают количество клеток, погибших с обработкой аргоном и без нее.
Затем исследователи подсчитывают количество клеток, погибших с обработкой аргоном и без нее.
По мере того, как исследования аргона набирают обороты, более вероятно, что начнутся испытания на людях, сказал Новранги. Но есть предостережения: некоторые исследования показывают неоднозначные результаты или отрицательные эффекты лечения аргоном. В одном случае, по словам Новранги, мозг в целом казался защищенным аргоном, но повреждение одной области фактически увеличилось при обработке газом. Это может быть связано с тем, что аргон не проник в эту область, или с тем, что разные области мозга имеют разные типы клеток и плотность клеток.
«Это все еще требует большого количества исследований, чтобы действительно можно было применить в клинике», — сказал Новранги.
Подписывайтесь на Live Science @livescience , Facebook и Google+ .
Дополнительные ресурсы
- Лаборатория Джефферсона: The Element Argon
- Национальная лаборатория Лос-Аламоса: Argon
- Королевское химическое общество: Argon
Стефани Паппас — автор статей для журнала Live Science, освещающего самые разные темы — от геонаук до археологии, человеческого мозга и поведения.
