что это такое, плюс или минус, определяем полярность
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
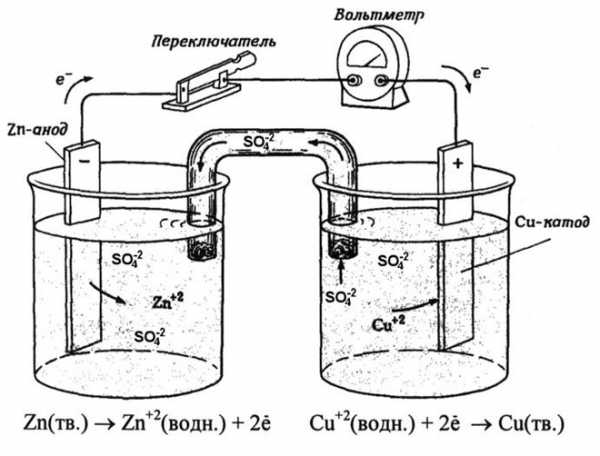
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод – положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
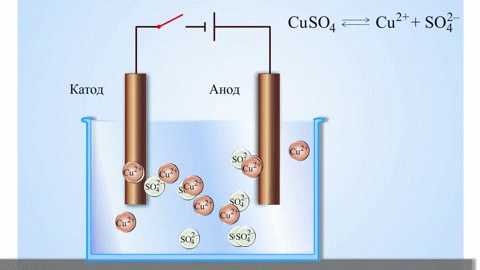
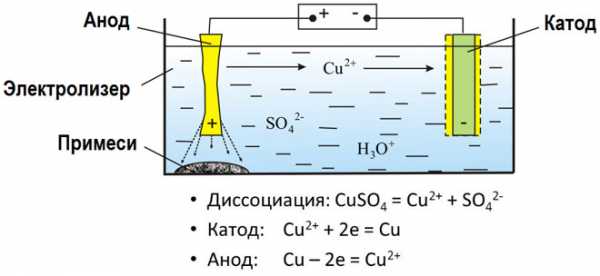
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Электроэкстракция – процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.

Гальванопластика – процесс получения металлических копий с объёмных предметов электроосаждением металла.

Применение в вакуумных электронных приборах
Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
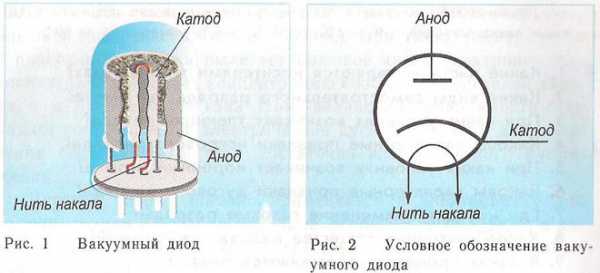
Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
Применение в электронике
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.
Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.

При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Почему существует путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный. Часто, но не всегда. Все зависит от процесса, протекающего на электроде.
ВНИМАНИЕ! Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его.
Как определить анод и катод
В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
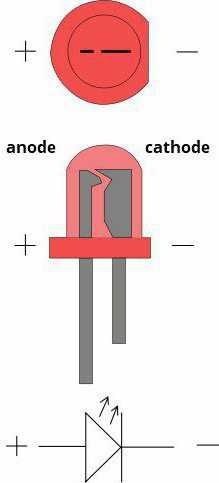
У диода отводы называются анод и катод. Ток будет идти через диод, если отвод анод подключить к «плюсу», отвод «катод» — к «минусу».
У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче.
Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут.
Знак анода и катода
В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному.
odinelectric.ru
Катод — это… Что такое Катод?
Катод (от греч. κάθοδος — ход вниз; возвращение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии
В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает процесс окисления[1][2]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
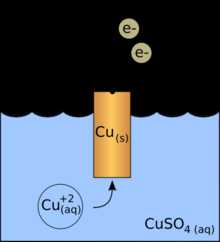
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «+» катод гальванического элемента, на котором происходит восстановление меди.
В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока. [2][3][4].
В электротехнике катод — отрицательный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
dic.academic.ru
химия-физика. Почему в гальваническом элементе анод имеет отрицательный заряд, а в электролизе положительный?
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд) , здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового) , избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка) , то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди) , то есть катодом будет являться положительный электрод.
1. Потому что так ПРИНЯТО 2. Или, если хотите, потому, что при электролизе ионы двигаются электрическим полем — вот и должен быть АНОД положительным, чтобы отрицательные АНИОНЫ к нему притягивались (анод — это электрод, К КОТОРОМУ идут анионы… ) А вот в гальваническом элементе есть ЭДС, то есть некие силы не электрической природы, которые передвигают ионы ПРОТИВ электрического поля (чтобы его создавать) , то есть передвигают АНИОНЫ к электроду, заряженному отрицатально, против сил отталкивания — чтобы они там накапливались, и этот отрицательны заряд СОЗДАВАЛИ…
touch.otvet.mail.ru
Ответы@Mail.Ru: как назыается отрицательный электрод
Все ответы неверны! Электрод называется не по заряду, а по процессу. Например, в гальваническом элементе отрицательный электрод — это АНОД, т. к. на нём идёт процесс ОКИСЛЕНИЯ. Но при электролизе электрод, на котором идёт окисление (анод) — положительный. А катод — отрицателен. Дополните свой вопрос названием процесса и получите ответ.
Положительный — анод. Отрицательный — катод.
touch.otvet.mail.ru
Анод и катод — что это и как правильно определить?
Образование 21 марта 2016Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии. Наиболее популярное объяснение звучит следующим образом: анод – это положительный электрод, а катод – отрицательный. Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как. Давайте рассмотрим это в рамках статьи.
Анод
 Обратимся к ГОСТ 15596-82, который занимается химическими источниками тока. Нас интересует информация, размещённая на третьей странице. Согласно ГОСТу, отрицательным электродом химического источника тока является именно анод. Вот так да! А почему именно так? Дело в том, что именно через него электрический ток входит из внешней цепи в сам источник. Как видите, не всё так легко, как кажется на первый взгляд. Можно посоветовать внимательно рассматривать представленные в статье картинки, если содержимое кажется слишком сложным – они помогут понять, что же автор хочет вам донести.
Обратимся к ГОСТ 15596-82, который занимается химическими источниками тока. Нас интересует информация, размещённая на третьей странице. Согласно ГОСТу, отрицательным электродом химического источника тока является именно анод. Вот так да! А почему именно так? Дело в том, что именно через него электрический ток входит из внешней цепи в сам источник. Как видите, не всё так легко, как кажется на первый взгляд. Можно посоветовать внимательно рассматривать представленные в статье картинки, если содержимое кажется слишком сложным – они помогут понять, что же автор хочет вам донести.
Катод
Обращаемся всё к тому же ГОСТ 15596-82. Положительным электродом химического источника тока является тот, при разряде из которого он выходит во внешнюю цепь. Как видите, данные, содержащиеся в ГОСТ 15596-82, рассматривают ситуацию с другой позиции. Поэтому при консультировании с другими людьми насчет определённых конструкций необходимо быть очень осторожным.
Возникновение терминов
 Их ввёл ещё Фарадей в январе 1834 года, чтобы избежать неясности и добиться большей точности. Он предлагал и свой вариант запоминания на примере с Солнцем. Так, у него анод – это восход. Солнце движется вверх (ток входит). Катод – это заход. Солнце движется вниз (ток выходит).
Их ввёл ещё Фарадей в январе 1834 года, чтобы избежать неясности и добиться большей точности. Он предлагал и свой вариант запоминания на примере с Солнцем. Так, у него анод – это восход. Солнце движется вверх (ток входит). Катод – это заход. Солнце движется вниз (ток выходит).
Пример радиолампы и диода
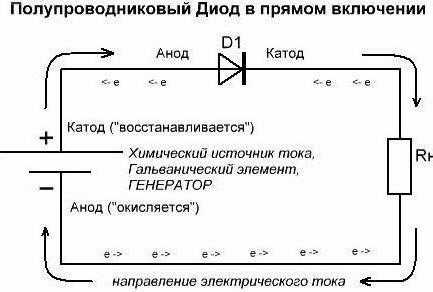
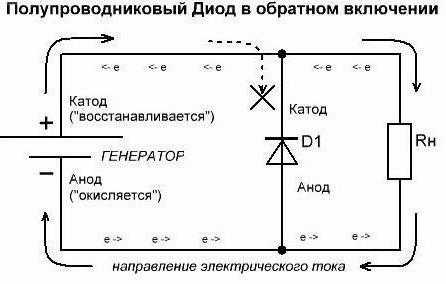 Продолжаем разбираться, что для обозначения чего используется. Допустим, один из данных потребителей энергии у нас имеется в открытом состоянии (в прямом включении). Так, из внешней цепи диода в элемент по аноду входит электрический ток. Но не путайтесь благодаря такому объяснению с направлением электронов. Через катод во внешнюю цепь из используемого элемента выходит электрический ток. Та ситуация, что сложилась сейчас, напоминает случаи, когда люди смотрят на перевёрнутую картину. Если данные обозначения сложные – помните, что разбираться в них таким образом обязательно исключительно химикам. А сейчас давайте сделаем обратное включение. Можно заметить, что полупроводниковые диоды практически не будут проводить ток. Единственное возможное здесь исключение – обратный пробой элементов. А электровакуумные диоды (кенотроны, радиолампы) вообще не будут проводить обратный ток. Поэтому и считается (условно), что он через них не идёт. Поэтому формально выводы анод и катод у диода не выполняют свои функции.
Продолжаем разбираться, что для обозначения чего используется. Допустим, один из данных потребителей энергии у нас имеется в открытом состоянии (в прямом включении). Так, из внешней цепи диода в элемент по аноду входит электрический ток. Но не путайтесь благодаря такому объяснению с направлением электронов. Через катод во внешнюю цепь из используемого элемента выходит электрический ток. Та ситуация, что сложилась сейчас, напоминает случаи, когда люди смотрят на перевёрнутую картину. Если данные обозначения сложные – помните, что разбираться в них таким образом обязательно исключительно химикам. А сейчас давайте сделаем обратное включение. Можно заметить, что полупроводниковые диоды практически не будут проводить ток. Единственное возможное здесь исключение – обратный пробой элементов. А электровакуумные диоды (кенотроны, радиолампы) вообще не будут проводить обратный ток. Поэтому и считается (условно), что он через них не идёт. Поэтому формально выводы анод и катод у диода не выполняют свои функции.
Почему существует путаница?
Специально, чтобы облегчить обучение и практическое применение, было решено, что диодные элементы названия выводов не будут менять зависимо от своей схемы включения, и они будут «прикреплены» к физическим выводам. Но это не относится к аккумуляторам. Так, у полупроводниковых диодов всё зависит от типа проводимости кристалла. В электронных лампах этот вопрос привязан к электроду, который эмитирует электроны в месте расположения нити накала. Конечно, тут есть определённые нюансы: так, через такие полупроводниковые приборы, как супрессор и стабилитрон, может немного протекать обратный ток, но здесь существует специфика, явно выходящая за рамки статьи.
Разбираемся с электрическим аккумулятором
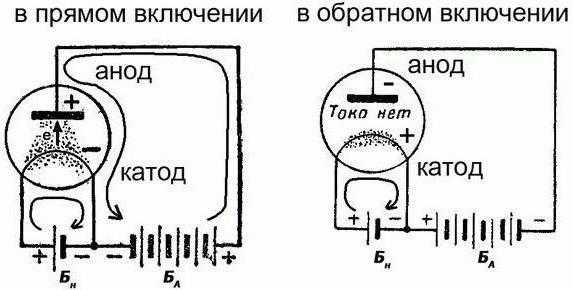 Это по-настоящему классический пример химического источника электрического тока, что является возобновляемым. Аккумулятор пребывает в одном из двух режимов: заряд/разряд. В обоих этих случаях будет разное направление электрического тока. Но обратите внимание, что полярность электродов при этом меняться не будет. И они могут выступать в разных ролях:
Это по-настоящему классический пример химического источника электрического тока, что является возобновляемым. Аккумулятор пребывает в одном из двух режимов: заряд/разряд. В обоих этих случаях будет разное направление электрического тока. Но обратите внимание, что полярность электродов при этом меняться не будет. И они могут выступать в разных ролях:
- Во время зарядки положительный электрод принимает электрический ток и является анодом, а отрицательный его отпускает и именуется катодом.
- При отсутствии движения о них разговор вести нет смысла.
- Во время разряда положительный электрод отпускает электрический ток и является катодом, а отрицательный принимает и именуется анодом.
Об электрохимии замолвим слово
Здесь используют немного другие определения. Так, анод рассматривается как электрод, где протекают окислительные процессы. И вспоминая школьный курс химии, можете ответить, что происходит в другой части? Электрод, на котором протекают восстановительные процессы, называется катодом. Но здесь нет привязки к электронным приборам. Давайте рассмотрим ценность окислительно-восстановительных реакций для нас:- Окисление. Происходит процесс отдачи частицей электрона. Нейтральная превращается в положительный ион, а отрицательная нейтрализуется.
- Восстановление. Происходит процесс получения частицей электрона. Положительная превращается в нейтральный ион, а потом в отрицательный при повторении.
- Оба процесса являются взаимосвязанными (так, количество электронов, что отданы, равняется присоединённому их числу).
Также Фарадеем для обозначения были введены названия для элементов, что принимают участие в химических реакциях:
- Катионы. Так называются положительно заряженные ионы, что двигаются в растворе электролита в сторону отрицательного полюса (катода).
- Анионы. Так называются отрицательно заряженные ионы, что двигаются в растворе электролита в сторону положительного полюса (анода).
Как происходят химические реакции?
 Окислительная и восстановительная полуреакции являются разделёнными в пространстве. Переход электронов между катодом и анодом осуществляется не непосредственно, а благодаря проводнику внешней цепи, на котором создаётся электрический ток. Здесь можно наблюдать взаимное превращение электрической и химической форм энергии. Поэтому для образования внешней цепи системы из проводников разного рода (коими являются электроды в электролите) и необходимо пользоваться металлом. Видите ли, напряжение между анодом и катодом существует, как и один нюанс. И если бы не было элемента, что мешает им напрямую произвести необходимый процесс, то ценность источников химического тока была бы весьма низка. А так, благодаря тому, что заряду необходимо пройтись по той схеме, была собрана и работает техника.
Окислительная и восстановительная полуреакции являются разделёнными в пространстве. Переход электронов между катодом и анодом осуществляется не непосредственно, а благодаря проводнику внешней цепи, на котором создаётся электрический ток. Здесь можно наблюдать взаимное превращение электрической и химической форм энергии. Поэтому для образования внешней цепи системы из проводников разного рода (коими являются электроды в электролите) и необходимо пользоваться металлом. Видите ли, напряжение между анодом и катодом существует, как и один нюанс. И если бы не было элемента, что мешает им напрямую произвести необходимый процесс, то ценность источников химического тока была бы весьма низка. А так, благодаря тому, что заряду необходимо пройтись по той схеме, была собрана и работает техника.
Что есть что: шаг 1
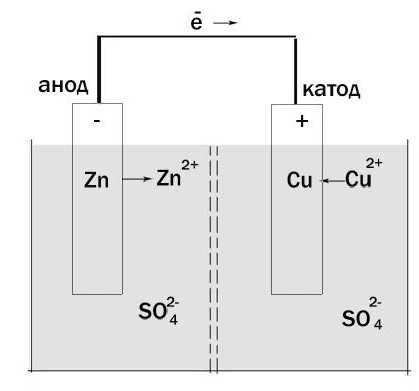 Теперь давайте будем определять, что есть что. Возьмём гальванический элемент Якоби-Даниэля. С одной стороны он состоит из цинкового электрода, который опущен в раствор сульфата цинка. Затем идёт пористая перегородка. И с другой стороны имеется медный электрод, который расположен в растворе сульфата меди. Они соприкасаются между собой, но химические особенности и перегородка не дают смешаться.
Теперь давайте будем определять, что есть что. Возьмём гальванический элемент Якоби-Даниэля. С одной стороны он состоит из цинкового электрода, который опущен в раствор сульфата цинка. Затем идёт пористая перегородка. И с другой стороны имеется медный электрод, который расположен в растворе сульфата меди. Они соприкасаются между собой, но химические особенности и перегородка не дают смешаться.
Шаг 2: Процесс
Происходит окисление цинка, и электроны по внешней цепи двигаются к меди. Так получается, что гальванический элемент имеет анод, заряженный отрицательно, и катод — положительный. Причем данный процесс может протекать только в тех случаях, когда электронам есть куда «идти». Дело в том, что попасть напрямую от электрода к другому мешает наличие «изоляции».
Шаг 3: Электролиз
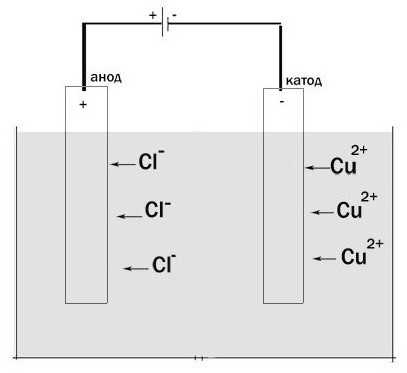 Давайте рассмотрим процесс электролиза. Установка для его прохождения является сосудом, в котором имеется раствор или расплав электролита. В него опущено два электрода. Они подключены к источнику постоянного тока. Анод в этом случае – это электрод, который подключен к положительному полюсу. Здесь происходит окисление. Отрицательно заряженный электрод – это катод. Здесь протекает реакция восстановления.
Давайте рассмотрим процесс электролиза. Установка для его прохождения является сосудом, в котором имеется раствор или расплав электролита. В него опущено два электрода. Они подключены к источнику постоянного тока. Анод в этом случае – это электрод, который подключен к положительному полюсу. Здесь происходит окисление. Отрицательно заряженный электрод – это катод. Здесь протекает реакция восстановления.
Шаг 4: Напоследок
Поэтому при оперировании данными понятиями всегда необходимо учитывать, что анод не в 100% случаев используется для обозначения отрицательного электрода. Также катод периодически может лишаться своего положительного заряда. Всё зависит от того, какой процесс на электроде протекает: восстановительный или окислительный.
Заключение
Вот таким всё и является – не очень сложно, но не скажешь, что и просто. Мы рассмотрели гальванический элемент, анод и катод с точки зрения схемы, и сейчас проблем с соединением источников питания с наработками у вас быть не должно. И напоследок нужно оставить ещё немного ценной для вас информации. Всегда приходится учитывать разницу, которую имеет потенциал катода/потенциал анода. Дело в том, что первый всегда будет немного большим. Это из-за того, что коэффициент полезного действия не работает с показателем в 100 % и часть зарядов рассеивается. Именно из-за этого можно увидеть, что аккумуляторы имеют ограничение на количество раз заряда и разряда.
Источник: fb.rumonateka.com
Анод — ОКСИ Про
Анод – это электрод прибора, который присоединяется к положительному полюсу необходимого источника питания. При этом электрический потенциал анода является положительным по отношению к потенциалу указанного катода. Во всех процессах электролиза анод – это электрически положительный полюс, на котором происходят окислительно-восстановительные реакции. Получается, что результатом этих операций может быть разрушение анода. Это используется, например, при электрорафинировании металлов.
Самые популярные аноды
В металлургии используется анод для гальваники для того, чтобы наносить на поверхность изделий слой металла электрохимическим способом или для электрорафинирования. При этом процессе металл с примесями полностью растворяется на аноде, а потом осаждается в чистом виде на катоде.
В основном распространены аноды из цинка, которые могут быть литыми, сферическими, катаными. Причем последние используются чаще всего. Кроме того, берут аноды из никеля, меди, олова, бронзы, кадмия, сплава сурьмы и свинца, серебра, платины и золота. А вот из кадмия аноды почти не используют, что обуславливается их экологической вредностью. Анод из драгоценных металлов используют для того, чтобы повысить коррозионную стойкость, улучшить эстетические свойства предметов, а также для других целей. Кроме того, они пригодятся и для того, чтобы повысить электропроводность изделий.
В вакуумных электронных приборах анод – это специальный электрод, который способен притягивать к себе любые летящие электроны, которые испущены катодом. В рентгеновских трубках и электронных лампах он имеет такую конструкцию, когда полностью поглощает все электроны. В электронно-лучевых трубках аноды являются элементами электронной пушки, которые поглощают только часть летящих электронов, формируя при этом электронный луч после себя. В полупроводниковых приборах электроды, которые подключаются к положительному источнику тока, когда прибор открыт, то есть он имеет небольшое сопротивление, называют анодом, а тот, что подключен к отрицательному полюсу, соответственно, – катодом.
Знак анода и катода
В специальной литературе часто можно встретить самое разное обозначение знака анода: «+» или «-». Это определяется особенностями рассматриваемых процессов. К примеру, в электрохимии считают, что катод – это электрод, на котором протекает процесс восстановления, а анод – это электрод, на котором протекает процесс окисления. При активной работе электролизера внешний источник тока обеспечивает на одном электроде избыток электронов и здесь происходит восстановление металла. Этот электрод является катодом. А на другом электроде, в свою очередь, обеспечивается недостаток электронов и происходит окисление металла, и его называют анодом.
При работе гальванического элемента, на одном из электродов избыток электронов обеспечивается уже не внешним источником тока, а именно реакцией окисления металла, то есть здесь отрицательным будет уже анод. Электроны, которые проходят через внешнюю цепь, будут расходоваться на протекание реакции восстановления, то есть катодом можно назвать положительный электрод.
Исходя из такого толкования, для аккумулятора аноды и катоды меняются местами в зависимости от того, как направлен ток внутри аккумулятора. В электротехнике анодом называют положительный электрод. Так электрический ток течет от анода к катоду, а электроны – наоборот.
oxi-pro.ru
А катод это плюс или минус
А это СМОТРЯ ГДЕ! В электрохимической ячейке при внешнем источни ке питания (элктролиз там, вольтамперометрия…) , в электронной лампе и у полупроводникового диода катод — минус А вот у источника тока (батарейки) на катоде — плюс!
ПО-моему плюс. хотяяя, плюс-катион :))
Анод — плюс, катод — минус.
катод — минус. Анод — плюс,
Анечка Куренкова права анод он же катион. а катод -аноид. он же минус
Катод-минус. Учительница учила: катод — 5 букв, минус — 5 букв, анод — 4 буквы, плюс — 4 буквы. Удачи!
Катод (донор) — минус, к нему движутся катионы (+), а анод (реципиент) — плюс, к нему движутся анионы (-).
ответы сказаны загадками прибаутками так где правильный ответ катод что анод что кто даст правильной ответ
Анод — отдает электроны. Отсюда и смотрим, если нам нужно подключать внешний источник питания, например к гальванованне для электролиза, то к аноду подключаем плюс от источника питания — все логично, с анода электроны будут убегать на плюс источника (где их недостаток). А вот если мы говорим о электродах самого источника питания, то по тому же принципу — анод должен отдавать электроны, а значит на самом источнике питания анод будет минусом.
touch.otvet.mail.ru
