Различия между двуокисью рутила и анатазом диоксида титана 2019
Рутил против анатаза Диоксид титана
В глубинах Земли обнаружено несколько минералов. Ученые и химики продолжают изучать обширные измерения нашего мира, чтобы найти что-то полезное и полезное для человечества. Одним из обнаруженных минералов является диоксид титана. Диоксид титана происходит естественным образом в почвах Земли. Он имеет беловатый и непрозрачный вид. Этот минерал считается старым, как сама Земля. Согласно статистическим данным, он также входит в число 50 крупнейших химических веществ, производимых во всем мире. Существуют две основные формы диоксида титана, рутил и анатаз.
Чтобы получить чистую беловатую форму диоксида титана, ей необходимо пройти ряд химических процессов. Диоксид титана — это без запаха и абсорбирующего минерала. Благодаря своим врожденным свойствам он имеет несколько применений. Краска и косметика сильно выигрывают от этого природного минерала. В области косметики диоксид титана служит в качестве белого пигмента, солнцезащитного крема и глушителя. Тем не менее, проблемы, связанные с использованием диоксида титана, выросли, поскольку это потенциальный фотокатализатор и канцероген, которые могут быть очень вредны для человеческого организма.
Двуокись рутила является наиболее распространенной формой. Он предпочтительно используется в приложениях с помехами из-за его высокого показателя преломления. Он также твердый и обладает химически стойкими свойствами. Естественный рутил состоит из десяти процентов железа и следов ниобия и тантала. «Рутил» происходит от латинского слова «рутилус», что означает «красный». При просмотре проходящим светом рутил имеет глубокий красный цвет. Rutile имеет много важных применений. В прибрежных песках, если имеется большое количество рутила, он служит важным компонентом месторождений тяжелых минеральных песков. Эти песок рудных месторождений, в конечном счете извлечены, чтобы получить рутила минерал для производства огнеупорного керамического материала, металлического титана и пигмента. Порошковая форма рутила служит белой пигментацией для красок, бумаги, пластмасс, пищевых продуктов и других предметов, которые нуждаются в белом цвете. Наноразмерные рутиловые частицы также используются для эффективного поглощения ультрафиолетовых лучей. С этой характеристикой рутил смешивается для производства солнцезащитных кремов и для предотвращения повреждения кожи. Драгоценные камни имеют большую ценность, если среди них есть рутил, потому что рутил может сделать оптическое явление, известное как астеризм.
Anatase — это тип полиморфа, который становится рутилем, когда он подвергается воздействию около 915 градусов по Цельсию. Его цвет от коричневого до черного или от желтого до синего. Анатаз — редчайшая форма диоксида титана, но имеет почти такие же свойства, как рутил в отношении его твердости, плотности и блеска. Тем не менее, вы можете отличить два минерала от их расщепления и кристальной привычки. Оба анатаза и рутила являются тетрагональными по структуре, но в анатазе имеются октаэдры, которые разделяют четыре ребра, образующие четырехкратную ось. Кварц обычно ассоциируется с полосками анатаза. Кварц плюс анатаз делают их популярной коллекцией для драгоценных камней и коллекционеров минералов, так как эти минералы демонстрируют замечательные люстры. Anatase также используется для белой пигментации красок, бумаги и керамики, но не рекомендуется использовать его на открытом воздухе из-за более низкой скорости поглощения, чем рутил.
Резюме:
Диоксид титана имеет две формы: рутил и анатаз.
Рутил глубокий красный, а анатаз — от желтого до синего.
Рутил обладает высокой поглощающей способностью, чем анатаз.
Рутил и анатаз используются в белой пигментации
ru.esdifferent.com
Диоксид титана (TiO2) Рутил, титановый диоксид анатазного порошка Производители и поставщики — Цена
Двуокись титана (TiO2) Рутил , титановый диоксид анатазного порошка
Наименование продукта: Двуокись титана (TiO2) Рутил и анатаз
Синонимы: титановый белый, пигмент белый 6; Диоксид титана R1931, диоксид титана A100
Номер CAS: 13463-67-7
Характеристики: Белый порошок.
Чистота (анализ): 98% Мин., 99% Мин.
Молекулярная формула: TiO2
Состав:
Пакет:
25 кг бумажно-пластиковый составной мешок, или по просьбе клиентов предлагают полиэтиленовый пакет размером 500 кг / 1000 кг.
КЛЮЧЕВЫЕ слова:
Двуокись титана Рутила, титана диоксид анатаза (TiO2)
Описание:
Двуокись титана, титановый диоксид анатаза (TiO2), также известный как оксид титана (IV) или оксид титана, представляет собой природный оксид титана, химическая формула TiO2. При использовании в качестве пигмента он называется титановым белым, пигментным белым 6 (PW6) или CI 77891. Как правило, он поступает из ильменита, рутила и анатаза. Двуокись титана Rutile, двуокись титана Anatase (TiO2) имеет широкий спектр применений: от краски до солнцезащитного крема до пищевой окраски. При использовании в качестве пищевой красителя он имеет E-номер E171. Мировое производство в 2014 году превысило 9 миллионов метрических тонн. По оценкам, двуокись титана, двуокись титана (TiO2), двуокись титана используется в двух третях всех пигментов.
Двуокись рутлия R1930 представляет собой универсальный пигмент с многоцелевым покрытием с плотным ZrO 2 и Al 2 O 3 и специальной органической обработкой поверхности. Качество продукции очень близко к международным передовым хлоридным технологическим продуктам TiO 2 .
Диоксид титана A100 представляет собой пигмент anatase tio2, полученный сульфатным способом с передовой технологией, обладающий превосходными пигментными свойствами, такими как высокая чистота, мелкие частицы. Анатазовый пигмент A100 с титановым титановым покрытием с превосходной диспергируемостью специально разработан для применений высшего сорта, качество которого эквивалентно Cosmo KA100.
Диоксид титана встречается в природе как известные минералы рутила, анатаза и рулокита, а также в виде двух форм высокого давления — моноклинной формы бадделеитообразной формы и орторомбической формы α-PbO2, которая была обнаружена недавно в кратере Риес в Баварии , Один из них известен как акаогит и должен рассматриваться как чрезвычайно редкий минерал. В основном добывается из ильменитовой руды. Это самая распространенная форма руды, содержащей диоксид титана, по всему миру. Двуокись титана Рутил (TiO2) является следующим наиболее распространенным и содержит около 98% диоксида титана в руде. Метастабильные фазы титанового диоксида анатаза (TiO2) и брукита необратимо преобразуются в равновесную рутильную фазу при нагревании выше температуры в диапазоне 600-800 ° C (1,112-1,472 ° F).
Двуокись титана, титановый диоксид титана (TiO2), также называемый титаном, белый, непрозрачный, природный минерал, существующий в ряде кристаллических форм, наиболее важными из которых являются рутил и анатаз. Эти природные оксидные формы можно добывать и служить в качестве источника для коммерческого титана. Двуокись титана Рутила, анатаз диоксида титана (TiO2) не имеет запаха и абсорбента. Его самая важная функция в виде порошка — это широко используемый пигмент для белизны и непрозрачности.
Двуокись титана Рутила, анатаз диоксида титана (TiO2) используется в качестве отбеливающего и непрозрачного агента в фарфоровых эмалях, придавая им яркость, твердость и кислотоустойчивость. В наше время он используется в косметике, например, в средствах по уходу за кожей и солнцезащитных лосьонах, утверждает, что двуокись титана Rutile, титановый диоксид анатаз (TiO2) защищает кожу от ультрафиолетового излучения из-за ее свойства для поглощения ультрафиолетового излучения.
Фотокаталитическая активность двуокиси титана Rutile, анатаза диоксида титана (TiO2) приводит к тонким покрытиям, проявляющим самоочищающиеся и дезинфицирующие свойства под воздействием ультрафиолетового излучения. Сплавы характеризуются легким и очень высоким пределом прочности при растяжении (даже при высоких температурах), высокой коррозионной стойкостью и способностью выдерживать экстремальные температуры и, следовательно, используются главным образом в самолетах, трубах для электростанций, бронировании, морских кораблях, космических аппаратах , и ракет.
Благодаря своим уникальным свойствам, двуокись титана, титанокислый анатаз (TiO2) широко используется и хорошо известна в области нанонауки и нанотехнологий. Это был один из 1-ых материалов, которые будут использоваться в нанотехнологических продуктах. Однако потенциальная токсичность наночастиц диоксида титана является спорным предметом. Многие косметические компании используют наночастицы диоксида титана. Из-за своей яркой белизны он используется в таких продуктах, как краски, покрытия, бумага, чернила, зубная паста, порошок для лица и пищевая окраска.
Несмотря на то, что двуокись титана Rutile, анатаз диоксида титана (TiO2) является одним из наиболее производимых химикатов, реальные и потенциальные преимущества диоксида титана не без противоречий. Двуокись титана (TiO2) Наночастицы могут проникать в организм человека путем ингаляции, контакта с кожей и контакта с глазами. Пылевая ингаляция может вызвать проблемы с дыханием, а контакт с кожей или глазами может вызвать раздражение. Если наночастицы диоксида титана используются в солнцезащитном креме, они могут проникать в клетки кожи и могут вызывать повреждение ДНК после воздействия солнечного света. Страх в том, что это может привести к раку кожи. Диоксид титана был классифицирован Международным агентством по исследованию рака как канцероген группы 2B, «возможным канцерогеном для человека».
Fengchen Group является ведущим поставщиком диоксида титана Rutile, титана диоксид анатаза (TiO2) порошок из Китая. Мы специализируемся на оптовых и массовых количествах, гарантируя, что у всех наших клиентов есть правильный поставщик порошка титана диоксида рутила, титана диоксид анатаза (TiO2), когда он в нем нуждается. Когда вы собираетесь покупать или покупать двуокись титана, титановый диоксид анатаза (TiO2), пожалуйста, обратитесь к Fengchen Group.
Приложения:
Двуокись титана, титановый диоксид анатаза (TiO2) широко используется в таких отраслях, как высококачественные внутренние и наружные покрытия, внутренние и внешние латексные краски, промышленные покрытия, порошковые покрытия, пластмассы (ПВХ, полиэтилен, полистирол и полиуретан и т. Д.), Маточная смесь, профиль ПВХ , резина, высококачественная печатная краска и изготовление бумаги и т. д.
Обычаи:
Двуокись титана, титановый диоксид анатаза (TiO2) является наиболее часто используемым белым пигментом и обеспечивает белизну и непрозрачность для красок и покрытий (включая глазури), пластмасс и бумаги.
Он имеет множество специальных применений. Двуокись титана, титановый диоксид анатаза (TiO2) устойчив к ультрафиолетовому излучению и, следовательно, не обесцвечивает в течение длительного периода времени, а ультратонкие и тонкодисперсные кристаллы диоксида титана все чаще используются для солнцезащитных экранов.
Двуокись титана Рутил, титана диоксид анатаз (TiO2) также используется в новых нанотехнологиях приложений.
В качестве полупроводника используются значительно меньшие количества двуокиси титана, рутан, двуокись титана (TiO2) и катализация фоторазложения воды в водород и кислород.
Двуокись титана, титановый диоксид анатаза (TiO2) также обладает высокой диэлектрической постоянной и высоким сопротивлением и, следовательно, используется для изготовления конденсаторов.
Прочное соединение между титаном и кислородом дает большую термостабильность, плав щуюс при 2100 К. Таким образом, он используетс в качестве керамического материала. Двуокись титана Рутила, анатаз двуокиси титана (TiO2) также используется для повышения кислотостойкости стекловидных эмалей.
Основная информация:
Химическое название: | Диоксид титана (TiO 2 ) |
Номер CAS: | 13463-67-7 |
EINECS NO .: | 236-675-5 |
Индекс цвета: | 77891, пигмент белый 6 |
Сертификат анализа
Технические характеристики: (стандарт: Q / SNBJ1-2012)
Имущество | Диоксид титана R1931 | Диоксид титана A100 |
Содержание диоксида титана Содержание TiO 2 % | ≥93.0 | ≥98.5 |
Содержание рутила% | ≥98.0 | —- |
Цвет (по сравнению со стандартным образцом) | Не ниже ≥-0,3 ≤0.5 | Не ниже ≥-0,3 ≤0.5 |
Материя летучая при 105ºC% | ≤0.5 | ≤0.5 |
Материя, растворимая в воде% | ≤0.5 | ≤0.4 |
Остаток на сите 45 мкм% | ≤0.05 | ≤0.05 |
PH водной суспензии | 6,5-8,0 | 6,5-8,0 |
Яркость% | ≥98.0 | ≥96.0 |
Масляная абсорбция г / 100 г | ≤18.0 | ≤24 |
Тонировочная прочность | ≥120 | ≥110 |
Высококачественный, чистый рутиловый диоксид титана, титановый диоксид анатаза (TiO2), порошок / вещество фабрики в Китае; Китай Титан диоксид рутила, титана диоксид анатаза (TiO2) порошок сырья поставщиков в Китае. Китай Титан диоксид рутила, титана диоксид анатаза (TiO2) производителей порошка в Китае.
Сопутствующие товары:
Если вы ищете диоксид титана (tio2) рутил, порошок анатаза двуокиси титана, свяжитесь с нами. Мы являемся одним из ведущих и профессиональных китайских производителей и поставщиков в этой области. Конкурентоспособная цена и хорошее послепродажное обслуживание доступны.www.fengchengroup.net
Диоксид титана (TiO2) – наиболее важный белый пигмент, используемый в лакокрасочной промышленности. Он широко используется в составе красок, благодаря эффективному рассеиванию видимого света, придающего белизну, яркость, укрывистость. Диоксид титана существует в двух кристаллических структурах: анатазной и рутильной. Рутильный диоксид примерно на 30% лучше рассеивает свет (укрывистость), чем анатазный, поэтому последний используется гораздо реже. К тому же, анатаз менее атмосферостоек, чем рутил. Анатаз гораздо хуже работает в защите полимера (акрилата, пластмассы) от УФ лучей и приводит к фотокатализу и потере своиств полимера (происходит деструкция, выцветание, меление и т.д.). Таким образом, именно РУТИЛЬНАЯ форма диоксида титана является единственным и безальтернативным белым пигментом в стандартных областях промышленности (краски, пластмассы, бумага) для придания белизны, укрывистости и стабильности системе пигмент+носитель. Сравнение рутильной и анатазной форм:
Основные характеристики (На что влияют?) Способ производства (Хлорное или Сульфотное?) На главную protitan.narod.ru Задать вопрос. |
protitan.narod.ru
Анатазная двуокись — титан — Большая Энциклопедия Нефти и Газа, статья, страница 1
Анатазная двуокись — титан
Cтраница 1
Анатазная двуокись титана применяется главным образом для покрытий, эксплуатируемых внутри помещения. Анатаз марок А-1 и АВ используется без поверхностной его обработки, марки А-01-обрабатывается соединениями алюминия и кремния. Пигментная двуокись титана марки Р-1 применяется без обработки поверхности, главным образом для покрытий неответственного назначения; рутил марки Р-01 обрабатывается соединениями алюминия и кремния; рутил марки Р-02 — соединениями алюминия, кремния и цинка. Лучшими свойствами по атмосферостойкости и декоративности обладает пигмент Р-02. Он и находит широкое применение в лакокрасочной промышленности. [1]
В наибольшей степени меление свойственно анатазной двуокиси титана, и поэтому она была использована в качестве объекта исследования в большинстве работ по изучению меления. Однако несмотря на большое число проведенных исследований, причины, вызывающие ускоренное старение пленки в присутствии некоторых пигментов, до сих пор с достоверностью не установлены, поэтому и не имеется эффективных методов борьбы с этим явлением. [2]
В наибольшей степени меление свойственно анатазной двуокиси титана, и поэтому она была использована в качестве объекта исследования в большинстве работ по изучению меления. [3]
Двуокись титана пигментная Т-1 и Т-2 — порошок белого цвета, анатазная двуокись титана. [4]
Учитывая все перечисленные выше требования, можно сделать вывод, что анатазная двуокись титана, а также необработанный рутил [48] вследствие невысокой кроющей способности и плохой диспергируемое непригодны для лакокрасочных материалов, наносимых электроосаждением. [5]
Поглощение фиолетового света придает пигменту желтоватый оттенок, который можно заметить, если сравнить краски, приготовленные на основе рутильной и анатазной двуокиси титана. [6]
Для чисто белых покрытий в качестве пигмента больше всего подходит двуокись титана рутильной модификации ( марка РО-2), подцвеченная ультрамарином или пигментом синим антрахиноно-вым ( 0 01 — 0 05 вес. Анатазная двуокись титана, цинковые белила, литопон менее пригодны: первая по причине повышенного меления покрытий, остальные — из-за малой кроющей способности. Однако и применение рутильной двуокиси титана неблагоприятно сказывается на атмосферостойкости покрытий. [7]
Для чисто белых покрытий в качестве пигмента больше всего подходит двуокись титана рутильной модификации ( марка РО-2), подсвеченная ультрамарином или пигментом синим антрахиноно-вым ( 0 01 — 0 05 вес.
В зависимости от назначения выпускают различные марки пигментной двуокиси титана с поверхностной обработкой ( модификацией) или без нее. Например, анатазную двуокись титана марки А-1 без поверхностной обработки применяют для покрытий внутри помещений, а марки А-01, обработанную соединениями А1 и Si — для кожи. Рутильная двуокись титана марки Р-1 без поверхностной обработки предназначена для неответственных наружных покрытий, марки Р-01, обработанная соединениями А1 и Si — для покрытий средней атмосферостойкости, марки Р-02, обработанная соединениями Al, Si и Zn — для наружных покрытий с высокой атмосферостойкостью. [9]
Благодаря основным свойствам пигмент реагирует со свободными жирными кислотами растительных масел с образованием свинцовых мыл. Лакокрасочные пленки, содержащие свинцовые пигменты, лучше сохраняют прочность на изгиб при старении по сравнению с пленками, пигментированными цинковыми белилами. Свинцовые белила ( при слое пигмента 0 00092 мм) пропускают 55 — 65 % ультрафиолетовых лучей в интервале спектра от синего до ультрафиолетового ( при длинах волн 300 — 436 нм) и уступают в этом отношении анатазной двуокиси титана и цинковым белилам. При нагревании до 80 С свинцовые белила желтеют и сохраняют окраску после охлаждения, при 240 С выделяют воду и превращаются в оксикарбонат свинца, при дальнейшем повышении температуры происходит выделение двуокиси углерода и образование продуктов с различным содержанием СО2 и РЬО. При 400 — 470 С двуокись углерода выделяется полностью. Свинцовые белила нельзя смешивать с пигментами, содержащими сульфиды металлов ( цинк, кадмий и др.), и применять для изготовления белых строительных красок, эксплуатируемых в промышленных районах, в воздухе которых содержится сероводород и другие серусодержа-щие газы, так как сероводород вступает в реакцию с свинцовыми белилами, образуя сульфид свинца черного цвета. [10]
Благодаря основным свойствам пигмент реагирует со свободными жирными кислотами растительных масел с образованием свинцовых мыл. Лакокрасочные пленки, содержащие свинцовые пигменты, лучше сохраняют прочность на изгиб при старении по сравнению с пленками, пигментированными цинковыми белилами. Свинцовые бе — лила ( при слое пигмента 0 00092 мм) пропускают 55 — 65 % ультрафиолетовых лучей в интервале спектра от синего до ультрафиолетового ( при длинах волн 300 — 436 нм) и уступают в этом отношении анатазной двуокиси титана и цинковым белилам. При нагревании до 80 С свинцовые белила желтеют и сохраняют окраску после охлаждения, при 240 С выделяют воду и превращаются в оксикарбонат свинца, при дальнейшем повышении температуры происходит выделение двуокиси углерода и образование продуктов с различным содержанием СО2 и РЬО. При 400 — 470 С двуокись углерода выделяется полностью. Свинцовые белила нельзя смешивать с пигментами, содержащими сульфиды металлов ( цинк, кадмий и др.), и применять для изготовления белых строительных красок, эксплуатируемых в промышленных районах, в воздухе которых содержится сероводород и другие серусодержа-щие газы, так как сероводород вступает в реакцию с свинцовыми белилами, образуя сульфид свинца черного цвета. [11]
В соответствии с различными взглядами на причины меления различны и методы, предлагаемые для борьбы с ним. Исследователи, считающие, что причина меления заключается в фотосенсибн-лизирующем действии пигмента ( двуокиси титана), предлагают вводить в пигмент различные соли, ослабляющие его фотосенсиби-лизирующее действие. Так, например, рядом экспериментов он доказал, что полимеризован-ное льняное масло лучше смачивает частицы двуокиси титана, чем сырое льняное масло и олифа. Поэтому для получения красочных пленок, содержащих анатазную двуокись титана, он рекомендует применять в качестве пленкообразователя сильно полимеризованные масла. Такие пленки мелят значительно слабее. К ослаблению меления, по данным Гуревича, приводит и такая обработка красочной пасты, которая улучшает смачивание пигмента пленкообразователем. [12]
В соответствии с различными взглядами на причины меления различны и методы, предлагаемые для борьбы с ним. Исследователи, считающие, что причина меления заключается в фотосенсиби-лизирующем действии пигмента ( двуокиси титана), предлагают вводить в пигмент различные соли, ослабляющие его фотосенсиби-лизирующее действие. Так, например, рядом экспериментов он доказал, что полимеризован-ное льняное масло лучше смачивает частицы двуокиси титана, чем сырое льняное масло и олифа. Поэтому для получения красочных пленок, содержащих анатазную двуокись титана, он рекомендует применять в качестве пленкообразователя сильно полимеризованные масла. Такие пленки мелят значительно слабее. К ослаблению меления, по данным Гуревича, приводит и такая обработка красочной пасты, которая улучшает смачивание пигмента пленкообразователем. [13]
Страницы: 1
www.ngpedia.ru
Способ получения кристаллического диоксида титана в структурной модификации анатаз
Изобретение может быть использовано в химической промышленности. Для получения кристаллического диоксида титана в структурной модификации анатаз готовят исходный раствор тетрахлорида титана и проводят гидролиз раствором гидроксида аммония. Образующийся осадок сушат и прокаливают. Исходный раствор готовят растворением тетрахлорида титана в этиловом спирте до получения концентрации ионов титана не менее 30% в пересчете на TiO2. Гидролиз проводят в термостатируемом реакторе при pH 7-10, температуре 20-25°C и механическом перемешивании со скоростью вращения мешалки 1000 об/мин. При этом исходный раствор и раствор гидроксида аммония подают в эквимолярных концентрациях двумя струями. Прокаливание полученного осадка проводят при 700-800°C в течение 1-5 мин. В качестве стабилизатора анатазной структуры диоксида титана используют хлорид аммония, получающийся в результате побочной реакции гидролиза. Изобретение позволяет получить диоксид титана в модификации анатаз с повышенной кристалличностью, обладающий повышенной термической стабильностью, высокой удельной площадью поверхности, с размером частиц 10-50 нм, сократить продолжительность процесса изготовления и издержки на утилизацию промывных вод. 4 з.п. ф-лы, 3 ил., 1 табл., 1 пр.
Изобретение относится к способам получения диоксида титана, используемого для получения функциональных фотокаталитических материалов широкого спектра применения, в частности, для химической промышленности — получение молекулярного водорода, для экологии -очистка воздуха и воды от вредных органических соединений, для строительной индустрии — производство самоочищающихся материалов.
Изобретение позволяет получить диоксид титана в модификации анатаз, который обеспечивает широкое использование диоксида титана как эффективного фотокатализатора.
Известен способ получения фотокатализатора на основе нанокристаллического диоксида титана (RU №2408428 С1, МПК B01J 37/08, C01G 23/053, опубл. 20.07.2009), заключающийся в приготовлении водного раствора сульфата титанила с добавлением кислоты, с последующим гидролизом полученного раствора в гидротермальных условиях при 100-250°C в течение 0,5-24 часов с последующим выделением осадка центрифугированием, многократным промыванием дистиллированной водой и сушкой при 60-70°C. Этим способом получают мезопористый диоксид титана с размером областей когерентного рассеяния (ОКР) 10-60 нм с высокой кристалличностью (до 100%) при использовании длительного времени гидротермальной обработки до 48 часов в присутствии кислот, что экономически неэффективно. Кроме того, удельная поверхность полученного фотокатализатора не сообщается, как и не приводится испытание его фотокаталитических свойств.
Известен также способ синтеза фотокаталитического нанокристаллического диоксида титана с кристаллической структурой анатаза (SI 22583, МПК C01G 23/001, опубл. 28.02.2009), заключающийся в использовании в качестве титансодержащего реагента сульфата титанила, осаждаемого раствором гидроксида аммония при Т=20-35°C в течение 30-300 мин, и прокаливании при 450-700°C, время прокаливания при максимальной температуре от 30 до 180 минут, с деагломерацией в течение 30-180 мин в щелочной среде при pH=7-13 в присутствии ПАВ в течение 4-10 часов для получения стабильных дисперсий, пригодных для диспергирования в различных средах. Получаемые частицы имеют размер от 5 нм до 50 нм.
Недостатком данных изобретений является то, что высокотемпературная стабильность анатаза обеспечивается присутствием сульфат ионов, стабилизирующих низкотемпературную кристаллическую модификацию диоксида титана (анатаз). Однако известно, что фотокаталитическая активность диоксида титана, полученного из раствора сульфата титанила, на 30-40% ниже активности промышленного фотокатализатора Р25 [Иванов В.К., Максимов В.Д., Шапорев А.С. и др. / Гидротермальный синтез эффективных фотокатализаторов на основе TiO2 // Журнал неорганической химии — 2010. — Т. 55. — №2], поэтому полученный диоксид титана в модификации анатаз из растворов сульфата титанила является недостаточно эффективным.
Наиболее близким к заявляемому способу является способ получения катализатора на основе диоксида титана для фотокаталитической очистки воды и воздуха от органических соединений, патогенных флор (RU 2317947 С1, МПК C01G 23/053, B01J 21/06, B01J 37/26, опубл. 27.02.2008), позволяющий осуществить получение диоксида титана в структурной модификации анатаз с удельной поверхностью 70-170 м2/г и термостабильностью до 700°C за счет увеличения содержания фтора в структуре диоксида титана (0,4-4,8 мас. %). Способ включает приготовление реакционного раствора, содержащего минеральную соль титана, включая тетрахлорид титана, фторид-ион в концентрации не менее 5 мас. % и активизирующую добавку — гидроксид аммония в 5-10% избытке.
Использование реакционного раствора с концентрацией фторид-иона 5-10 мас. % обеспечивает формирование диоксида титана в анатазной структуре с высокой удельной поверхностью. Реакцию гидролиза с образованием осадка ведут при pH=10-13. Образующийся осадок промывают и прокаливают. Избыток аммиака используется для обеспечения достаточного количества фторид-ионов в осадке и для обеспечения pH реакционного раствора, способствующего сокращению времени гидролиза при увеличении его полноты.
К недостаткам данного способа относится то, что высокая удельная поверхность 170 м2/г может быть получена только при Т=300°C, повышение температуры прокаливания до 700°C приводит к снижению удельной поверхности диоксида титана в структурной модификации анатаз до 50-70 м2/г, при этом содержание фтора в порошке составляет 0,3-0,4 мас. %. Снижение концентрации фторид-ионов в осадке приводит к сильному снижению удельной поверхности фотокатализатора и появлению рутила. Кроме того, способ содержит операцию промывки осадка, ведущую к увеличению количества сточных вод, а присутствие ионов фтора способствует формированию кислой реакции поверхности фотокатализатора, что сужает возможность его применения.
Задачей настоящего изобретения является получение кристаллического диоксида титана в структурной форме анатаз с повышенным содержанием кристаллических частиц, обладающего повышенной термической стабильностью при сохранении высокой удельной поверхности порошка фотокатализатора и упрощении способа синтеза.
Поставленная задача решается тем, что в способе получения диоксида титана в структурной модификации анатаз, включающем приготовление исходного раствора, содержащего тетрахлорид титана, его гидролиз раствором гидроксида аммония при заданном значении pH, образование осадка, его сушку и прокаливание, согласно изобретению, исходный раствор готовят растворением тетрахлорида титана в этиловом спирте до получения концентрации ионов титана не менее 30 мас. % в пересчете на TiO2, гидролиз проводят в реакторе при pH=7-10, температуре 20-25°C и механическом перемешивании со скоростью вращения мешалки 1000 об/мин, подавая исходный раствор и раствор гидроксида аммония в эквимолярных концентрациях двумя струями, прокаливание полученного осадка проводят при 700-800°C в течение 1-5 мин.
Технический результат достигается также тем, что в процессе гидролиза тетрахлорида титана получают побочный продукт хлорид аммония в количестве не менее 4 моль/моль TiO2, служащий стабилизатором анатазной структуры диоксида титана с размером частиц 10-50 нм.
На достижение технического результата направлено то, что подвергаемый гидролизу исходный раствор разбавляют равным количеством этилового спирта или воды.
Кроме того, исходный раствор и раствор гидроксида аммония подают в реактор с одинаковой скоростью.
Осадок сушат при температуре не менее 70°C выпариванием маточного раствора.
Фотоактивные материалы на основе диоксида титана характеризуются высокой эффективностью фотостимулированных реакций под воздействием солнечного и ультрафиолетового света, высокой химической стабильностью, экологической безопасностью и сравнительно невысокой стоимостью. Однако высокий квантовый выход процессов генерации свободных носителей заряда в частицах диоксида титана не является залогом высокой фотокаталитической активности материала на их основе из-за потери фотогенерированных носителей зарядов за счет высокой скорости процессов рекомбинации. Снижение скорости процессов рекомбинации в частицах полупроводниковых материалов, к которым относится и диоксид титана, достигается путем снижения количества и упорядочивания структурных дефектов в частицах. В связи с этим, существенным фактором, оказывающим влияние на фотокаталитическую активность полупроводниковых материалов, является степень их кристалличности.
Диоксид титана может быть синтезирован в аморфном состоянии или в трех основных кристаллических модификациях — рутил, анатаз, брукит. Известно, что кристаллические модификации диоксида титана имеют значительно меньше дефектов в сравнении с его аморфной модификацией, что способствует эффективному перемещению фотогенерированных зарядов в массе полупроводника и снижает вероятность процессов рекомбинации, причем большую фотокаталитическую активность проявляет TiO2 в структурной форме анатаз [Артемьев Ю.М., Рябчук В.К. Введение в гетерогенный фотокатализ: Учеб. пособие. — СПб.: Изд-во С.-Петерб. Ун-та, 1999. — 304 с.; Yanagisawa К., Ovenstone J. Crystallization of Anatase from Amorphous Titania Using the Hydrotermal Technique: Effects of Starting Material and Temperature // J. Phys. Chem. В. — 1999. — V. 103. — P. 7781-7787]. Вследствие того, что стимулированные светом окислительно-восстановительные реакции происходят на поверхности диоксида титана, одним из основных требований, предъявляемых к фотокатализаторам, является наличие высокой удельной поверхности, которая достигается двумя путями: синтезом непористых ультрадисперсных частиц TiO2 размером менее 100 нм, или созданием мезопористых структур TiO2 с развитой поверхностью пор.
Методы синтеза ультрадисперсных частиц диоксида титана из растворов, относящиеся к методам «мягкой химии», многостадийны и из-за этого чаще используются как лабораторные. В качестве исходных реагентов в этих методах синтеза могут быть использованы любые титансодержащие соединения. Часто для придания фотокатализатору оптимальных характеристик используются дополнительные стадии обработки прекурсоров, такие как микроволновая или ультразвуковая обработка. Непременными стадиями процесса являются промывание, фильтрация, сушка, финальная термообработка и помол порошка. Уменьшение числа стадий процесса получения фотоактивного диоксида титана в высокодисперсном состоянии позволит упростить процесс, уменьшить его стоимость и расширить области применения материалов на его основе.
Поэтому задача создания высокоэффективных, не подверженных фотокоррозии и отравлению фотокатализаторов, пригодных для экономически выгодного проведения практически важных химических процессов может быть решена путем разработки новых методов синтеза фотоактивных порошков анатаза с высокой степенью кристалличности и удельной поверхностью более 50 м2/г. Разрабатываемые методы синтеза должны обеспечивать получение фотокаталитических материалов технологичными способами, не требующими специальных условий и сложного оборудования, и предпочтительно относиться к методам «мягкой химии».
Сущность изобретения заключается в том, что для получения заявляемых характеристик диоксида титана в результате гидролиза требуется получить осадок гидроксида титана с наноразмерными частицами, обеспечить сохранность дисперсности частиц в условиях сушки осадка, а также при удалении стабилизатора в процессе прокаливания осадка.
При обычных условиях термодинамически стабильной кристаллической модификацией диоксида титана является рутил, а анатаз метастабилен и переходит в рутил при 400-600°C, однако, известно, что анатаз обладает большей термодинамической стабильностью по сравнению с рутилом, когда размер частиц диоксида титана не превышает 35 нм. Таким образом, используя подходящий стабилизатор размера частиц, можно получить чистый диоксид титана в кристаллической модификации анатаз, стабильный в условиях высокотемпературной обработки, необходимой для полного перехода аморфного диоксида титана в кристаллический анатаз. Такой стабилизатор должен обеспечивать высокую дисперсность частиц диоксида титана в растворе и твердой фазе и легко удаляться из осадка.
С этих позиций использование тетрахлорида титана для синтеза фотокаталитического диоксида титана очень привлекательно из-за того, что побочным продуктом реакции образования гидроксида титана Ti(OH)4 из растворов TiCl4 и гидроксида аммония NH4OH является хлорид аммония NH4Cl, который можно удалить из осадка возгонкой или термолизом при температурах ниже 400°C. Такая температура прокаливания позволяет сохранить кристаллическую модификацию анатаз, рутилизирующуюся при температурах выше 400°C.
С другой стороны хлорид аммония известен как стабилизатор коллоидных частиц гидроксида титана в растворе, его присутствие во время синтеза обеспечивает образование высокодисперсных и при этом однородных по размеру золей Ti(OH)4.
Однако получение диоксида титана непосредственно из раствора тетрахлорида титана методами растворной химии не используется, т.к. хлорид титана — дымящая на воздухе жидкость, гидролизующаяся в присутствии паров воды. Реакция хлорида титана с водой, приводящая к образованию гидратированной окиси титана — гидроксида титана, как и реакции нейтрализации хлорида титана растворами щелочей или аммиака, протекает бурно с высоким экзотермическим эффектом. Поэтому получение высокодисперсного, фотокаталитически активного TiO2 в модификации анатаз гидролизом или реакцией нейтрализации раствора TiCl4 проводят из полученных в специальных условиях концентрированных водных растворов TiCl4. Их получают при медленном добавлении воды с охлаждением и интенсивным перемешиванием, для стабилизации полученных растворов применяют добавку сильных кислот. Однако использование в качестве источника ионов титана водного раствора хлорида титана не желательно из-за того, что водные растворы тетрахлорида титана нестабильны и самопроизвольно гидролизуются в течение времени, их состав постоянно изменяется: изменяется концентрация гидролизованных ионов, степень гидролиза и степень полимеризации полиядерных гидрокомплексов вплоть до появления в растворах коллоидных частиц. Использование нестабильного исходного реагента приводит к нестабильности свойств готовой товарной продукции по физическим характеристикам — дисперсность, и зависящим от них функциональным свойствам — фотокаталитическая активность.
Указанный недостаток решается в заявляемом изобретении использованием раствора хлорида титана в этиловом спирте, который в отсутствии воды представляет собой стабильный прозрачный раствор. Полученный раствор хлорида титана в этиловом спирте имеет кислую реакцию и желтую окраску. Раствор сохраняет стабильность при разбавлении этиловым спиртом или равным количеством воды, гидролиз разбавленного водой раствора начинается при нагревании выше 50°C. Концентрированный раствор, при концентрации 30% и более стабилен в хранении, однако имеет высокую вязкость, поэтому, для улучшения реологических характеристик раствора при подаче в реактор для синтеза диоксида титана его необходимо разбавить этиловым спиртом или водой в соотношении 1:1. Использование других спиртов не целесообразно из-за токсичности или плохой стабильности их растворов.
Стабилизирующая способность кристаллического хлорида аммония для получения порошков наночастиц до настоящего изобретения не была известна. В нашем изобретении необходимая для формирования высокой удельной поверхности TiO2 концентрация NH4C1 не менее 4 моль/моль TiO2 создается в ходе смешения растворов реагентов и далее обеспечивает разделение частиц золя в процессе синтеза, высыхания и прокаливания геля гидратированной окиси титана. Данная концентрация хлорида аммония является достаточной для стабилизации частиц анатаза, использование более высокой концентрации хлорида приведет лишь к усложнению и удорожанию процесса.
Кроме получения необходимых характеристик диоксида титана, предлагаемое решение сокращает количество операций, необходимых для получения готового продукта, т.к. промывание осадка перед финальной термообработкой прокаливанием становится ненужным.
Вследствие того, что фотоактивная кристаллическая модификация диоксида титана — анатаз, как правило, стабильна в интервале температур 400-600°C, большое значение имеет величина температуры прокаливания. За температуру рутилизации диоксида титана принято считать T=600°C, однако из справочной литературы известно, что полное обезвоживание гидроксида титана происходит при температуре выше 800°C, поэтому трудно получить полностью кристаллический анатаз без примеси рутильной или аморфной фаз.
Одним из известных способов повышения температуры рутилизации с целью получения высококристаллических порошков анатаза, необходимых для его фотокаталитического применения, является метод стабилизации границ частиц гидроксида титана за счет адсорбции ионов сильных кислот, присутствующих в среде во время синтеза, однако анионы, выполняющие роль стабилизатора, сохраняются в составе полученного с их помощью диоксида титана, придавая его поверхности кислую реакцию, что сужает область применения полученных с использованием анионов порошков. Особенно прочно удерживаются на поверхности диоксида титана ионы фтора, их удаление без уменьшения дисперсности порошка практически невозможно.
В настоящем изобретении в процессе получения диоксида титана присутствуют анионы хлора, содержащиеся в исходном растворе тетрахлорида титана в этиловом спирте, которые не относятся к эффективным анионам-стабилизаторам анатаза, т.к его соединения имеют низкую температуру термического разложения и испарения.
В настоящем изобретении задача получения кристаллического диоксида титана в структурной модификации анатаз с высокой кристалличностью, повышенной термической стабильностью при сохранении высокой удельной поверхности фотокатализатора решается путем стабилизации границ частиц гидроксида титана одновременным присутствием в осадке гидроксида титана ионов хлора в сочетании с катионом аммония. Этот прием оказался эффективным из-за выявленной стабилизирующей роли хлорида аммония. Кроме того, было установлено, что стабилизирующее действие хлорида аммония можно варьировать путем задания и поддержания в ходе синтеза гидроксида титана необходимого значения pHсинтеза от 7 до 10, что привело к повышению температуры рутилизации диоксида титана с обычных 600°C до 700-800°C.
Экспериментально было установлено, что от величины pH синтеза зависит строение геля гидроксида титана. Условия формирования частиц гидроксида титана в избытке гидроксида аммония при pH=10 способствуют возникновению большого количества зародышей твердой фазы, быстро агрегирующих в преимущественно крупные частицы аморфного осадка. Внутри таких частиц поверхность зародышей оказывается не стабилизированной, что приводит к активации процессов полимеризации и конденсации первичных частиц в процессе сушки и прокаливания. Полученный таким образом гель остается аморфным даже при температуре 800°C, т.к. структурная перестройка требует разрыва большого количества связей. При pHсинтеза=7 формирование частиц гидроксида титана происходит в условиях, способствующих возникновению отдельных наноразмерных частиц гидроксида титана, а аморфный осадок является результатом постепенно идущих процессов коалесценции мелких частиц, поверхность которых уже защищена адсорбированными ионами и молекулами стабилизатора. Полученный таким образом гель состоит из наноразмерных, однородных по составу и размеру частиц, которые в процессе термообработки геля при достижении температуры фазового перехода переходят в кристаллическое состояние. Из-за малых размеров частиц (ОКР ~20-25 нм) наблюдается образование метастабильной фазы анатаз. Снижение pH синтеза меньше 7 приводит к неполному осаждению ионов титана из раствора и появлению кислой реакции поверхности у порошка фотокатализатора, что ухудшает свойства диоксида титана и технологически нецелесообразно, увеличение pH больше 10 ухудшает кристалличность частиц диоксида титана.
Использование температуры прокаливания ниже 700°C ухудшает кристалличность анатаза за счет присутствия аморфного диоксида титана, увеличение температуры прокаливания выше 800°C приводит к увеличению содержания рутила, все это отрицательно влияет на фотокаталитическую эффективность порошка диоксида титана.
Дополнительным приемом стабилизации анатазной модификации диоксида титана, предлагаемым в настоящем изобретении, является сокращение времени выдерживания гидроокиси титана при температуре прокаливания 700-800°C до 1-5 мин. Короткое время высокотемпературной обработки способствует формированию микрогетерофазных областей в частицах фотокатализатора и увеличению фотокаталитической активности. В целом, значения температуры и длительности прокаливания выбираются с учетом условий, в которых был проведен синтез прекурсора, и исходя из того, какие характеристики диоксида титана: степень кристалличности, фазовый состав, удельная поверхность, пористость, необходимо получить. Уменьшение времени прокаливания меньше 1 мин невозможно из-за программного обеспечения печи. Увеличение более 5 мин нецелесообразно, т.к. приводит к уменьшению удельной поверхности порошка фотокатализатора и увеличению содержания рутила.
Совокупность вышеуказанных признаков необходима и достаточна для достижения технического результата изобретения, заключающегося в получении кристаллического диоксида титана в структурной форме анатаз с повышенным содержанием кристаллических частиц, обладающего повышенной термической стабильностью при сохранении высокой удельной поверхности порошка фотокатализатора и упрощении способа синтеза.
Использование в ходе синтеза двухструйной подачи растворов реагентов эквимолярных концентраций при одинаковой скорости их подачи обеспечивает низкие значения пересыщения ионов в растворе, что способствует формированию однородных малоразмерных частиц гидроксида титана, необходимых для получения анатаза.
Проведение гидролиза при температуре 20-25°C обеспечивает получение необходимого размера частиц гидроксида титана. Проведение гидролиза при температуре менее 20°C требует использования дополнительного охлаждения реактора, что усложняет процесс, увеличение температуры более 25°C сопровождается укрупнением осаждаемых частиц, что приводит к ухудшению термической стабильности анатаза.
Проведение гидролиза при механическом перемешивании со скоростью вращения мешалки 1000 об/мин обеспечивает получение необходимого размера частиц гидроксида титана. Проведение гидролиза при перемешивании со скоростью вращения мешалки менее 1000 об/мин сопровождается увеличением пересыщения ионов в растворе, что сопровождается укрупнением осаждаемых частиц и увеличением полидисперсности системы, что приводит к ухудшению термической стабильности диоксида титана. Увеличение скорости вращения мешалки более 1000 об/мин нарушает условия гидродинамического вращения жидкости в реакторе, обеспечение которых потребует усложнения конструкции реактора.
Проведение сушки осадка выпариванием маточного раствора при температуре не менее 70°C обеспечивает необходимую длительность процесса получения диоксида титана. Использование температуры менее 70°C неоправданно увеличит время получения готового порошка.
Вышеуказанные частные признаки изобретения позволяют осуществить способ в оптимальном режиме с точки зрения получения кристаллического диоксида титана в структурной форме анатаз с повышенным содержанием кристаллических частиц, обладающего повышенной термической стабильностью при сохранении высокой удельной поверхности порошка фотокатализатора и упрощении способа синтеза.
На фиг. 1. приведено изображение с атомно-силового микроскопа (АСМ) частиц фотокаталитического диоксида титана размером 10-50 нм, полученных предлагаемым способом в оптимальных условиях.
Для иллюстрации отсутствия рутильной и аморфной фаз в образце на фиг. 2. приведены рентгенограммы фотокаталитического диоксида титана, полученного предлагаемым способом в оптимальных условиях, в сравнении с рентгенограммой промышленно выпускаемого фотокатализатора Р25, получаемого пиролизом аэрозолей соединений титанила. Фотокатализатор Р25 использовался как эталонный образец с известными характеристиками, близкими патентуемому продукту. Кристаллографические и дисперсионные характеристики фотокатализатора Р25 — аэрооксида производства «Evonik Industries)) (Германия, США, Япония) известны: состав: 70% анатаза и 30% рутила, удельная поверхность 50±15 м2/г, размер частиц 30 нм, кристаллический TiO2 — 99,5% (https://www.aerosil.com/www2/uploads_all/productfinder/AEROXIDE-TiO2-P-25_2578_08122011164254.pdf).
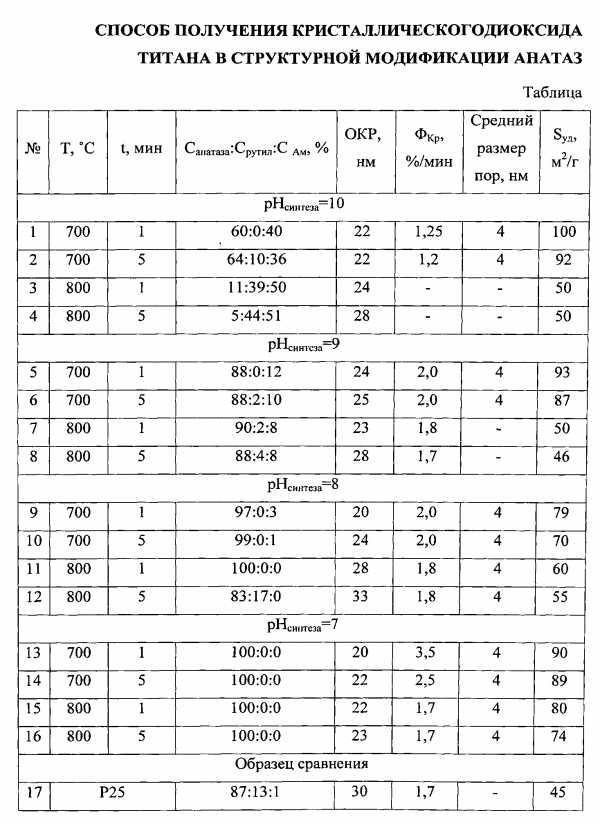
Кристаллографические и дисперсионные характеристики порошков диоксида титана, полученных по заявляемому способу, исследовали методом рентгенофазового анализа. По дифракционным спектрам порошковых образцов определяли содержание фазы анатаза (Санатаза), средние размеры областей когерентного рассеивания, по относительной интенсивности характеристичных рефлексов проводили оценку степени кристалличности диоксида титана в сравнении с образцом дисперсного материала марки аэрооксид Р25 с известным содержанием анатаза.
Удельную площадь поверхности (Sуд) и размер пор определяли методом измерения низкотемпературной адсорбции азота.
Исследование полученных образцов диоксида титана с помощью индикаторной методики показало, что все они имеют нейтральную реакцию поверхности.
Фотокаталитическую активность образцов диоксида титана, полученных по заявляемому способу, оценивали относительно фотокатализатора Р25 спектрофотометрической методикой. Для этого строили кинетические кривые реакции фоторазложения красителя сафранина Т в ходе ультрафиолетового облучения суспензии, содержащей 0,1 г диоксида титана, 50 мл дистиллированной воды и 3·10-6 г красителя (фиг. 3).
Облучение суспензии проводили лампой ДРТ-125-1. За изменением концентрации красителя в пробах суспензии следили по изменению интенсивности полосы поглощения, соответствующей максимальному поглощению красителя с λmax=518 нм. Для отделения раствора красителя от частиц фотокатализатора использовали центрифугирование. Регистрацию спектров красителя в фугате проводили через равные промежутки времени облучения — 20 мин. Для построения графической зависимости рассчитывали изменение концентрации красителя в суспензии по формуле:
ΔCKp=((С0-С)/С0)·100%, где ΔCKp — изменение концентрации красителя в суспензии, выраженное в %, С0 — исходная концентрация красителя, С — концентрация красителя в момент измерения τ.
Коэффициент фотокаталитической активности (ФKp) определяли по тангенсу угла наклона касательной кинетических зависимостей.
Обобщенные данные, полученные в результате измерений и расчетов, приведены в Таблице.
Сущность изобретения поясняется примерами.
Пример 1.
Способ получения кристаллического диоксида титана с размером частиц 10-50 нм, фиг. 1, в структурной модификации анатаз, фиг. 2а, из спиртового раствора тетрахлорида титана.
Раствор тетрахлорида титана в этиловом спирте готовили путем вливания TiCl4 в абсолютный этиловый спирт при непрерывном перемешивании и температуре 10°C до достижения концентрации ионов титана в спиртовом растворе 30 мас. % в пересчете на TiO2, разбавляли равным количеством этилового спирта или воды до концентрации 15%, брали 50 мл этого раствора и смешивали методом двухструйной кристаллизации с 50 мл 15% раствора NH4OH в реакторе объемом 500 мл, содержащем 150 мл дистиллированной воды, смешивание вели в течение 10 мин при pH=7 при контроле температуры T=20-25°C при интенсивном механическом перемешивании, скорость вращения мешалки 1000 об/мин. Значение pH, установленное перед началом подачи растворов реагентов раствором гидроксида аммония, поддерживали постоянным в ходе всего синтеза. После окончания подачи растворов суспензию выдерживали при перемешивании 30 мин для окончания процессов ионного обмена. Осадок гидроксида титана вместе с маточным раствором, содержащим хлорид аммония, этиловый спирт и воду, сушили выпариванием при температуре 70°C, затем прокаливали при 700°C в течение 1 мин.
Полученный образец (Таблица, №13) содержит только кристаллические частицы диоксида титана размером 10-50 нм с порами 4 нм в структурной модификации анатаз, в 2 раза превосходит фотокатализатор Р25 по величине удельной поверхности и более чем в 2 раза — по фотокаталитической активности в реакции разложения сафранина Т.
Примеры варьирования параметров синтеза для других температур, времен прокаливания и pHсинтеза приведены в Таблице.
Приведенные примеры подтверждают возможность получения предложенным способом кристаллического диоксида титана с удельной поверхность более 50 м2/г в модификации анатаз. Полученный диоксид титана не содержит аморфных частиц, обладает фотокаталитической активностью не хуже, чем у промышленного фотокатализатора Р25, имеет нейтральную реакцию поверхности. При этом способ получения диоксида титана предельно прост.
Заявленное изобретение позволяет применять фотокаталитические материалы в области экологии для очистки воды и воздуха от органических загрязнителей, в области производства строительных материалов с эффектом самоочищающихся поверхностей, в химической промышленности для получения молекулярного водорода.
Технический результат. Изобретение позволяет получить диоксид титана в модификации анатаз, обладающий повышенной термической стабильностью до 800°C, с повышенной до 100% кристалличностью, высокой удельной площадью до 70 м2/г, с нейтральной реакцией поверхности, с размером частиц 10-50 нм, а также сократить продолжительность процесса изготовления и издержки на утилизацию промывных вод за счет исключения стадии промывки.
1. Способ получения кристаллического диоксида титана в структурной модификации анатаз, включающий приготовление исходного раствора, содержащего тетрахлорид титана, его гидролиз раствором гидроксида аммония при заданном значении pH, образование осадка, его сушку и прокаливание, отличающийся тем, что исходный раствор готовят растворением тетрахлорида титана в этиловом спирте до получения концентрации ионов титана не менее 30% в пересчете на TiO2, гидролиз проводят в термостатируемом реакторе при pH=7-10, температуре 20-25°C и механическом перемешивании со скоростью вращения мешалки 1000 об/мин, подавая исходный раствор и раствор гидроксида аммония в эквимолярных концентрациях двумя струями, прокаливание полученного осадка проводят при 700-800°C в течение 1-5 мин.
2. Способ по п. 1, отличающийся тем, что в процессе гидролиза тетрахлорида титана получают побочный продукт хлорид аммония в количестве не менее 4 моль/моль TiO2, служащий стабилизатором анатазной структуры диоксида титана с размером частиц 10-50 нм.
3. Способ по п. 1, отличающийся тем, что подвергаемый гидролизу исходный раствор разбавляют равным количеством этилового спирта или воды.
4. Способ по п. 1, отличающийся тем, что исходный раствор и раствор гидроксида аммония подают в реактор с одинаковой скоростью.
5. Способ по п. 1, отличающийся тем, что осадок сушат при температуре не менее 70°C выпариванием маточного раствора.
findpatent.ru
Диоксид титана Pretiox AV01SF (анатазный)
Пигменты представляют собой компоненты разнообразных материалов, предназначенных для окрашивания, а также для создания оттенков цветов. На простом языке мы называем их красителями. В природе существует несколько групп таких красителей и самые известные из них – это органические и неорганические. Первые получают путем проведения определенных химических реакций, а также создают их используя природные минералы. Прочность их соединений на молекулярном уровне дает им свойство при нанесении на какие-либо материалы, создавать некий защитный слой, которому свойственная долговечность. Нередко неорганические красители используются для придания металлу антикоррозийных свойств. Кроме того, на основе подобных красителей создаются специальные материалы, защищающие не только металлические, но и другие конструкции от ржавчины, разрушения и сырости.
Что касается природных, т.е. органических красителей, то они содержатся в живых организмах.Наверное, вы могли заметить, какой цвет имеет море и дело здесь не только в преломлении солнечных лучей, а также песке, который тоже способен давать оттенки, а в живых организмах, которых в морских глубинах огромное множество. Такие пигменты называют биологическими. Их применение весьма распространено, как в медицине, так и в косметологии. Проще говоря, в древние времена женщины тоже пользовались средствами макияжа, только краски у них были получены в результате обработки вот таких природных пигментов.
Преимущества пигментов не имеют границ, во-первых, без пигментов невозможно было бы оформить декоративные предметы, да и вообще создать что-либо цветное.
Пигмент придает предмету не только цвет, но и определенные свойства, иногда эти свойства играют на пользу не только самого предмета, защищая его от загрязнений и микро повреждений, но и человека. К примеру, биологические, т.е. органические пигменты нередко входят в состав лекарственных препаратов и мазей, которые при нанесении на кожу, впитываются и способствуют заживлению. Это хорошо доказывают оливковое и облепиховое масла.
Перед тем как пигмент купить, необходимо учитывать и то, что красители созданные на основе разных веществ и биоматериалов могут придавать предмету разные свойства. Так, чаще всего пигменты имеют пластинчатую форму, если посмотреть на них в микроскоп. Данный пигмент будет придавать материалу большую степень укрывистости, а это значит, что краска прослужит дольше.
www.gis-pigment.com
Нано оксид титана
Нано двуокись титана
NTitanium
Не для продажи — только для информации

Высокочистый нано диоксид титана в анатазной и рутильной форме. Средний размер частиц
менее 100нм.
Представленные наноразмерные оксиды титана имеют хорошую прозрачность и отличную
способность к поглощению ультрафиолетового излучения в длинноволновом (UVA) и средневолновом
(UVB) диапазонах, в отличие от обычного диоксида титана. Нано оксид титана не растворим
в воде, органических кислотах, слабых неорганических кислотах. Растворим в серной
и фтористоводородной кислотах, щелочах.
Описание
NTitanium-01 – двуокись титана анатазного типа, включающая другие оксиды металлов и окислов. Он может быть использован как фотокаталитический материал. Под воздействием света с длиной волны менее 400нм, материал выделяет электроны, создавая заряженную зону на поверхности, воздействуя на абсорбированные кислород (O2) и воду (h3O), образуя активные анионные радикалы. Эти радикалы разлагают опасные газы, и органические загрязнения. Данный процесс называется фотокатализом. Благодаря своим фотокаталитическим свойствам материал может широко использоваться для очистки воздуха и вредных выбросов. NTitanium-01 – стабильно в широком диапазоне поглощает свет.
NTitanium-02 –двуокись титана в рутильной форме. Хорошо экранирует ультрафиолетовое излучение. Может быть использован в сочетании с оксидом цинка. Под действием ультрафиолетовых лучей и кислорода он приобретает хорошие бактерицидные свойства. Материал может быть использован в солнцезащитной косметике, в функциональных химических волокнах, в высококачественных пластиках и в других сферах.
NTitanium-03 – двуокись титана, рутил. Обладает гидрофильными свойствами. Средний размер частиц менее 80нм. Удельная поверхность 30м2/г. Приятный на ощупь. Подходящий в качестве экранирующего агента в солнцезащитной косметике.
NTitanium-04 – обладает теми же свойствами, что и NTitanium-03. Отличие: гидрофобный, хорошо смешивается с жирами.
NTitanium-03H и NTitanium-04H – с теми же свойствами, что NTitanium-03 и NTitanium-04, только предназначены для косметики. Они лучше абсорбируют ультрафиолетовое облучение UVA и UVB по сравнению с органическими добавками и хорошо сочетаются с другим косметическим сырьем. Это идеальные добавки, экранирующие ультрафиолетовое излучение.
| Наименование | TiO2,%, мин | Средний размер частиц, нм | Удельная поверхность, м2/г, мин | Комментарий |
|---|---|---|---|---|
| NTitanium-01 (анатаз) |
99 | 10 | 150 | Высокая удельная поверхность и фотокаталитическая активность |
| NTitanium-01W (анатаз) |
94 | 10 | 100 | Наивысшая фотокаталитическая активность |
| NTitanium-01Mn (анатаз) |
96 | 10 | 100 | Наивысшая фотокаталитическая активность |
| NTitanium-02 (рутил) |
99 | 20 | 40 | Чистый диоксид титана (рутил) |
| NTitanium-02G (рутил) |
99.9 | 20 | 8 | Диоксид титана (рутил) высокочистый |
| NTitanium-03-01 (анатаз) |
96 | 20 | - | Гидрофильный |
| NTitanium-03-02 (рутил) |
92 | 30 | - | Гидрофильный |
| NTitanium-03H (рутил) |
88 | 30 | 100 | Гидрофильный (специально для косметической промышленности) |
| NTitanium-04-01 (рутил) |
96 | 20 | - | Хорошо смешивается с жирами |
| NTitanium-04-02 (рутил) |
92 | 20 | - | Хорошо смешивается с жирами |
| NTitanium-04H (рутил) |
85 | 30 | 100 | Хорошо смешивается с жирами (специально для косметической промышленности) |
Области применения
В материалах для защиты от ультрафиолетового излучения, в химических волокнах, в
печатных красках, покрытиях и т.п.
Для фотокатализа, в производстве самоочищающегося стекла, самоочищающейся керамики,
в антибактериальных материалах, для очистки воздуха, очистки стоков, в химической
индустрии.
В косметике, для солнцезащитных кремов, утренних и вечерних кремов, увлажняющих
и освежающих кремов и т.п.
В упаковочных материалах, используемых в пищевой упаковки.
Как покрытие в бумажной индустрии.
В космической индустрии.
Рекомендации по дозировке
Поскольку данная серия продуктов имеет очень широкую область применения, диапазон также широк от 0.5% до 8% в зависимости от цели применения продукта.
При использовании продукта как экранирующего агента в основном используют концентрацию 1% — 3%. 3% — 5% для композиций, защищающих от обесцвечивания и влаги. 3% — 8% для защиты от ультрафиолета в косметических материалах. Приблизительно 2.5% для печатных красок и покрытий.
В каждом конкретном случае, контактируйте с нами для рекомендаций. Однако, пользователь должен, в конечном счете, самостоятельно протестировать продукт.
ru.nanoformula.eu

