Химия. Амфотерность алюминия — материалы для подготовки к ЕГЭ по Химии
Алюминий – амфотерный элемент. Это означает, что его соединения могут проявлять кислотные свойства и образовывать соли с активными металлами. В зависимости от условий реакции соль может быть безводной, например, . Эта безводная соль в некоторых изданиях представлена как . Разница между этими двумя способами представления безводной соли скорее стилистическая. Оба варианта являются правильными, ни один из них не будет засчитан на ЕГЭ за ошибку. При попытке получить ту же соль в водной среде получается гидроксокомплекс. Его формулу записывают как или . Здесь снова оба варианта являются равноправными. Обе эти соли, безводную и гидроксокомплекс, можно получать из алюминия, его оксида и гидроксида. Соли можно превращать друг в друга.
Из-за большого количества схожих реакций эта тема сложна для запоминания. Ниже приводится схема, позволяющая быстро определять продукты реакций и их условий.
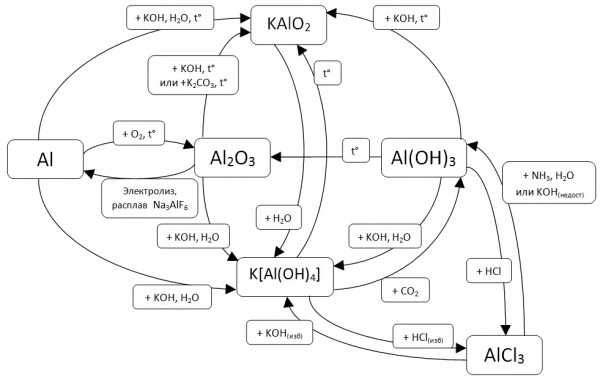
В схеме ячейки соединены стрелками. Каждой стрелки касается надпись с условиями и веществами, необходимыми для такого перехода. Стоит заметить, что во всех местах калий может быть заменен на натрий без ущерба для смысла.
Продемонстрируем использование этой схемы на примере задания, похожего на задание № 37 ЕГЭ по химии.
Алюминий прореагировал с раствором гидроксида натрия. Через полученный раствор пропустили углекислый газ. Выпавший осадок отделили, прокалили и сплавили с карбонатом калия. Напишите уравнения четырех описанных реакций.
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
Амфотерные металлы и их свойства
Амфотерные металлы – это простые вещества, которые по структуре, химическим и физическим свойствам сходны с металлической группой элементов. Сами по себе металлы не могут проявлять амфотерных свойств, в отличие от их соединений. Например, оксиды и гидроксиды некоторых металлов обладают двойственной химической природой – в одних условиях они ведут себя как кислоты, а в других обладают свойствами щелочей.
Основные амфотерные металлы – это алюминий, цинк, хром, железо. К этой же группе элементов можно отнести бериллий и стронций.
Что такое амфотерность?
Впервые это свойство было обнаружено достаточно давно. А термин «амфотерные элементы» был введен в науку в 1814 году известными химиками Л. Тенаром и Ж. Гей-Люссаком. В те времена химические соединения принято было разделять на группы, которые соответствовали их основным свойствами во время реакций.
Тем не менее, группа оксидов и оснований обладала двойственными способностями. В некоторых условиях такие вещества вели себя как щелочи, в других же, наоборот, действовали как кислоты. Именно так и возник термин «амфотерность». Для таких химических веществ поведение во время кислотно-основной реакции зависит от условий ее проведения, природы участвующих реагентов, а также от свойств растворителя.
Интересно, что в естественных условиях амфотерные металлы могут взаимодействовать как с щелочью, так и с кислотой. Например, во время реакции алюминия с сульфатной кислотой образуется сульфат алюминия. А при реакции этого же метала с концентрированной щелочью образуется комплексная соль.
Амфотерные основания и их основные свойства
При нормальных условиях это твердые вещества. Они практически не растворяются в воде и считаются довольно слабыми электролитами.
Основной метод получения таких оснований – это реакция соли металла с небольшим количеством щелочи. Реакцию осаждения нужно проводить медленно и осторожно. Например, при получении гидроксида цинка в пробирку с хлоридом цинка осторожно, каплями добавляют едкий натр. Каждый раз нужно несильно встряхивать емкость, чтобы увидеть белый осадок металла на дне посуды.
С кислотами и кислотными оксидами амфотерные вещества реагируют как основания. Например, при реакции гидроксида цинка с соляной кислотой образуется хлорид цинка.
А вот во время реакций с основаниями амфотерные основания ведут себя как кислоты.
Кроме того, при сильном нагревании амфотерные гидроксиды разлагаются с образованием соответствующего амфотерного оксида и воды.
Самые распространенные амфотерные металлы: краткая характеристика
Цинк относится к группе амфотерных элементов. И хотя сплавы этого вещества широко использовались еще в древних цивилизациях, в чистом виде его смогли выделить лишь в 1746 году.
Чистый металл представляет собой достаточно хрупкое вещество голубоватого цвета. На воздухе цинк быстро окисляется – его поверхность тускнеет и покрывается тонкой пленкой оксида.
В природе цинк существует преимущественно в виде минералов – цинкитов, смитсонитов, каламитов. Самое известное вещество – это цинковая обманка, которая состоит из сульфида цинка. Самые большие месторождения этого минерала находятся в Боливии и Австралии.
Алюминий на сегодняшний день считается наиболее распространенным металлом на планете. Его сплавы использовались на протяжении многих столетий, а в 1825 году вещество было выделено в чистом виде.
Чистый алюминий представляет собой легкий металл серебристого цвета. Он легко поддается механической обработке и литью. Этот элемент обладает высокой электро- и теплопроводностью. Кроме того, данный металл стоек к коррозии. Дело в том, что поверхность его покрыта тонкой, но очень стойкой оксидной пленкой.
На сегодняшний день алюминий широко применяется в промышленности.
autogear.ru
Химические свойства амфотерных оксидов | CHEMEGE.RU
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Поделиться ссылкой:
chemege.ru
Алюминия амфотерные свойства — Справочник химика 21
Приведенный обзор показывает, что по сравнению с бором у алюминия признаки металлического элемента заметно усиливаются, В частности, в отличие от кислотных соединений бора однотипные соединения алюминия (П1) проявляют амфотерные свойства. Ослабление кислотных признаков однотипных производных алюминия (III) по сравнению с бором (III), а также у алюминия (III) по сравнению с кремнием (IV) можно проиллюстрировать на следующих примерах [c.461]Растворяться в растворах кислот и щелочей с выделением водорода способны металлы, гидроокиси которых обладают амфотерными свойствами. Программа средней школы знакомит лишь с цинком и алюминием. Это определяет возмолвеличину грамм-эквивалента металла и окончательно определить его природу. Взят алюминий. [c.185]
Приведенный обзор показывает, что по сравнению с бором у алюминия признаки металлического элемента заметно усиливаются. В частности, в отличие от кислотных соединений бора однотипные соединения алюминия (П1) проявляют амфотерные свойства. Ослабление кислотных признаков однотипных производных алюминия (И1) по сравнению
Опыт 6. Амфотерные свойства гидрата окиси алюминия. К 4—5 мл раствора соли алюминия прибавить по каплям раствор щелочи до появления осадка. Полученную жидкость тс осадком разлить в две пробирки. В одну из них влить по каплям раствор кислоты, в другую — раствор щелочи. Наблюдать растворение осадка в том и другом случае. Написать молекулярные и ионные уравнения образования осадка и его растворения под действием кислоты и щелочи. [c.58]
Как практически убедиться в амфотерны, свойствах гидроксида алюминия Написать ураннения соответствующих реакций. [c.181]
Амфотерными свойствами обладают оксиды и гидр,оксиды бериллия, алюминия, галлия, индия, олова (И, IV), свинца (II, IV), цинка [c.240]
Атомы элементов третьей группы являются электронными аналогами, так как все они имеют одинаковое строение внешнего уровня 5 р (и одинаковое число электронов на нем). Металлические свойства у них выражены слабее, чем у элементов I и II главной подгрупп, а у бора, характеризующегося малым радиусом и наличием двух квантовых слоев, преобладают неметаллические свойства. За исключением неметалла бора, все они могут находиться в водных растворах в виде гидратированных положительно трехзарядных ионов. В этой подгруппе, как и в других, с увеличением порядкового номера металлические свойства сверху вниз усиливаются. Бор — кислотообразующий элемент, оксиды и гидроксиды алюминия, галлия и индия обладают амфотерными свойствами, а оксид таллия имеет основной характер. [c.104]
Амфотерные свойства гидроксида алюминия (как и других амфотерных гидроксидов) объясняются тем, что в водном растворе он способен диссоциировать как по типу кислоты (с обр.ч-зованием водородных ионов), так и по типу основного гидроксида (с образованием гидроксильных ионов) [c.15]
При увеличении п от 2 до 3 элемент приобретает уже металлические свойства. Алюминий — металл, но еще не типичный. Его соединения обладают амфотерными свойствами.
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий-амфотерный элемент. Подобные свойства имеют также элементы А-групп-Ве, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., a также больщинство элементов Б-групп-Сг, Мп, Fe, Zn, d, Au и др. Например [c.98]
Гидроксид алюминия А1(0Н)з входит в состав многих природных бокситов (гиббсит). В воде практически не растворяется и является слабым основанием. Проявляет амфотерные свойства и растворяется как в кислотах, так и в щелочах [c.177]
Использование равновесий (146) особенно эффективно для отделения амфотерных элементов от металлов, не обладающих амфотерными свойствами. Например, алюминий [c.194]
Гидроксид алюминия, как и оксид, обладает амфотерными свойствами. [c.284]
Из приведенных примеров видно, что цинк (как и алюминий) обладает двойственной природой, а его оксид и гидроксид — амфотерными свойствами. [c.108]
Гидроокись алюминия обладает амфотерными свойствами. [c.221]
Амфотерными свойствами обладают гидроксиды хрома, цинка, алюминия, свинца, олова, сурьмы и др. Оксиды также могут быть амфотерными (например, SnO) и растворяться как в кислотах, так н щелочах. [c.126]
III аналитической группы (в отличие от катионов I и II групп) обладают рядом характерных особенностей их соли в водных растворах подвергаются гидролизу катионы проявляют окислительновосстановительные свойства (кроме АР+) при осаждении групповым реагентом образуют коллоидные растворы гидроксиды алюминия, хрома и цинка проявляют амфотерные свойства, образуют комплексные соединения. [c.289]
Амфотерными свойствами обладают гидроокиси хрома, цинка, алюминия, свинца, олова, сурьмы и некоторые другие. [c.209]
Другие теоретические вопросы. Катионы III аналитической группы (в отличие от катионов I и 11 групп) обладают рядом характерных особенностей их соли в водных растворах подвергаются гидролизу катионы проявляют окислительно-восстановительные свойства при осаждении групповым реактивом образуют коллоидные растворы гидроокиси алюминия, хрома и цинка проявляют амфотерные свойства образуют комплексные соединения. Для успешного изучения катионов III группы эти вопросы необходимо снова повторить. Они рассматривались ранее [c.259]
Металлические свойства элементов подгруппы бора выражены значительно слабее, чем у элементов подгруппы бериллия. Так, элемент бор, который в периоде расположен между бериллием и углеродом, относится к элементам-неметаллам. Он имеет наибольшую энергию ионизации атома (см. п. 3 табл. 13.3). Внутри подгруппы с возрастанием заряда ядра энергия ионизации атомов уменьшается и металлические свойства элементов усиливаются. Алюминий — уже металл, но не типичный. Его гидроксид обладает амфотерными свойствами. У таллия более сильно выражены металлические свойства, а в степени окисления + 1 он близок к элементам-металлам подгруппы лития. [c.248]
Подобно алюминию, галлий обладает амфотерными свойствами. Минеральные кислоты медленно растворяют его на холоду и быстро при нагрев
www.chem21.info
Алюминий амфотерность — Справочник химика 21
Оксид алюминия — амфотерный окисел. В воде не растворяется, но растворяется в щелочах с образованием гидроксоалюмината. [c.444]Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий-амфотерный элемент. Подобные свойства имеют также элементы А-групп-Ве, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., a также больщинство элементов Б-групп-Сг, Мп, Fe, Zn, d, Au и др. Например [c.98]
Гидроокись алюминия амфотерна. По отношению к сильным кислотам ведет себя как основание — вступает с ними во взаимодействие, образуя соли [c.245]
Гидроксид алюминия — амфотерное соединение, легко растворяющееся как в кислотах, так и в щелочах [c.445]
Окись алюминия не растворяется в воде и не реагирует с ней. Окись алюминия амфотерна. По отношению к кислотам она ведет себя как основной окисел—растворяется в растворах кислот с Образованием алюминиевых солей, например [c.146]
Она кристаллизуется в решетке с таким же строением, как решетка окиси алюминия и подобно ей отличается высокой твердостью и тугоплавкостью. Окись хрома, как и окись алюминия, амфотерна. [c.149]
Гидроокись алюминия — амфотерное соединение — может реагировать и с кислотами, и с основаниями с образованием солей. На этом основании обычно считают, что она является одновре.менно и основанием, и кислотой. Вычислена даже константа диссоциации так называемой одноосновной алюминиевой кислоты К=6,3-10 (при 25°С) [1279]. Однако Реми [1107] считает, что способность гидроокиси алюминия образовывать соли с основаниями объясняется не отщеплением Н» -ионов при диссоциации, а дальнейшим присоединением к AJ (ОН)з ионов ОН. [c.13]
Гидроксид алюминия — амфотерное соединение, [c.50]
При движении вниз в главных подгруппах усиливаются основные свойства оксидов и гидроксидов и ослабевают кислотные. Например, азот в степени окисления -1-5 дает сильную кислоту — азотную, фосфор — более слабую фосфорную кислоту оксид бора — кислотный оксид, в то время как оксид алюминия— амфотерный. [c.185]
Гидроокись алюминия амфотерна сна играет роль основания по отношению к сильным кислотам и ведет себя, как кислота, по отношению к сильным осиованиЯ М. [c.211]
Рассмотрим остальные элементы, приведенные во второй серии магний, алюминий, кремний, фосфор, серу, хлор и аргон. Проходя по этой серии элементов, мы как бы завершаем второй завиток той же спирали. Действительно, за натрием следует м а г н и й—двухвалентный элемент, схожий с бериллием, но отличающийся от него сильнее выраженными металлическими свойствами (влияние второго промежуточного электронного слоя). Далее следует а л ю м и н и й—трехвалентный элемент, как и бор (однако алюминий—амфотерный металл, а бор—металлоид). За алюминием следует кремни й—аналог углерода, затем ф о с ф о р—элемент той же группы, что и азот, в значительной мере схожий с азотом по свойствам. Затем сер а— аналог кислорода (находится с ним в одной и той же группе), затем хло р— [c.191]
Алюминий—амфотерный элемент. Наличие иона алюминия в растворе обнаруживают, пользуясь амфотерным характером гидроокиси алюминия i M. лабораторную работу № 15). Порядок работы таков [c.373]
Гидроокись алюминия амфотерна (отдает иди получает пару электронов) [c.89]
Алюминий — амфотерный элемент, он хорошо растворяется в едких щелочах с выделением водорода, а в растворе остается алюминат. [c.440]
Соединения алюминия проявляют как ионные, так и ковалентные свойства. Так, треххлористый алюминий в водных растворах имеет ионный характер, а в бензоле — ковалентный Гидроокись алюминия амфотерна и может реагировать по трек направлениям. Во-первых, с избытком щелочей она реагирует как кислота с образованием алюминатов, содержащих в своем составе, например, ион [ЛЮг]». Алюминаты щелочных металлов растворимы. Поэтому, если при обработке растворов гидро- [c.100]
Алюминий — амфотерный элемент. [c.149]
Гидроокись алюминия амфотерна, легко диссоциирует [c.296]
Соединения алюминия. Амфотерность. При горении алюминия на воздухе получается окись алюминия АЬОз — белое, очень тугоплавкое вещество. В природе окись алюминия встречается в виде минерала корунда, по твердости уступающего только алмазу. Окрашенные примесями в красный или синий цвет кристаллы АЬОз ценятся как драгоценные камни — рубин и сапфир. В настоящее время рубины получают искусственно, сплавляя окись алюминия с окислами хрома в электрических печах. Искусственные рубины применяются в точном приборостроении, для изготовления камней в часах и т. п. Непрозрачные кристаллы корунда в виде наждака используют для шлифования и полирования металлических и других изделий. [c.236]
Алюминий — амфотерный металл. В этом проявляется его сходство с бериллием. Поведение алюминия при взаимодействии с кислотами определяется наличием оксидной пленки. Он активно реагирует с хлороводородной кислотой, которая разрушает защитную оксидную пленку [c.320]
Гидроксид алюминия — амфотерное основание. Наибольшую химическую активность проявляет аморфный гидроксид алюминия. В реакциях с кислотами гидроксид алюминия растворяется в результате образования координационных сфер, содержащих больше молекул воды, чем гидроксид-ионов [c.325]
Алюминий — амфотерный металл, способный растворяться в кислотах и щелочах [c.362]
Согласно их положению в периодической таблице, галлий, индий и таллий трехвалентны. В отличие от бора и алюминия галлий может быть также двухвалентным, индий — одно- и двухвалентным, а таллий — одновалентным (см. табл. 70, стр. 554). Галлий и индий в низших степенях окисления менее устойчивы, чем в трехвалентном состоянии. В своих трехвалентных соединениях галлий и индий во многом похожи на алюминий. Их гидроокиси, как и гидроокись алюминия, амфотерны, а их соли в водных растворах гидролизуются. Оба металла образуют квасцы, изоморфные алюминиевым квасцам (стр. 387). Таллий в одновалентном состоянии более устойчив, чем в трехвалентном. В трехвалентном состоянии он сильно отличается от алюминия. [c.571]
Оксид. Бинарное соединение алюминия с кислородом (глинозем) AI2O3 известно в неск
www.chem21.info
Определение кал ция амфотерных металлах
Осаждение гидроокисей. Осаждение гидроокисей широко применяется и в качественном, и в количественном анализе для открытия, отделения и определения катионов. В некоторых случаях разделение катионов основано на амфотерном характере некоторых окислов металлов. Так, например, железо отделяют от ванадия, молибдена, алюминия и т. п. элементов, обрабатывая раствор избытком ш,елочи. В других случаях разделение элементов основано на различной растворимости гидроокисей. Так, при анализе многих руд, металлов, шлаков, известняков и т. п. материалов, для отделения алюминия и железа от марганца, магния, кальция и других элементов используют то обстоятельство, что гидроокиси большинства трехвалентных металлов значительно менее растворимы, чем гидроокиси многих двухвалентных металлов. Слабые основания, как, например, гидроокись аммония, пиридин (С Н Н) и др., количественно осаждают гидроокиси алюминия и железа, тогда как ионы кальция, магния и многих Других двухвалентных элементов остаются в растворе. [c.94]Многочисленные явления, относящиеся к сорбции ионов гидроокисями, могут быть истолкованы на основе ионообменного равновесия, хотя из результатов ранних работ не всегда ясно, протекает ли процесс сорбции во всем объеме твердой фазы или только на поверхности. Этот вопрос мо. но легко разрешить, определив полную емкость данной массы ионообменника в зависимости от его поверхности однако до настоящего времени подобные определения проводились очень редко. Свежеосажденные окиси трехвалентных металлов — очень эффективные сорбенты например, гидратированная окись железа хорошо сорбирует катионы щелочноземельных элементов (в соответствии с законом действия масс) [3] другие двухвалентные катионы [4] сорбируются при pH выше 7. Можно предположить, что катионы щелочных металлов и щелочноземельных элементов сорбируются на поверхности и легко элюируются, а катионы с более высоким зарядом (Се +, Рт +, Ки +) сорбируются во всем объеме ионообменника и вымываются с трудом [5]. Пока еще неизвестно, в какой мере это явление связано с ионным обменом, так как подобные ионы могут также соосаждаться на окислах. Амфотерные окислы, такие, как гидроокись алюминия, в зависимости от pH раствора могут сорбировать либо катионы, либо анионы, что может быть выражено следующим уравнением [6] [c.114]
Подобные марганцу элементы иногда называют амфотерными , что весьма неудачно, так как амфотерность является свойством не элемента, а гидроокиси КОН. 0,711 при общей характеристике элементов односторонне руководствоваться свойствами типичных для них гидроокисей, то некоторые металлы (Ке, Ш и др.) пришлось бы называть металлоидами. Из изложенного следует, что общеупотребительное в науке и технике определение понятия металл по состоянию вещества (III 8) не всегда совпадает с определением того же понятия по свойствам типичной для данного элемента гидроокиси (II 5). [c.180]
Определение кальция в амфотерных металлах, их соединениях п сплавах. Метод [126] позволяет определять (2—4) 10″ % Са в А1, Sn, Сг, Zn, бронзе, латуни, баббите и (1—2,5)-10 % Са в солях алюминия, свинца, цинка, олова, хрома и бериллия. [c.199]
Осаждение гидроокиси магния избытком едкого натра в присутствии алюминия, олова, цинка и других амфотерных металлов более пригодно для повышения концентрации магния в растворе, чем для отделения его от этих металлов, поскольку они соосаждаются вместе с гидроокисью магния. Метод отделения магния от таких металлов, как железо, марганец, медь, цинк, свинец и никель, основан на осаждении гидроокиси магния едким натром в присутствии тартрата или цианида, которые предотвращают осаждение указанных металлов . Этот метод выделения магния был применен для определения его в сплавах алюминия. Для отделения магния от больших количеств титана применяют осаждение магния в виде гидроокиси из растворов, содержащих перекись водорода . [c.528]
Белковые (коллоидные) ошибки. Специфические химические реакции между растворенным веществом (как, например, ионами тяжелых металлов) и индикатором могут привести к заметным ошибкам при определении pH. Влияние, оказываемое белками и коллоидами на результаты измерений pH с помощью индикаторов, обусловлено амфотерностью белковых молекул или зарядом коллоидных частиц. Вероятно, связывание индикаторных красителей сильно зависит от заряда белка оно является наименьшим вблизи изоэлектрической точки. Кларк [9, стр. 185, 186] приводит для некоторых индикаторов значения белковой ошибки, выраженной в единицах pH. [c.152]
Минимум растворимости идентичен изоэлектрической точке. Это понятие применимо не только к амфотерным соединениям, как это обычно принято, но и к ступенчато образующимся комплексам. Можно говорить об изоэлектрической точке не только для гидроксосоединений, где она характеризуется определенным значением pH, но вообще для любого вида комплексов, если при ступенчатом комплексообразовании ионы могут обладать последовательно положительным и отрицательным зарядом. Если М»+ — ион металла, X » —ион, являющийся лигандом, д — соответствующие координационные числа отдельных комплексов при ступенчатом комплексообразовании, Q — максимальное координационное число, то для изоэлектрической точки справедливо соотнощение [c.42]
Хромопротеиды фикобилинов амфотерны, немного кислотны, но легко образуют эфиры. Они образуют комплексы с цинком и медью, но не содержат никакого металла в естественном состоянии. Малые количества кальция (0,25%) > найденные Лембергом [49] в их золе, вероятно, обусловлены адсорбированным сульфатом кальция магний и железо в них определенно отсутствуют. [c.482]
Химические свойства. Этиловый спирт — нейтральное соединение, но все же в определенных реакциях спирты проявляют свойства очень слабых кислот и слабых оснований, т. е. являются амфотерными, подобно воде. Кислотные свойства спирта проявляются при взаимодействии его с щелочными металлами. [c.271]
Свойства элементов в данном периоде также проявляют определенную закономерность при переходе от начала периода к его концу усиливаются металлоидные свойства, а металлические ослабляются. Например, в 3-м периоде Na, Mg, AI, Si, P, S, l первые представители Na и Mg проявляют только металлические свойства, а Si, Р, S, С1 — только металлоидные А1 как элемент, занимающий промежуточное место между металлами и металлоидами, проявляет амфотерные свойства. [c.83]
Методы, основанные на амфотерности алюминия. Алюминий — амфотерный металл—отделяют как от катионов,так иани-онов сорбцией на катионитах в ЫН4-форме из растворов с pH 2,5—3,0. Для его десорбции используют при этом растворы щелочей [222,238, 239, 356, 357]. Лазарев [222] при определении алюминия в сплавах альнико и бронзах раствор пропускает через колонку с СБС в Н» -форме, затем алюминий извлекает 300 мл 1 N раствора МаОН и 50 мл воды со скоростью 3,5 мл1мин. [c.185]
Осаждение в присутствии минеральных кислот выполнять нельзя вследствие
www.chem21.info
Амфотерной металл — Большая Энциклопедия Нефти и Газа, статья, страница 1
Амфотерной металл
Cтраница 1
Амфотерные металлы ( Zn, Al, Sn, Pb) достаточно-устойчивы в нейтральных, но нестойки в кислой и щелочной средах, так как в них растворимы их оксиды. [2]
Гидроксосоли амфотерных металлов, например Fe2 и Fe3, могут существовать только в присутствии большого количества щелочи. [3]
В случае амфотерных металлов ( например, алюминия, цинка, свинца, олова) избыток щелочи, образующийся на поверхности перезащищенных конструкций, приводит к увеличению агрессивности среды, а не к подавлению коррозии. На примере свинца было показано [ 211, что катодная защита достижима и в щелочной области рН, но критический потенциал полной защиты ( см. ниже) сдвигается в область более отрицательных значений. Алюминий может быть катодно защищен от питтинговой коррозии, если обеспечить его контакт с цинком [22], который выполняет роль протектора. Контакт с магнием может привести к перезащите с последующим разрушением алюминия. [4]
Олово является амфотерным металлом и быстро корродирует л растворах сильных кислот и щелочей, в хлоре, броме и иоде при комнатной температуре, а во фторе — при 100 С и выше. [5]
Группа II — амфотерные металлы, достаточно устойчивые в нейтральной среде, но неустойчивые в кислых и щелочных средах. [6]
Известны примеры реэкс-тракции амфотерных металлов щелочным водным растворов, например, из оксинатов или дитизонатов алюминия, свинца и цинка. [7]
В случаях перезащиты амфотерных металлов ( например, А1, Zn, Pb, Sn) образующийся при этом избыток щелочи вызывает разрушение металла большее, чем снижение коррозии из-за катодной защиты. Для свинца было показано [16], что катодная защита возможна и в щелочном диапазоне рН, однако потенциал, при котором достигается полная защита, сдвигается при этом в сторону более отрицательных значений. [8]
Иной характер носят гидриды амфотерных металлов — Snh5, Sbh4, Geh5; по своей природе эти гидриды приближаются к гидридам неметаллов. Обычно они представляют собой газообразные или жидкие вещества с характерным запахом. [9]
Щелочи взаимодействуют только с амфотерными металлами, образуя соли и водород. Например, легкость растворения алюминия в сильных щелочах, несмотря на то, что он снаружи покрыт стойкой защитной окисной пленкой амфотерного окисла А12О3, обусловливается легкой растворимостью этой пленки в щелочи с обнажением свободной поверхности металла. Как химически активный металл алюминий далее реагирует с водой. [10]
Определение микропримеси кальция в амфотерных металлах, их соединениях и сплавах За-ьодск. [11]
В качестве примеров обратной экстракции амфотерных металлов в щелочную водную фазу можно назвать извлечение ионов алюминия, свинца и цинка при использовании оксина или дитизона. [12]
По аналогичному механизму реагируют со щелочами и другие амфотерные металлы: галлий, алюминий, цинк. Более сложно протекает процесс растворения у менее активных амфотерных металлов, не способных выделять водород из воды. [13]
Эта же реакция имеет место и при растворении амфотерных металлов в растворах щелочей. Ионы гидроксония в растворах щелочей появляются вследствие диссоциации воды, и, хотя их концентрация в каждый данный момент ничтожно мала, убыль их немедленно восполняется диссоциацией новых и новых молекул воды. [14]
Преимуществом использования в качестве катализаторов алкоксидов и окислов амфотерных металлов является возможность проведения реакции в нейтральной среде. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
