Методическая разработка по химии на тему «Амфотерные соединения»
ГОСУДАРСТВЕННОЕ
АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
НОВОСИБИРСКОЙ ОБЛАСТИ
«БАРАБИНСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Рассмотрено на заседании ЦМК
Протокол № ____от________________
Председатель_____________________
(Ф.И.О)
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ТЕОРЕТИЧЕСКОГО ЗАНЯТИЯ ДЛЯ ПРЕПОДАВАТЕЛЯ
Специальность 34.
Учебный предмет ОУП.11. Химия
Раздел 3. Неорганическая химия
Тема 3.8. Амфотерные соединения
Разработчик: преподаватель химии Дъячук Людмила Владимировна
2021
Содержание
Методический лист ……………………………………………………………4
Примерная хронокарта занятия……………………………………………….6
Исходный материал……………………………………………………………9
Контроль знаний по предыдущей теме………………………………………14
Задания для закрепления и систематизации знаний………………………..15
Предварительный контроль знаний………………………………………….16
Задание для самостоятельной внеаудиторной работы студентов………. ..17
Список использованных источников…………………………………………18
Выписка
из рабочей программы
учебного предмета ОУП. 11. Химия
11. Химия
для специальности 34.02.01 Сестринское дело (с базовой
подготовкой)
Тема 3.8. Амфотерные соединения | Содержание учебного материала | 2 |
|
Амфотерность оксидов и гидроксидов переходных металлов и алюминия, взаимодействие с кислотами и щелочами. Амфотерность аминокислот, образование пептидов. Комплексные соединения. Формирование умения выполнять самостоятельный поиск химической информации с использованием различных источников. | 1,2 | ||
Лабораторные работы | — |
| |
Практические занятия | — | ||
Контрольные работы | — | ||
Самостоятельная
работа обучающихся: подготовка рефератов, чтение текста учебника[2,§31, упр. | 2 |
МЕТОДИЧЕСКИЙ ЛИСТ
Тип занятия – комбинированный урок
Вид занятия – лекция, объяснение с демонстрацией наглядных пособий, выполнения упражнений.
Продолжительность – 90 мин.
ЦЕЛИ ЗАНЯТИЯ
1. Учебные цели:
— сформировать знания об амфотерности оксидов и гидроксидов переходных металлов и алюминия, взаимодействии с кислотами и щелочами, амфотерности аминокислот, образовании пептидов, комплексных соединениях. Сформировать умения характеризовать свойства амфотерных соединений.
2. Развивающие цели:
— развивать логическое мышление,
внимание, память, умение осуществлять самостоятельный поиск информации в
различных источниках, организовывать собственную деятельность, необходимую для
выполнения профессиональных задач; развивать навыки познавательной
деятельности, способность и готовность к самостоятельному поиску методов
решения практических задач, применению различных методов познания; владение
навыками познавательной рефлексии как осознания совершаемых действий и
мыслительных процессов, их результатов и оснований, границ своего знания и
незнания, новых познавательных задач и средств их достижения.
3. Воспитательные цели:
— формирование готовности и способности к образованию, в том числе самообразованию, на протяжении всей жизни; сознательного отношения к непрерывному образованию как условию успешной профессиональной и общественной деятельности; самостоятельно осуществлять, контролировать и корректировать деятельность.
Методы обучения – объяснительно-иллюстративный, репродуктивный, частично – поисковый.
Место проведения занятия – кабинет биологии, анатомии и генетики
человека с основами медицинской генетики.
МОТИВАЦИЯХимия – это всегда единство противоположностей.
Рассмотрим элементы
периодической системы, соединения которых проявляют амфотерные
(противоположные) свойства. Амфотерность – это способность некоторых
простых веществ и соединений проявлять в зависимости от условий как кислотные,
так и основные свойства. С
каждым годом появляется все больше химических амфотерных соединений. Их называют материалами
будущего.
Их называют материалами
будущего.
В результате взаимодействия амфотерных гидроксидов со щелочами образуются комплексные соли, которые имеют огромное значение в жизнедеятельности живых организмов. Почти все ферменты и многие гормоны, гемоглобин крови, многие лекарства представляют собой комплексные соединения. В медицине они используются как противоядия, при лечении наследственных заболеваний, ревматоидного артрита. В медицинской практике при лечении многих заболеваний в качестве лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути.
Владение знаниями о свойствах амфотерных веществ и комплексных соединений позволит медицинскому работнику организовывать собственную деятельность для эффективного выполнения профессиональных задач, развивать навыки познавательной деятельности, способность и готовность к самостоятельному поиску методов решения практических задач, применению различных методов познания.
Исходный материал
План
1. Амфотерные соединения
Амфотерные соединения
2. Химические свойства амфотерных соединений
3. Комплексные соединения
1. Амфотерные соединения
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, т. е. проявлять основные свойства.
Амфотерны оксиды и гидроксиды многих элементов.
Схема
1
Амфотерные оксиды и гидроксиды
2. Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
2. Взаимодействуя со щелочами — сильными основаниями, амфотерные гидроксиды и оксиды проявляют кислотные свойства:
Взаимодействуя со щелочами, гидроксид алюминия также образует комплексные соли, состав которых может быть отражен формулой:
Теперь, когда мы
познакомились со строением продуктов взаимодействия амфотерных гидроксидов с
щелочами в растворе, вернемся к дальнейшему рассмотрению амфотерности.
и в присутствии кислоты ведет себя как основание (принимает Н+), а в присутствии основания — как кислота (отдает Н+).
В органической химии типичные амфотерные соединения — аминокислоты, общая формула которых для а-аминокислот такова:
Именно амфотерность аминокислот обусловливает их наиболее характерные свойства.
Кислотные свойства аминокислот проявляются в их способности взаимодействовать, например, с основаниями или вступать в реакцию этерификации с образованием сложных эфиров:
Основные свойства аминокислот проявляются в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:
Амфотерность аминокислот проявляется в их способности в растворе образовывать в результате диссоциации диполярный ион — как бы внутреннюю соль:
Аминокислоты могут вступать друг с другом в реакции поликонденсации, образуя полипептиды и белки:
Эти
процессы непрерывно протекают в клетках, обеспечивая в рибосомах биосинтез
белков.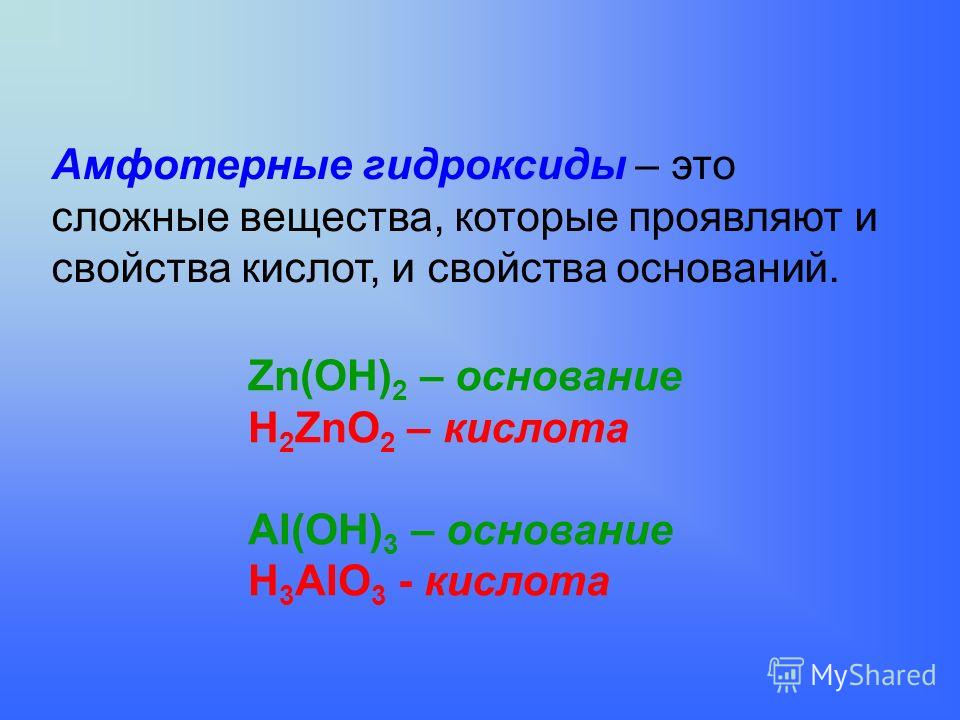 Как вы уже знаете, именно порядок чередования в полученной
полипептидной цепи исходных аминокислот обусловливает первичную структуру
белковой молекулы.
Как вы уже знаете, именно порядок чередования в полученной
полипептидной цепи исходных аминокислот обусловливает первичную структуру
белковой молекулы.
В результате подобной реакции из аминокислот с концевым (почему?) расположением групп —NH2 и —СООН получают полиамиды, например:
3. Комплексные соединения
Это соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
В переводе с латинского complexus – «сочетание»
В 1863 г. Швейцарский химик Вернер разработал координационную теорию, в основу которой легли представления о пространственном строении веществ.
Строение комплексных соединений.
В центре находится атом или ион –
комплексообразователь, а вокруг него – атомы, молекулы или ионы, образовавшие с
ним ковалентные связи по донорно-акцепторному механизму – лиганды. Ими могут
быть анионы кислот, некоторые молекулы небольшого размера (Н2О), имеющие атомы
с неподелёнными электронными парами.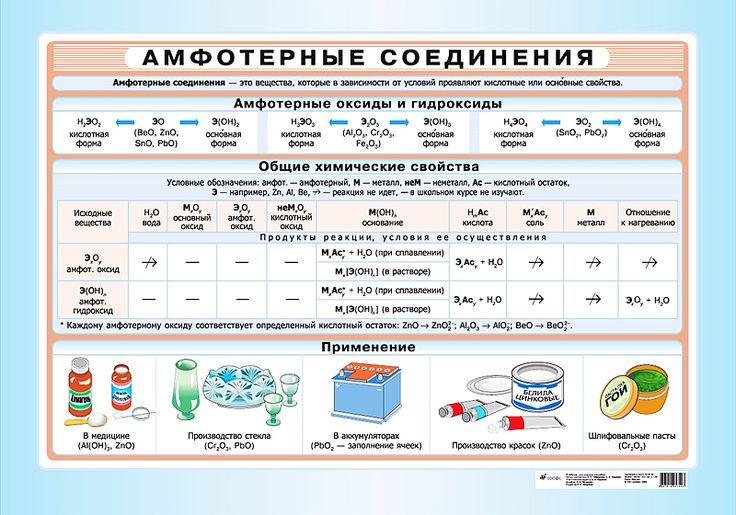
Общее число лигандов, связанных с центральным атомом, называется координационным числом. Известны комплексные соединения с координационным числом от 1 до 12 (чаще 4 и 6).
Лиганды вместе с центральным атомом образуют внутреннюю сферу. Внутреннюю сферу заключают в квадратные скобки.
Вокруг внутренней сферы образуется ещё и внешняя сфера – из ионов, не связанных непосредственно с комплексообразователем.
Na2[Zn(OH)4] – тетрогидроксоцинкат натрия
Значение комплексных соединений.
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.
Широкое применение комплексные соединения получили в аналитической химии в качестве индикаторов.
Многие КС обладают каталитической активностью, поэтому их широко используют в неорганическом и органическом синтезах.
Таким образом, с использованием комплексных соединений
связана возможность получения многообразных химических продуктов: лаков,
красок, металлов, фотоматериалов, катализаторов, надёжных средств для
переработки и консервирования пищи и т. д.
д.
Комплексные соединения цианидов имеют важное значение в гальванопластике, так как из обычной соли бывает невозможно получить настолько прочное покрытие как при использовании комплексов.
Приложение 1
Контроль знаний по предыдущей теме
1. Контрольные вопросы:
1) Что такое основания? Дайте определение понятию с трёх точек зрения.
2) На какие классы делят основания? Приведите примеры.
3) Охарактеризуйте химические свойства оснований, приведите примеры химических реакций.
Критерии оценки за устный опрос (контрольные вопросы):
Оценка «5» ставится, если
обучающийся: показывает глубокое и полное знание и понимание материала; полное
понимание сущности рассматриваемых понятий, явлений и закономерностей, теорий,
взаимосвязей; умеет составить полный и правильный ответ; правильно и обстоятельно
отвечает на дополнительные вопросы; допускает не более одного недочёта, который
легко исправляет.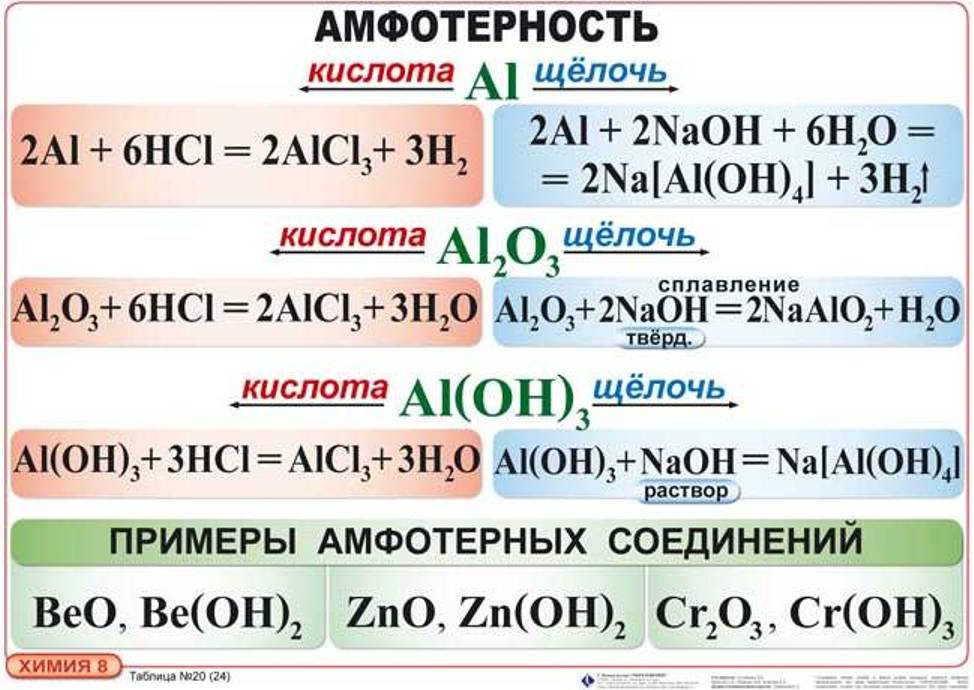
Оценка «4» ставится, если обучающийся: показывает знание всего изученного материала; даёт полный и правильный ответ; допускает незначительные ошибки и недочёты; небольшие неточности в формулировке понятий; материал излагает в логической последовательности, допуская негрубую ошибку или два недочёта, которые может исправить.
Оценка «3» ставится, если обучающийся: излагает материал фрагментарно; не всегда последовательно, допускает ошибки при формулировке выводов, ошибки при определении понятий; отвечает неполно на вопросы преподавателя.
Оценка «2» ставится, если обучающийся: не раскрывает основное содержание материала; не делает выводов и обобщений; допускает более двух грубых ошибок, которые не может исправить даже при помощи преподавателя.
2. Допишите уравнения реакций до конца:
1) KOH + HNO3 →
2) KOH + SO2→
3) NaOH + FeSO4→
4) NaOH + Zn(OH)2→
5) Cu(OH)2 + HCl→
6) Fe(OH)3→(t°C)→
Эталон ответа:
1) KOH + HNO3 →KNO3 + H2O
2) 2KOH + SO2→K2SO3 + H2O
3)2NaOH + FeSO4→Fe(OH)2 +Na2SO4
4) 2NaOH + Zn(OH)2→Na2ZnO2 + 2H2O
5) Cu(OH)2 + 2HCl→CuCl2 + 2H2O
6) 2Fe(OH)3→(t°C) Fe2O3 + 3H2O
Критерии оценок:
Оценка «5»: задание выполнено без ошибок
Оценка «4»: допущено 2 ошибки
Оценка «3»: допущено 3-4 ошибки
Оценка «2»: допущено более 4 ошибок
Приложение 2
Задания для закрепления и систематизации знаний
1. Ответьте на вопросы:
Ответьте на вопросы:
1) Какие вещества называют амфотерными соединениями?
(Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, т. е. проявлять основные свойства)
2) Приведите примеры химических элементов, образующих амфотерные соединения
(Al, Zn, Be, Cr (III), Fe (III))
3) C какими веществами взаимодействую амфотерные соединения?
(с сильными кислотами, со щелочами)
4) Какие вещества называются комплексными соединениями?
(Это соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму)
5) Как называются группы атомов, ионов, молекул, связанные с центральным атомом ковалентными связями?
(Лиганды)
За каждый правильный ответ – 1 балл (максимально – 5 баллов).
2. Выполните задание:
Допишите до конца уравнения реакций:
1) Zn(OH)2 + HCl →
2) Zn(OH)2 + KOH→
Эталон ответа:
1) Zn(OH)2 + 2HCl →ZnCl2 + 2H2O
2) Zn(OH)2 + 2KOH→K2ZnO2 + 2H2O
За
каждый правильный ответ – 1 балл (максимально – 2 балла).
Приложение 3
Предварительный контроль новых знаний
Вставьте пропущенные слова:
1) Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять …………свойства, так и их акцепторами, т. е. проявлять ………….свойства.
2) Амфотерные соединения взаимодействуя с сильными кислотами, обнаруживают ………….свойства.
3) Амфотерные соединения взаимодействуя со щелочами, обнаруживают ………….свойства.
4) Комплексные соединения — это соединения, в которых хотя бы одна …………….связь образовалась по донорно-акцепторному механизму.
5) Молекулы или ионы, связанные с центральным атомом, образующие с ним ковалентные связи по донорно-акцепторному механизму, называют — …………..
6) Лиганды вместе с центральным атомом образуют ……….сферу, которую заключают в квадратные скобки.
7) За пределами квадратных скобок находятся ионы,
образующие ………. сферу.
сферу.
Эталон ответа:
1) Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, т. е. проявлять основные свойства.
2) Амфотерные соединения взаимодействуя с сильными кислотами, обнаруживают основные свойства.
3) Амфотерные соединения взаимодействуя со щелочами, обнаруживают кислотные свойства.
4) Комплексные соединения — это соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
5) Молекулы или ионы, связанные с центральным атомом, образующие с ним ковалентные связи по донорно-акцепторному механизму, называют – лиганды.
6) Лиганды вместе с центральным атомом образуют внутреннюю сферу, которую заключают в квадратные скобки.
7) За пределами квадратных
скобок находятся ионы, образующие внешнюю сферу.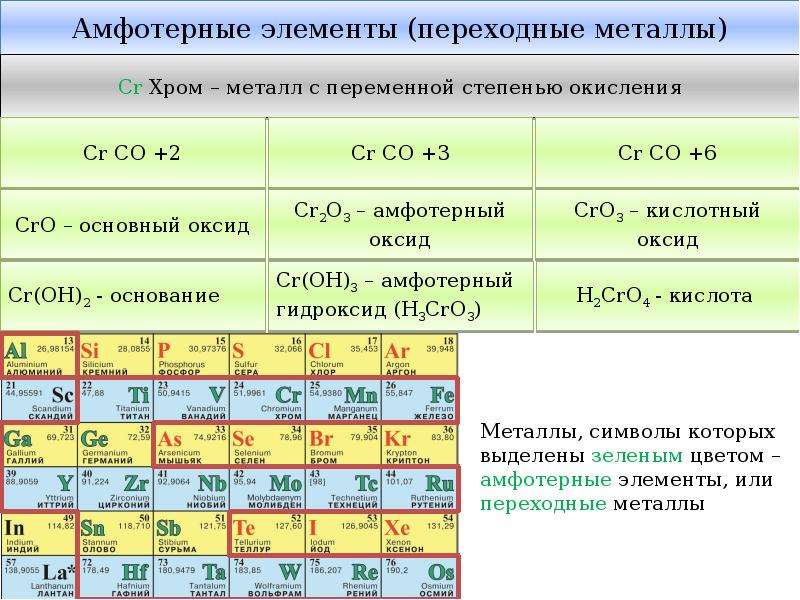
За каждый правильный ответ – 1 балл (максимально – 7 баллов)
Критерии оценок за работу по новой теме
Оценка «5»: обучающийся набирает 10 баллов
Оценка «4»: обучающийся набирает 7-9 баллов
Оценка «3»: обучающийся набирает 6 баллов (ставится по желанию)
Приложение 4
Задание для самостоятельной внеаудиторной работы студентов
Изучите текст учебника [2,§31], выполните упражнение 8
Эталоны ответов:
Упр. 3
Cr(OH)3 + 3HCl→CrCl3 +3H2O
Cr(OH)3 + KOH→KCrO2 +2H2O
Упр. 4
Алюминий реагирует со щелочами, поэтому щёлочи нельзя хранить в алюминиевой посуде:
2Al + 6KOH + 6H2O →2K3[Al(OH)6] + 3H2
Критерии оценок:
Оценка «5»: задание выполнено без ошибок
Оценка «4»: допущена 1 ошибка
Оценка «3»: допущено 2 ошибки
Оценка «2»: задание не выполнено
Список использованных источников
1. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С.
Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е
изд., стереотип. – М.: Дрофа, 2017. – 368 с.
Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С.
Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е
изд., стереотип. – М.: Дрофа, 2017. – 368 с.
2. Горячева И.Ю., Бурмистрова Н.А..Химия. 11 класс Проверочные работы [Текст]: пособие для учителя / под ред. С.В. Лихобаба. – Саратов: Лицей, 2005. – 64 с.
3. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
Амфотерные органические и неорганические соединения
Амфотэрность с греческого означает и тот, и другой. Их двойственность выражается в том, что они могут проявлять и основные, и кислотные свойства.
Амфотэрными называются
соединения, которые в зависимости от условий могут проявлять и кислотные, и
основные свойства.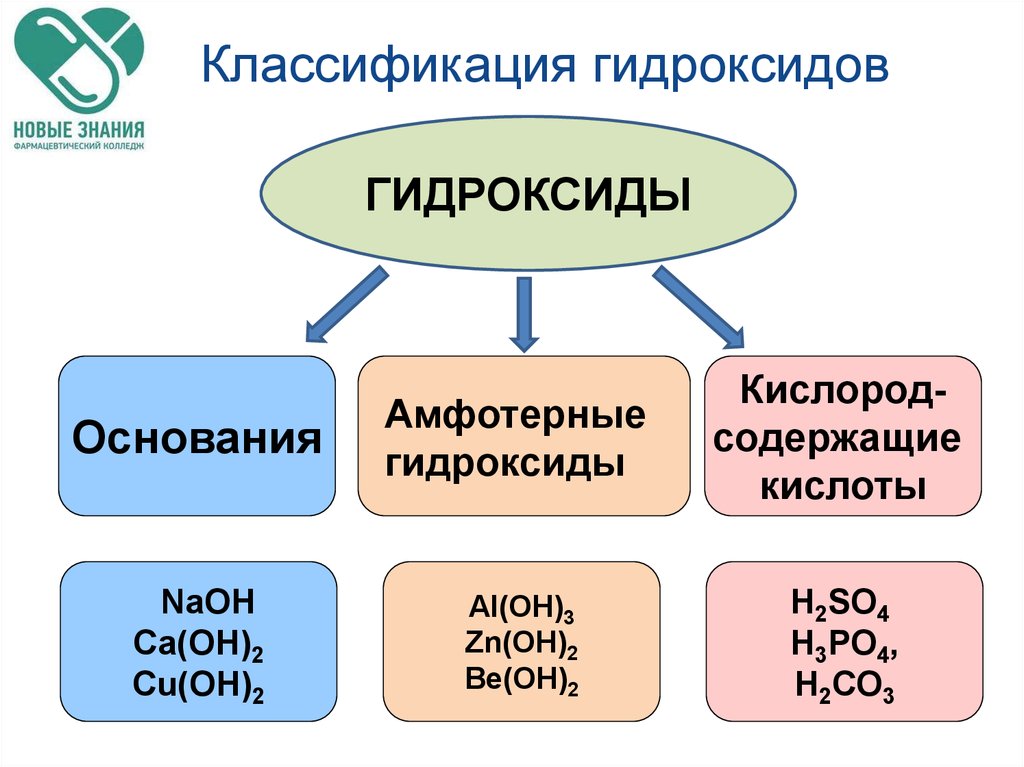
Среди неорганических веществ амфотэрными являются оксиды и гидроксиды пэ-элементов. Например: оксиды и гидроксиды цинка, алюминия, бериллия и других элементов, а также оксиды и гидроксиды некоторых дэ-элементов.
Амфотэрные соединения в реакции с кислотой ведут себя как основания, в реакции с основания выступают в роли кислот.
С точки зрения теории электролитической диссоциации кислоты – это электролиты, при диссоциации которых в качестве катионов образуются катионы водорода. Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Рассмотрим изменение кислотно-основных свойств гидроксидов.
Для примера возьмём строение гидроксида натрия, гидроксида алюминия и серной кислоты.
У этих гидроксидов будет по-разному разрываться связь. В гидроксиде натрия связь натрий-кислород полярнее, чем между кислородом и водородом.
Поэтому гидроксид
натрия будет диссоциировать на ионы натрия и гидроксид-ионы. В серной кислоте
атомы водорода и кислорода значительно отличаются по электроотрицательности,
чем между серой и кислородом. Поэтому серная кислота диссоциирует с
образованием катионов водорода и сульфат-ионов.
В серной кислоте
атомы водорода и кислорода значительно отличаются по электроотрицательности,
чем между серой и кислородом. Поэтому серная кислота диссоциирует с
образованием катионов водорода и сульфат-ионов.
Таким образом, в периодах с увеличением порядкового номера происходит ослабление основных свойств и усиление кислотных свойств гидроксидов.
Рассмотрим свойства бескислородных соединений.
Вспомним, согласно протолитической теории, кислоты – это вещества, группы атомов или ионы, которые являются в данной реакции донорами катионов, то есть отдают катионы водорода.
Основания – это вещества, группы атомов или ионы, которые являются акцэпторами катионов, то есть принимают протоны водорода.
Например, рассмотрим водородные соединения неметаллов: аммиака, воды и фтороводорода.
У атома азота в
аммиаке одна неподелённая пара электронов, у кислорода в молекуле воды – две неподелённые
пары, а у фтора во фтороводороде – три.
В этих молекулах есть неподелённые пары электронов, что позволяет им быть акцэпторами катионов водорода и проявлять основные свойства. Но в молекулах веществ есть и неметаллы – атомы водорода. При отрыве атомов водорода, соединение может быть донором катионов водорода, то есть проявлять кислотные свойства.
Например, в реакции аммиака с водой, катион водорода отделяется от воды, потому что связь между кислородом и водородом более полярная, чем между азотом и водородом, так как разница в электроорицательности кислорода и водорода больше, чем между азотом и водородом.
Этот катион водорода присоединяется к аммиаку. То есть вода здесь проявляет кислотные свойства, а аммиак – основные.
В реакции
фтороводорода с водой от фтороводорода отделяется катион водорода, а вода тем
самым является акцэптором катионов водорода, потому что связь между водородом и
фтором более полярная, чем между кислородом и водородом, фтороводород является
кислотой, а вода – основанием.
Поэтому в ряду от аммиака до фтороводорода идёт увеличение порядкового номера неметалла, основные свойства ослабевают, а идёт усиление кислотных свойств.
Таким образом, вода является амфотэрным соединением: с аммиаком вода выступает донором катионов водорода, то есть является кислотой, а в реакции с фтороводородом она будет акцэптором катионов водорода, то есть является основанием.
Амфотэрные соединения реагируют с кислотами и щелочами.
Так, в реакции с кислотами амфотэрные оксиды и гидроксиды ведут себя, как основания.
В реакции гидроксида цинка с соляной кислотой образуется соль – хлорид цинка и вода.
В реакции оксида цинка с соляной кислотой образуется соль – хлорид цинка и вода.
В реакциях с
основаниями амфотэрные соединения ведут себя, как кислоты. Так, в реакции
гидроксида цинка с гидроксидом натрия образуется тэтра-гидроксо-цинкат натрия,
в реакции оксида цинка с гидроксидом натрия образуется соль –
тэтра-гидроксо-цинкат натрия.
Аминокислоты являются амфотэрными органическими соединениями. В аминокислотах есть две функциональные группы: аминогруппа и карбоксильная группа.
Эти группы отличаются по свойствам. Так, аминогруппа является акцэптором катионов водорода, так как содержит азот, имеющий неподелённую пару электронов. Аминогруппа обуславливает основные свойства. Карбоксильная группа имеет сильно полярную кислород-водородную связь, поэтому является донором катионов водорода. Карбоксильная группа обуславливает кислотные свойства аминокислот.
Амфотэрные свойства аминокислот связаны с тем, что они являются бифункциональными соединениями. Аминокислота присоединяет протон водорода, который образуется при диссоциации кислоты.
При взаимодействии аминокислоты с гидроксидом натрия она проявляет кислотные свойства, так как взаимодействие происходит в карбоксильной группе.
Аминокислоты реагируют
со спиртами по реакции этэрификации с образованием сложных эфиров. При чём, от кислоты
отщепляется о-аш группа, а от спирта – атом водорода.
При чём, от кислоты
отщепляется о-аш группа, а от спирта – атом водорода.
В аминокислотах возможно внутримолекулярное взаимодействие из-за наличия двух функциональных групп. Ион водорода, который образуется при диссоциации в карбоксильной группе, присоединяется к аминогруппе и образуется диполярный ион, как бы внутренняя соль, поэтому аминокислоты проявляют амфотэрные свойства.
Аминокислоты также реагируют друг с другом по реакции кондэнсации.
Благодаря этой реакции в рибосомах происходит биосинтез белка. В промышленности таким образом получают синтетические волокна, например, капрон.
Таким образом, к амфотэрным соединениям относятся соединения, которые могут реагировать и с кислотами, и с основаниями. Неорганическими амфотэрными соединениями являются оксиды и гидроксиды некоторых пэ- и дэ-элементов. Органическими амфотэрными соединениями являются аминокислоты.
Амфотеризм | химия | Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Britannica Beyond
Мы создали новое место, где вопросы находятся в центре обучения. Вперед, продолжать. Просить. Мы не будем возражать. - Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полёта на Луну до управления космосом — мы изучаем широкий спектр тем, которые подпитывают наше любопытство к космосу!
Содержание
- Введение
Краткие факты
- Связанный контент
Амфотеризм | Факты, сводка и определение
Ищете примечания к пересмотру, относящиеся к экзаменационной комиссии, которую вы изучаете? Если это так, щелкните ссылки ниже, чтобы просмотреть наши сжатые, простые для понимания примечания к пересмотру для каждой экзаменационной комиссии, буклеты с практическими экзаменационными вопросами, наглядные пособия по картам памяти, интерактивные викторины, презентации PowerPoint и библиотеку прошлых работ непосредственно с экзаменационных комиссий.
- Амфотерная молекула – это молекула, которая может действовать как основание, так и кислота
- Все амфотерные молекулы содержат атом водорода
- Вода, аминокислоты, ионы гидрокарбоната и ионы гидросульфата являются амфотерными
Что такое амфотеризм?
Амфотерная молекула представляет собой молекулу, которая может действовать как основание и как кислота . Оно происходит от греческого слова «амфотерой», что означает «оба». Химические вещества, участвующие в реакции, определяют, будет ли амфотерная молекула действовать как основание или кислота.
Поскольку все амфотерные соединения должны отдавать протон, все они содержат атома водорода . Некоторыми примерами являются вода и аминокислоты.
Применяется к кислотам и основаниям в соответствии с теорией Бренстеда-Лоури и теорией Льюиса .
Вода как амфотерная молекула
Вода является одной из наиболее известных амфотерных молекул.
Если в реакцию вовлечено основание , такое как NH 3 , то вода может действовать как кислота . Это связано с тем, что вода отдает протон основанию и таким образом превращается в гидроксид-ион. Полное уравнение для этого показано ниже:
H 2 O + NH 3 → NH 4 + + OH —
реакция, то вода может выступать в качестве основания . Это связано с тем, что вода принимает протон от кислоты и таким образом превращается в ион гидроксония. Полное уравнение для этого показано ниже:
H 2 O + HCl → Cl — + H 3 O +
Вода как амфотерная молекула хорошо показана на изображении ниже.
Молекула воды может действовать как амфотерная молекула даже в образце чистой воды . Примерно 6 из 10 8 молекул воды вступают в следующую реакцию: (aq)
Эта реакция называется автоионизация . Это происходит в каждом растворе, независимо от того, чистый ли образец или он входит в состав раствора.
Это происходит в каждом растворе, независимо от того, чистый ли образец или он входит в состав раствора.
Аминокислоты в виде амфотерных молекул
Аминокислоты являются амфотерными соединениями. Это связано с тем, что они имеют кислотную группу ( COOH ) и основную группу ( NH 2 ) — это означает, что они могут реагировать со щелочами и кислотами с образованием солей.
Когда в растворах кислоты аминокислоты несут положительный заряд. Это означает, что в щелочном растворе аминокислоты несут отрицательный заряд . Таким образом, когда аминокислота растворяется в воде , она существует в форме, в которой она несет оба заряда , как на изображении выше. Это происходит потому, что карбоксильная группа диссоциирует с высвобождением протона, который переходит к аминогруппе.
Когда аминокислоты обладают положительным и отрицательным зарядом одновременно называется цвиттерионом . Эти цвиттер-ионы могут реагировать с основанием , высвобождая протон из аминогруппы — тогда он будет обладать общим отрицательным зарядом. Они также могут реагировать с кислотой , соединяясь с протоном кислоты — тогда он будет иметь общий положительный заряд. Обе эти цвиттерионные реакции обратимы . Структура цвиттер-иона показана ниже.
рН , при котором молекула аминокислоты имеет общий заряд нуля называется изоэлектрической точкой (ее также можно назвать изоэлектрическим рН).
Другие примеры амфотерных молекул
Вода, аминокислоты, ионы гидрокарбоната и ионы гидросульфата являются амфотерными веществами.
Многие оксиды и гидроксиды металлов и металлоидов являются амфотерными, например алюминий, мышьяк, хром, кобальт, медь, золото, железо, свинец, серебро, олово и цинк.

 3,4]
3,4]
