Химические свойства металлов в таблице, общее применение (9 класс, химия)
4.4
Средняя оценка: 4.4
Всего получено оценок: 845.
4.4
Средняя оценка: 4.4
Всего получено оценок: 845.
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
Рис. 1. Изменение металлических свойств в таблице Менделеева.Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.
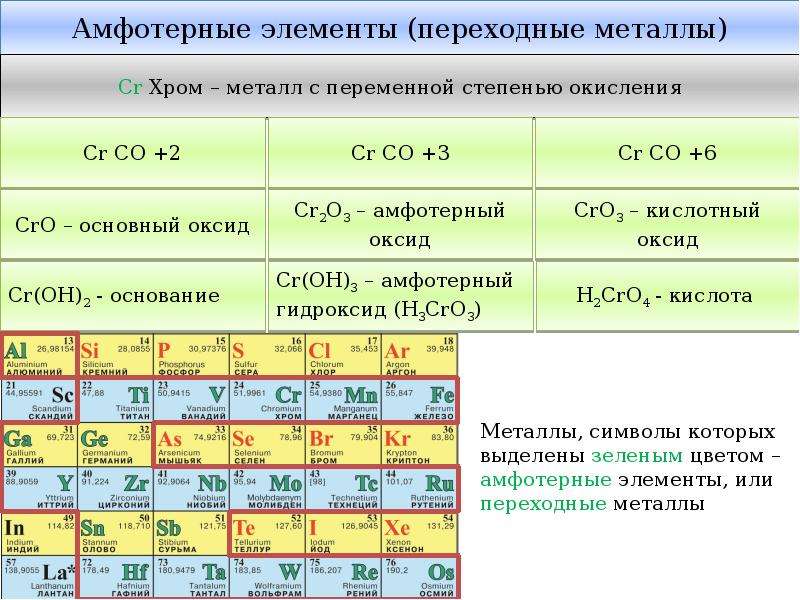
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция | Особенности | Уравнение |
С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина | – 4Li + O – 2Na + O2 → Na2O2; – K + O2 → KO2; – 4Al + 3O2 → 2Al2O3; – 2Cu + O2 → 2CuO |
С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. | – Sr + H2 → SrH2; – 2Na + H2 → 2NaH; – Mg + H2 → MgH2 |
С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании | – 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
С углеродом | Литий и натрий, остальные – при нагревании | – 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
С серой | Не взаимодействуют золото и платина | – 2K + S → K2S; – Fe + S → FeS; – Zn + S → ZnS |
С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
С водой | Щелочные и некоторые щелочноземельные металлы. | – 2Na + 2H2O → 2NaOH + H2↑; – Ca + 2H2O → Ca(OH)2 + H2; – Pb + H2O → PbO + H2↑ |
С кислотами | Металлы слева от водорода. Медь растворяется в концентрированных кислотах | – Zn + 2HCl → ZnCl2 + 2H2↑; – Fe + H2SO4 → FeSO4 + H2↑; – Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O |
Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu 3Au, 2Na + Sb → Na2Sb.
Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
Отрасль | Производство | Металлы |
Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
Ювелирная промышленность | Украшения | Au, Pt, Ag |
Медицина | Протезы | Ti, Ni, Au |
 3. Висмут.
3. Висмут.Что мы узнали?
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях. Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения. Металлы используются в медицине, промышленности, металлургии, электронике.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Валерия Олейник
10/10
Александр Котков
10/10
Лидия Маслова
10/10
Анна Богданова
10/10
Сергей Ефремов
7/10
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 845.
А какая ваша оценка?
Таблица Менделеева online — Переходные металлы
Переходные металлы (переходные элементы) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: (n — 1)dxnsy. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на (n − 1)d-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Таблица переходных металлов
| Группа → Период ↓ | III | IV | V | VI | VII | VIII | I | II | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | 21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
||||||||||||||||||||
| 5 | 39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
||||||||||||||||||||
| 6 | * | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
||||||||||||||||||||
| 7 | ** | Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|||||||||||||||
Общая характеристика группы
Все переходные элементы имеют следующие общие свойства:
- Небольшие значения электроотрицательности.

- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
| Формула соединения | Характер соединения |
|---|---|
| Mn(OH)2 | Основание средней силы |
| Mn(OH)3 | Слабое основание |
| Mn(OH)4 | Амфотерный гидроксид |
| H2MnO4 | Сильная кислота |
| HMnO4 | Очень сильная кислота |
- Для всех переходных элементов характерно образование комплексных соединений.

Классификация оксидов и периодические тенденции оксидов
Цели обучения
В этой статье автор объяснил, что такое оксиды, типы и классификация оксидов, а также изменения в периодической таблице.
ОксидыСодержание
Бинарные соединения кислорода с элементами периодической таблицы называются оксидами.
Определение оксидов
Примеры оксидов
NA 2 O, CAO, AL 2 O 3 , CO 2 , № 2 , CL 2 O 3 , из 2 ETC All.
Типы оксидовВ зависимости от кислотных свойств различают три типа оксидов.
- Основные оксиды
- Кислотные оксиды
- Амфотерные оксиды
Те оксиды, которые образуют основные оксиды в воде и в основном состоят из оснований.
Определение основных оксидов
Элементы группы I-A и группы II-A, кроме Be, и элементы группы II-A, кроме Zn, из основных оксидов.
Всякий раз, когда они растворяются в воде, они дают основания. С повышением металлического характера элементов вниз по группе оксиды элементов той же группы становятся все более и более основными. CO 2 и SiO 2 являются кислотными оксидами. GeO 2 и SnO 2 являются амфотерными оксидами, тогда как PbO 2 – основные оксиды.
Кислотные оксидыТе оксиды, которые при растворении в воде дают кислый раствор, известны как кислотные оксиды.
Определение кислотных оксидов
Оксиды углерода, азота и серы имеют кислотную природу. CO 2 , NO 2 , SO 2 являются кислотными оксидами.
Амфотерные оксидыТе оксиды, которые имеют как кислотные, так и основные свойства, называются амфотерными оксидами.
Определение амфотерных оксидов
Амоготерные оксиды ведут себя как кислоты по отношению к сильному основанию. Они действуют как основания по отношению к сильной кислоте.
Например:
ZnO реагирует с ионами H+ с образованием иона Zn +2 и ведет себя как основной оксид.
Реакция ZnO с серной кислотойZnO реагирует также с ионами OH –
Реакция ZnO с ионом гидроксила Изменение природы оксидов в периодической таблицеСуществует почти систематическая вариация кислотного и основного характера оксидов по группам и периодам периодической таблицы.
Следующая таблица дает представление о классификации оксидов на основе кислотно-основного характера.
Классификация оксидов по основаниям кислотно-основного характера Изменение природы оксидов в периоде При движении слева направо в периоде оксиды становятся все более и более кислыми по своей природе. Посмотрите на постепенное увеличение изменения характера оксидов третьего периода.
Посмотрите на постепенное увеличение изменения характера оксидов третьего периода.
| Group | I-A | II-A | III-A | IV-A | V-A | VI-A | VII-A |
| Oxides | Na 2 O | MgO | Al 2 O 3 | SiO 2 | P 2 O 5 | SO 3 | Cl 2 O 7 |
| Nature | Strongly basic | Basic | Amphoteric | Acidic | More acidic | Even more acidic | Strongly acidic |
When we move сверху вниз в группе; наблюдается увеличение оксидов основного характера. Посмотрите на оксиды элементов группы II-А. BeO наименее основный, а BaO максимально основный.
BeO наименее основный, а BaO максимально основный.
Группа II-A
Основной характер оксидов элементов группы II-A Степень окисления металла и ее влияние на природу оксидовНекоторые металлы имеют переменные степени окисления. Поэтому эти металлы дают различные оксиды. Это можно объяснить, сказав; чем больше степень окисления металла, тем сильнее кислотный характер оксидов.
Давайте посмотрим на оксиды марганца (Mn)
Оксиды марганца (Mn) Кислотный характер оксидов марганца в группе Оксиды азотаЭто пять оксидов азота, и их кислотная сила увеличивается с увеличением степени окисления азота.
Кислотный характер Оксиды азота в группе Оксиды серыПодобным образом, оксиды серы имеют те же тенденции, что и выше.
Кислотность оксидов серы в группахАмфотерные оксиды | Физика Валлах
Статьи по химии
Оксиды можно разделить на кислотные, основные, амфотерные и нейтральные. Амфотерные оксиды — это оксид, который может действовать как кислота или основание. Обычно оксиды неметаллов являются кислотными, а оксиды металлов — основными. Некоторые оксиды неметаллов нейтральны, а некоторые оксиды металлов или полуметаллов амфотерны. Есть несколько исключений из этих обобщений.
Амфотерные оксиды — это оксид, который может действовать как кислота или основание. Обычно оксиды неметаллов являются кислотными, а оксиды металлов — основными. Некоторые оксиды неметаллов нейтральны, а некоторые оксиды металлов или полуметаллов амфотерны. Есть несколько исключений из этих обобщений.
| Содержание |
|
Амфотерные оксиды — это оксиды, действующие как кислотные и основные оксиды. Он имеет свойства кислотного оксида, а также основных оксидов, которые нейтрализуют как кислоты, так и основания.
Амфотерные оксиды обычно растворяются в воде с образованием щелочных растворов. Щелочные растворы состоят из ионов гидроксида. Следовательно, оксид алюминия (Al 2 O 3 ) реагирует с соляной кислотой с образованием хлорида алюминия и воды. Раствор гидроксида натрия образует воду и алюминат натрия (NaAlO 2 ). Другие примеры амфотерных оксидов включают ZnO, SnO и PbO.
Идентификация амфотерных оксидов
Оксиды представляют собой соединения металлов или неметаллов с кислородом. Существует 4 типа оксидов. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием воды и солей. Амфотерные оксиды, среди многих других, включают оксид цинка и оксид свинца. Примеры включают аминокислоты и белки с классами аминов и карбоновых кислот и молекулы, которые могут самоионизироваться, такие как вода.
Амфотерные оксиды представляют собой соединения кислорода, проявляющие как кислотные, так и основные свойства. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это демонстрирует основные свойства соединений. Точно так же щелочь реагирует с образованием соли и воды, которая обладает кислотными свойствами. Пример: оксид алюминия.
Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это демонстрирует основные свойства соединений. Точно так же щелочь реагирует с образованием соли и воды, которая обладает кислотными свойствами. Пример: оксид алюминия.
Все оксиды могут быть образованы при нагревании элемента в кислороде. При взаимодействии водных растворов тригалогенидов металлов с гидроксидом получают оксиды в гидратированной форме. По нисходящей группе происходит переход от кислых оксидов к амфотерным к основным оксидам за счет усиления металлического характера соответствующих элементов.
Оксиды элементов 13 группы
| Оксиды | Свойства |
| В 2 О 3 | Слабокислотный |
| Ал 2 О 3 | Амфотерный |
| Га 2 О 3 | Амфотерный |
| В 2 О 3 | Слабое основание |
| Тл 2 О 3 | Основной, окислительный |
Примеры амфотерных оксидов
Термин «амфотерный» означает как кислоту, так и основание. Амфотерные оксиды обладают как кислотными, так и основными свойствами. Примерами являются оксиды алюминия и цинка. При взаимодействии с кислотами они образуют соли. Они также реагируют со щелочами с образованием комплексных солей.
Амфотерные оксиды обладают как кислотными, так и основными свойствами. Примерами являются оксиды алюминия и цинка. При взаимодействии с кислотами они образуют соли. Они также реагируют со щелочами с образованием комплексных солей.
Примеры:
ZnO(т) + 2HNO 3 (водн.) → Zn(NO 3 ) 2 (водн.) + H 2 O(л)
ZnO(s) + 2NaOH(aq) → Na 2 ZnO 2 (aq) + H 2 O(l)
Al 2 O 3 (т) + 6HCl(водн.) → 2AlCl 3 (водн.) + 3H 2 O(ж)
Al 2 O 3 (т) + 2NaOH(водн.) → 2NaAlO 2 (водн.) + H 2 O(ж)
И цинкаты, и алюминаты имеют окончание -ate, чтобы указать, что их ионы представляют собой комплексные ионы, содержащие кислород, подобно сульфатам, карбонатам и нитратам, что означает, что ионы ZnO 2 2-, а ионы алюмината — AlO 2-. Ионы записываются как Zn(OH) 4 2- и Al(OH) 4- . Обратите внимание, что цинкат и алюминат натрия растворимы в воде.
Ионы записываются как Zn(OH) 4 2- и Al(OH) 4- . Обратите внимание, что цинкат и алюминат натрия растворимы в воде.
Амфотерные оксиды в периодической таблице
В течение данного периода происходит переход оксидов от сильно основных, слабоосновных, амфотерных и слабокислых к сильнокислым, например, Na 2 O, MgO, Al 2 O 3 , P 4 O 10 , SO 3 и Cl 2 O 7 . Кислотность увеличивается с увеличением степени окисления, например, MnO < Mn 2 O 3 < Mn 2 O 7 .
Существует тенденция изменения кислотности оксидов в таблице Менделеева. В целом тренд периода основной → амфотерный → кислый. В следующей таблице показан тренд кислотности оксидов для периода 3.
| Нет 2 О | MgO | Ал 2 О 3 | SiO 2 | Р 4 О 18 | СО 2 | Кл 2 О 7 |
| Сильно основной | Базовый | Амфотерный | Слабокислотный | Кислотный | Кислотный | Сильнокислотный |
Основные оксиды находятся у основания групп I и II. Основность имеет тенденцию к увеличению в периодической группе. Для группы V кислотность оксидов NO 2 (кислая), P 2 O 3 (кислая) и As 2 O 3 (амфотерная). Sb 2 O 3 (амфотерный), Bi 2 O 3 (основной).
Основность имеет тенденцию к увеличению в периодической группе. Для группы V кислотность оксидов NO 2 (кислая), P 2 O 3 (кислая) и As 2 O 3 (амфотерная). Sb 2 O 3 (амфотерный), Bi 2 O 3 (основной).
В основных группах элементов основность оксидов возрастает с увеличением атомного номера в группе, например, BeO < MgO < CaO < SrO < BaO, хотя в более поздних группах переходных элементов наблюдается обратная тенденция.
Часто задаваемые вопросы (FAQ)
Q1. Как узнать, является ли оксид амфотерным?
Ответ. Вы можете сказать, что если оксид реагирует с кислотой и образует соль, или если оксид реагирует с основанием и образует соль, то вы можете сказать, что это амфотерный оксид.
Q2. Какие элементы образуют амфотерные оксиды?
Ответ. Такие металлы, как цинк, медь, олово, свинец, алюминий и бериллий, образуют амфотерные оксиды или гидроксиды.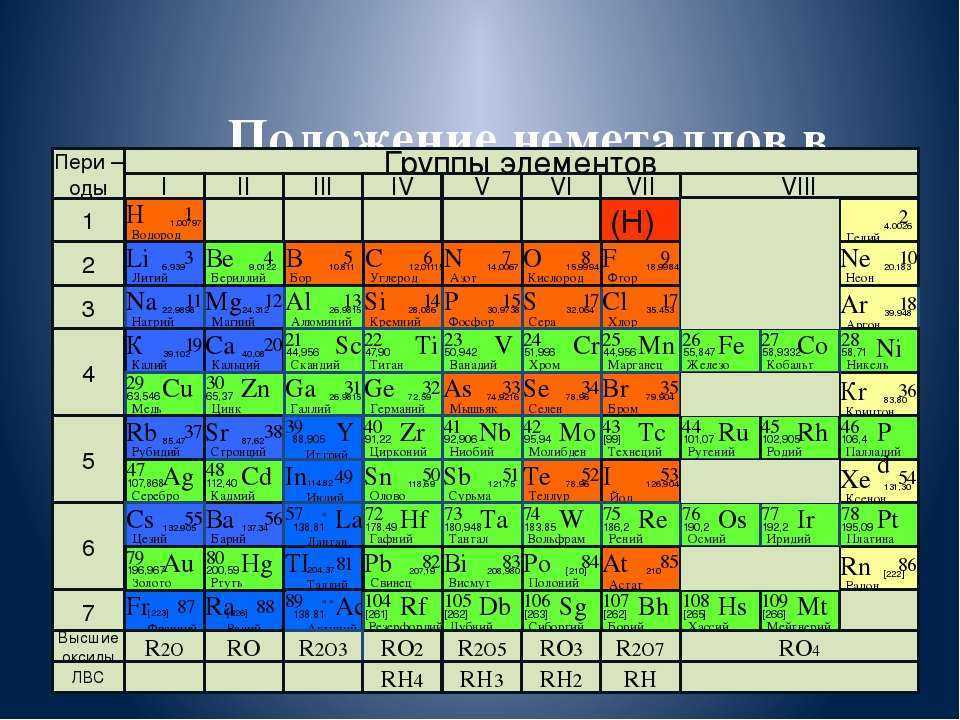

 Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление
Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности
При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности