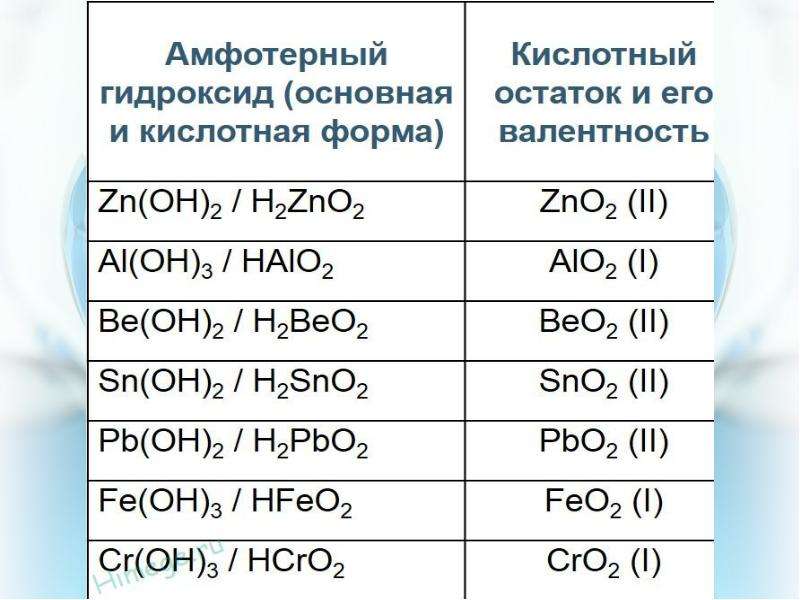
Амфотерные оксиды
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Переходные металлы 11 класс онлайн-подготовка на Ростелеком Лицей
Общие свойства переходных металлов
Переходные элементы располагаются в побочных подгруппах Периодической системы Д. И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны, но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения.
Переходные элементы – это металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Очень сильно видно различие в свойствах у элементов IV–VIII подгрупп периодической системы. Элементы побочных подгрупп – это металлы, а главных подгрупп – неметаллы. Однако, когда элементы главных и побочных подгрупп находятся в высших степенях окисления, их соединения проявляют заметное сходство.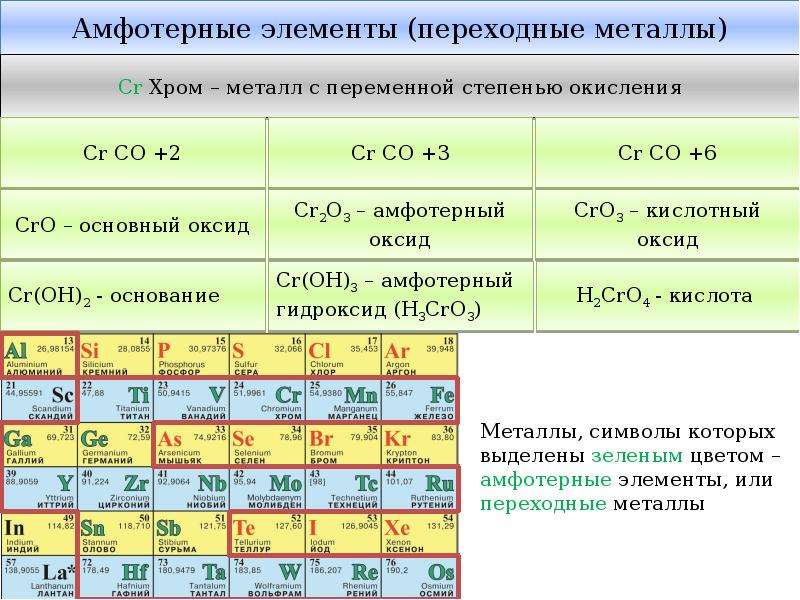
Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается (cм. Табл. 1). Химические свойства переходных элементов довольно сложны.
Табл. 1
Значение переходных металлов для организма и жизнедеятельности
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Рис. 1
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит (рис. 1). При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Химические свойства железа
Химические свойства железа и его соединений
Железо – это химический элемент №26, который находится в побочной подгруппе VIII группы, в четвертом периоде. Электронная конфигурация атома железа – 1s22s22p63s23p63d64s2.
Рис. 2
Распределение валентных электронов на орбиталях представлено на рис. 2.
Степени окисления железа: 0, +2, +3. Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды Fe2O3 и Fe(OH)3 проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
1. Взаимодействие с неметаллами
При нагревании железо, особенно порошкообразное, способно взаимодействовать практически со всеми неметаллами. Хлор и фтор окисляют железо до Fe+3. Бром может окислить и до Fe+2, и до Fe+3 в зависимости от количества, а йод окисляет только до степени окисления +2Fe+2. При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа.
Fe + S FeS
FeS + S FeS2 — природный минерал такого состава называется пирит (рис. 3).
Он используется для получения серной кислоты, а также железа и соединений железа.
Рис. 3
2. Взаимодействие железа с кислородом
При взаимодействии железа с кислородом, в зависимости от его количества, могут образовываться разные оксиды. В том числе и смешанный оксид Fe3O4.
2Fe + О2 2FeО
4Fe + 3О2 2Fe2О3
3Fe + 2О2 Fe3О4
3. Взаимодействие железа с водой
При сильном нагревании металлическое железо взаимодействует с водой.
3Fe + 4Н2О Fe3О4 + 4Н2↑
Во влажном воздухе при обычных условиях железо реагирует с парами воды и кислородом, с образованием ржавчины. Она состоит из смешенных оксидов, гидроксидов и соединений кислорода. Это не индивидуальное вещество.
Примерная схема ржавления железа:
4Fe + 6Н2О + 3О2 → 4Fe(ОН)3
4. Взаимодействие железа с кислотами
Как и другие типичные металлы, железо взаимодействует с кислотами-неокислителями с выделением водорода.
Fe + 2НCl → FeCl2 + Н2↑
С кислотами-окислителями железо не реагирует из-за пассивации. Но с разбавленными кислотами реакция происходит.
Fe + 4НNO3 → Fe(NO3)3 + NO↑ + 2Н2O
5. С растворами солей
Металлическое железо вытесняет менее активные металлы из растворов их солей.
Fe + CuSO4 → Cu + FeSO4
Амфотерные свойства железа
Железо и некоторые его соединения способны проявлять амфотерные свойства.
Fe + 2NaOH + 2H2O → Na2[Fe(OH)4] + H2↑ В горячем концентрированном растворе щелочи образуется комплексное соединение, и выделяется водород.
Соединения железа (II) и железа (III)
Соединения железа (II)
Соли железа (II) можно получить при взаимодействии металлического железа с кислотами-неокислителями или восстановлением железа (III).
2FeCl3 + Fe → 3FeCl2
Соединения железа (II) обладают восстановительными свойствами.
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl. На воздухе Fe(OH)2↓ окисляется кислородом.
4Fe(OH)2↓ + 2H2O + O2 → 4Fe(OH)3↓
Соединения железа (III)
Соли железа (III) получают либо окислением железа галогенами, либо при его взаимодействии с разбавленными кислотами-окислителями. Соли железа (III) могут проявлять слабые окислительные свойства.
2FeCl3 +2KI → 2FeCl2 + I2↓ + 2KCl. На этой реакции основан йодометрический способ определения солей железа.
Качественная реакция на соли железа (III)
FeCl3 + 6NaSCN → Na3[Fe(SCN)6] + 3NaCl. При взаимодействии с роданидами образуются ярко-красные, похожие на кровь комплексы различного состава.
Взаимодействие со щелочью.
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ как и Fe(OH)2↓ амфотерен, с преобладанием основных свойств.
Fe(OH)3↓ + 3HCl → FeCl3 + 3H2O
Fe(OH)3 + NaOH → NaFeO2 + 2H2O
Железная кислота и её соли
При окислении Fe(OH)3↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона:
2Fe(OH)3 + 3Cl2 + 10NaOH → 2Na2FeO4 + 6NaCl + 8H2O
Fe + 2KOH + 2H2O → K2FeO4 + 3H2↑
Железо имеет степень окисления +6. Такие соли называются ферраты: Na2FeO4, K2FeO4. Это соли не существующей в свободном виде железной кислоты Н2FeO4. Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
Подведение итога урока
В ходе урока вы изучили тему «Переходные металлы». Вы узнали о некоторых общих свойствах переходных металлов, о химических свойствах железа как наиболее важного переходного металла. Мы подчеркнули важность и необходимость для организма человека наличия именно переходных металлов. Рассмотрели некоторые примеры сплавов переходных металлов, исследовали амфотерные свойства железа и его соединений с различными степенями окисления. Немного узнали о железной кислоте и ее солях – ферратах.
Список литературы
- Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
- Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Габриелян О. С. Химия.
 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «internerurok.ru» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик.ру» (Источник)
Домашнее задание
- №№ 1, 5-б, в (с. 173) Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
- Что такое металлотермия? Приведите примеры.
- Какие свойства характерны для соединений железа (III)?
[Решено] Из приведенного здесь списка металлов номер
Из приведенного ниже списка металлов количество металлов, которые могут реагировать как с кислотами, так и с основаниями, составляет
а) Алюминий
б) Цинк
c) Бериллий
d) Железо
e) Кальций
Вариант 3: 3
Бесплатно
CT: Общие способности (пробный тест)
8,2 тыс. пользователей
пользователей
10 вопросов
10 баллов
10 минут
Правильный ответ — вариант 3, т. е. 3 .
- Цинк, алюминий и бериллий могут реагировать с как кислотами, так и основаниями .
- Эти металлы амфотерны .
- Амфотерное соединение может реагировать с как кислотой, так и основанием.
- Эти металлы обычно образуют амфотерные оксиды или гидроксиды.
- Цинк обычно встречается в виде оксида цинка, бериллий обычно встречается в виде оксида бериллия, а алюминий встречается как в виде оксида алюминия, так и в виде гидроксида алюминия.
| Имя | Символ | Атомный номер | "}»> Группа № |
| Алюминий | Ал | 13 | 13 |
| Цинк | Цинк | 30 | 12 |
| Бериллий | Быть | 4 | 2 |
| Железо | Fe | 26 | 8 |
| Кальций | Са | 20 | 2 |
Поделиться в WhatsApp
Последние обновления констебля полиции AP
Последнее обновление: 12 января 2023 г.
12 января 2023 года Комиссия по набору в полицию штата Андхра-Прадеш выпустила пропускную карточку полицейского констебля штата AP! В уведомлении констебля полиции AP 2022 общее количество вакансий – 6 100. Кандидаты, прошедшие 12-й проход, имеют право явиться на экзамен. Они могут проверить правильность применения пересмотренных критериев приемлемости. Выбор кандидатов зависит от предварительного экзамена, теста физических измерений (PMT), теста физической эффективности (PET), итогового экзамена и окончательного отбора. Отобранные кандидаты на должность констебля получат зарплату констебля полиции AP в диапазоне от рупий до 25,220 — 80,910.
кислотно-основное. Как узнать, является соединение амфотерным или нет?
спросил
Изменено 3 года, 7 месяцев назад
Просмотрено 3к раз
$\begingroup$
Мой учитель сказал мне, что если он реагирует с кислотой и основанием, то это соединение амфотерно.
Однако я не удовлетворен. Есть ли другой способ сказать? Например, нам дают соединение, скажем, BeO, как мы можем сказать, амфотерное оно или нет?
- кислотно-щелочной
$\endgroup$
3
$\begingroup$
Два правила, которые частично решают проблему:
1) Преимущественно ионные оксиды, такие как оксиды магния и более тяжелых щелочноземельных металлов, будут только основными в воде, хотя и слабо из-за ограниченной растворимости. Вам нужна значительная ковалентная связь металла с кислородом, чтобы заставить металл принимать дополнительные ионы гидроксида в сильных основаниях.
2) Обратите внимание, выше я сказал «металл». Неметаллы обычно образуют только кислотные ($\ce{CO2}, \ce{SO2}$) или инертные ($\ce{CO}, \ce{NO}$) оксиды. Вам нужен металл, чтобы оксид реагировал с водой или кислотой, как основание.
$\endgroup$
$\begingroup$
Извините, что говорю вам, но мнение вашего учителя неверно, просто потому, что слова «реагировать» недостаточно. Обычно вы называете оксиды «амфотерными». Вы можете сказать, что если оксид реагирует с кислотой и образует соль, или если оксид реагирует с основанием, образуя соль, то вы можете сказать, что это амфотерный оксид. Возьмем, к примеру, оксид алюминия: при растворении в HCl он образует хлорид алюминия, но мы также можем растворить его в NaOH, где он образует алюминат натрия.
Однако мы можем расширить это определение (хорошо для продвинутых классов). Одно формальное определение: «Химический вид, который ведет себя и как кислота, и как основание, называется амфотерным. Это свойство зависит от среды, в которой исследуется вид: h3SO4 является кислотой при исследовании в воде, но становится амфотерным в суперкислотах. »
См.: https://goldbook.