Действие щелочей на металлы
Щелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи.
Таким образом, реакция идет в две стадии:
в начало
Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Характерным химическим свойством металлов является их восстановительная способность. Они вступают в реакцию как с простыми веществами – неметаллами, так и со сложными веществами – водой, кислотой, щелочами и другими веществами.
Взаимодействие металлов с кислотами
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ АЗОТНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
Металл
взаимодействует с хлороводородной кислотой,
если энергия его ионизации меньше
энергии
ионизации
водорода, а таковыми являются активные
металлы, стоящие в ряду напряжений до
водорода. При растворении
в хлороводородной кислоте
активных металлов образуется соль этого
металла (хлорид) и выделяется водород.
В этом случае в качестве окислителя
выступает ион водорода (Н+)
кислоты, который оттягивает электрон
от атома восстановителя (металла).
При растворении
в хлороводородной кислоте
активных металлов образуется соль этого
металла (хлорид) и выделяется водород.
В этом случае в качестве окислителя
выступает ион водорода (Н+)
кислоты, который оттягивает электрон
от атома восстановителя (металла).
Можно рассчитать ЭДС этой реакции.
ЭДС = Еокис-ля
– Евос-ля = 0 – (-0,76) = 0,76 В.
Потенциалы находятся в ряду напряжений металлов.
в начало
Действие серной кислоты на металлы
Разбавленная
серная кислота растворяет
только активные металлы, т.е. реакции
идут аналогично реакциям
с хлороводородной кислотой.
В результате реакции образуется соль
металла (сульфат) и выделяется водород.
1 2 Fe0 —
2ē → Fe
1 2 2H+ + 2ē → H20 процесс восстановления Н+ — окислитель
Fe + 2H+ → Fe2+ + H2
ЭДС = 0 – (-0,44) = 0,44 В
Концентрированная
серная кислота растворяет
металлы, стоящие в ряду напряжений
металлов до серебра (включительно). Не
растворяется золото и платиновые
элементы (Рt, Os, Ru, Ir, Rh, Pd).
Окислителем в этом случае является сера со степенью окисления +6, которая в зависимости от активности металла и от условий (концентрация кислоты, температура) может восстанавливаться до серы +4, +0, -2. Таким образом, продуктами восстановления серы серной кислоты могут быть
Например: неактивные и малоактивные металлы (Cu, Ag, Fe, Ni) восстанавливают серу +6 до серы +4 (SO2). Реакция идет при нагревании.
Как видно из реакций, разбавленная серная кислота окисляет железо до +2, а концентрированная до +3.
Более активные металлы восстанавливают серу +6 до свободной серы (S0) и сероводородной кислоты (H2S), где сера имеет степень окисления -2.
в начало
Действие азотной кислоты на металлы
Азотная
кислота, являясь сильным окислителем,
действует почти на все металлы
(кроме Au, Pt, Ru, Rh, Ir, Os, Ta),
превращая их в нитраты, а некоторые –
в оксиды (пассивирование металлов).
Особенность действия азотной кислоты на металлы заключается в том, что она окисляет металлы без выделения водорода даже из разбавленного раствора кислоты, в отличие от серной. Глубина восстановления азота из азотной кислоты зависит от концентрации последней и от активности взаимодействующего с ней металла. Чем больше разбавлена кислота и чем активнее металл, тем глубже идет восстановление. Азот кислоты восстанавливается
ÜРазберем некоторые примеры взаимодействия азотной кислоты с металлами.
При взаимодействии концентрированной азотной кислоты с неактивными металлами выделяется NO2:
Разбавленная азотная кислота с малоактивными и неактивными металлами (Pb, Cu, Ni, Ag, Fe) образует NO:
Очень разбавленная азотная кислота восстанавливается до аммиака (NH3) при взаимодействии с очень активным металлом, образующим в кислой среде ион аммония NH4+:
Концентрированная кислота пассивирует некоторые металлы (Al, Cr, Fe), что выражается в покрытии металлов тонкой оксидной пленкой:
Поэтому
концентрированную азотную кислоту
перевозят в алюминиевых цистернах, а
разбавленную – в цистернах из кислотоупорной
стали.
Металлы способны вытеснять друг друга из растворов солей. Возможность прохождения таких реакций определяется положением металлов в ряду напряжений: более активные металлы вытесняют из растворов их солей менее активные.
Например:
Zn + CuSO4 → ZnSO4 + Cu.
в начало
Химические свойства простых веществ
Гурына Ира
Химия для 9 классаХимические свойства металлов
Металл + Кислород
С кислородом большинство металлов образует оксиды — амфотерные и основные:
- 4Li + O2= 2Li2O
- 4Al + 3O2 = 2Al2O3
Щелочные металлы, за исключением лития, образуют пероксиды:
- 2Na + O2 = Na2O2
Металл + галогены
С галогенами металлы образуют соли галогеноводородных кислот:
- Cu + Cl2 = CuCl2
Металл + Водород
С водородом самые активные металлы образуют ионные гидриды — солеподобные вещества, в которых водород имеет степень окисления -1.
- 2Na + h3 = 2NaH
Металл + Сера
С серой металлы образуют сульфиды — соли сероводородной кислоты
- Zn + S = ZnS
Металл + Азот
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании
- 3Mg + N2 = Mg3N2
Металл + Углерод
С углеродом образуются карбиды
- 4Al + 3C = Al3C4
Металл + Фосфор
С фосфором — фосфиды
- 3Ca + 2P = Ca3P2
Металл + вода
С водой — гидроксиды. Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода
- Са + 2Н2О = Са(ОН)2 + Н2
Химические свойства неметаллов
Взаимодействие с металлами. В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
- 2Na + Cl2 = 2NaCl
- Fe + S = FeS
- 6Li + N2 = 2Li3N
- 2Ca + O2 = 2CaO
Взаимодействие с другими неметаллами. Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды.
- 3h3 + N2 = 2Nh4
- h3 + Br2 = 2HBr
Взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства.
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
При взаимодействии с фтором фтор является окислителем, а кислород — восстановителем.
- 2F2 + O2 = 2OF2
Неметаллы взаимодействуют между собой: более электроотрицательный металл играет роль окислителя, менее электроотрицательный — роль восстановителя.
- S + 3F2 = SF6
- C + 2Cl2 = CCl4
Полезные ссылки
Источник материала
Поделиться Share Tweet
Что такое амфотерные металлы?.
 Опишите их реакцию на hot ca Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , пожалуйста, включите JS , чтобы это приложение заработало.
Опишите их реакцию на hot ca Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , пожалуйста, включите JS , чтобы это приложение заработало.Получение изображения.
More Related Question & Answers
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3.0k LIKES
3.0k VIEWS
1.5 K Акции
3,0K Like
3,0K Просмотр
1,5K Акции
3.0K Like
3,0K Просмотр
1,5K Акции
3,0K IMPLAY
3,01K Виды
3,0K.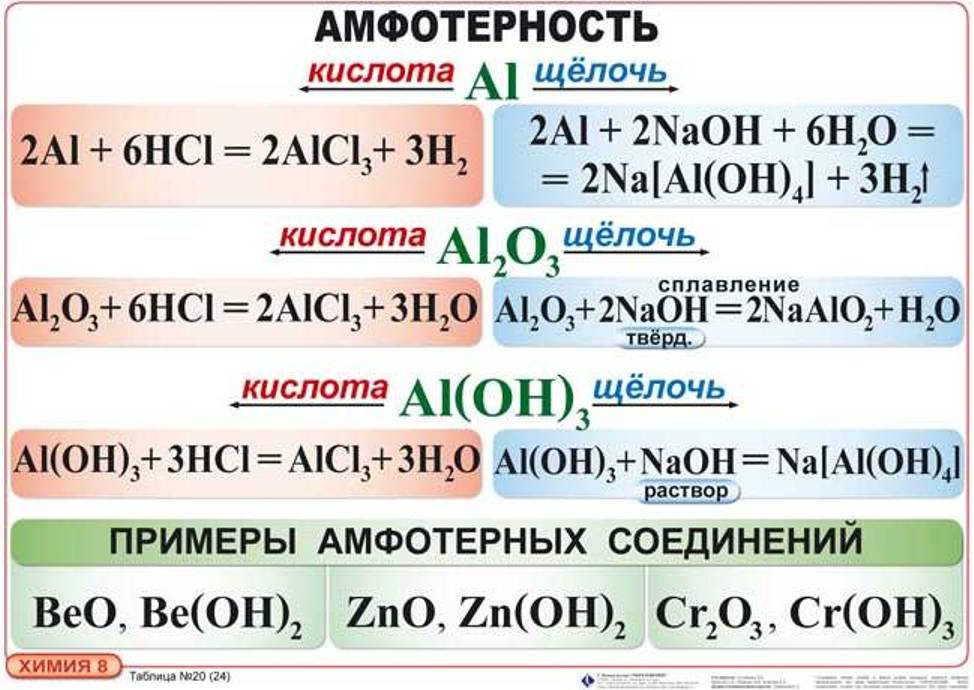 k НРАВИТСЯ
k НРАВИТСЯ
3,0K Просмотр
1,5K Акции
3,0K, как
3,0K Просмотр
1,5K Акции
3,0K нравятся
3,0K.
1.5K Шарес
1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K Like
3,0K Piews
1,5K Shares
3,0K Like
1,5K Shares
3,0K Like
9001K 3,000 3 900K.3.0k НРАВИТСЯ
3,0K Просмотр
1,5K Акции
3,0K нравятся
3,0K Просмотр
1,5K Акции
3,0K LIKE
3. 0K VIEW
0K VIEW
1,5K Акции
3,0K Like
3,0K Просмотры
1,5K Акции
3,0K любят
3,0K View
1,5K. , Doubtnut не владеет и не контролирует характер и содержание этих вопросов. Doubtnut не несет ответственности за какие-либо расхождения относительно дублирования контента по этим вопросам.
Все ли металлы реагируют с основанием? Если нет, то какие металлы реагируют и почему?
Последняя обновленная дата: 08 -й января 2023 г.
•
Всего просмотров: 171K
•
Просмотры сегодня: 1,71K
Ответ
Проверенный
171K+ просмотры
111111111111111111111.S. исходя из их химической природы. Металлы являются элементами-донорами электронов и поэтому имеют электроположительную природу. Их реакция с кислотами или основаниями зависит от их собственной склонности действовать как кислота или основание.
Полный ответ:
Металлы представляют собой электроположительные элементы, которые характеризуются своими физическими свойствами: блеском, ковкостью и пластичностью. Они являются хорошими проводниками тепла и электричества и, как правило, имеют жесткий характер. Большинство элементов, присутствующих в периодической таблице, имеют металлическую природу и занимают левые позиции. Химически металлы имеют тенденцию терять свои электроны и образовывать катионы.
Сами по себе металлы имеют очень слабую основу и склонны реагировать с кислотами, выделяя в ходе реакции газообразный водород. Металлы образуют соли, превращаясь в катионы и соединяясь с анионами, присутствующими в кислотах.
Металлы, будучи слабоосновными (из-за их электроположительной природы), не реагируют с основаниями. Но некоторые металлы по своей природе амфотерны и поэтому реагируют с основаниями с образованием комплексных солей (содержащих более одного типа катионов) и выделением газообразного водорода.
