Алюминий, свойства атома, химические и физические свойства
Алюминий, свойства атома, химические и физические свойства.
Поделиться в:
Al 13 Алюминий
26,9815386(8) 1s2 2s2 2p6 3s2 3p1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Атом и молекула алюминия. Формула алюминия. Строение алюминия
Цена на алюминий
Изотопы и модификации алюминия
Свойства алюминия (таблица): температура, плотность, давление и пр.
Физические свойства алюминия
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием
Получение алюминия
Применение алюминия
Таблица химических элементов Д.И. Менделеева
Атом и молекула алюминия.
 Формула алюминия. Строение алюминия:
Формула алюминия. Строение алюминия:Алюминий (лат. Aluminium, от лат. alumen – «квасцы») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Al и атомным номером 13. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), третьем периоде периодической системы.
Алюминий – амфотерный металл. Относится к группе лёгких, цветных металлов.
Алюминий обозначается символом Al.
Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
Молекула алюминия одноатомна.
Химическая формула алюминия Al.
Электронная конфигурация атома алюминия 1s2 2s2 2p6 3s2 3p1. Потенциал ионизации (первый электрон) атома алюминия равен 577,54 кДж/моль (5,985769(3) эВ). прием алюминия
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов. При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия (вычисленный) составляет 118 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Алюминий, свойства атома, химические и физические свойства
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| Общие сведения | ||
| 101 | Название | Алюминий |
| 102 | Прежнее название | |
| 103 | Латинское название | Aluminium |
| 104 | Английское название | Aluminium, Aluminum (в США и Канаде) |
| 105 | Символ | Al |
| 106 | Атомный номер (номер в таблице) | 13 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, лёгкий, цветной металл |
| 109 | Открыт | Ханс Кристиан Эрстед, Дания, 1825 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Мягкий, лёгкий и пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 8,1 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,005 % |
| 122 | Содержание в Солнце (по массе) | 0,006 % |
| 123 | Содержание в метеоритах (по массе) | 0,91 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 26,9815386(8) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p1 |
| 203 | Электронная оболочка | K2 L8 M3 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 118 пм |
| 205 | Эмпирический радиус атома* | 125 пм |
| 206 | Ковалентный радиус* | 121 пм |
| 207 | Радиус иона (кристаллический) | Al3+ 53 (4) пм, 67,5 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 184 пм |
| 209 | Электроны, Протоны, Нейтроны | 13 электронов, 13 протонов, 14 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 13-ая группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,61 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 577,54 кДж/моль (5,985769(3) эВ) |
| 305 | Электродный потенциал | Al3+ + 3e– → Al, Eo = -1,663 В |
| 306 | Энергия сродства атома к электрону | 41,762(5) кДж/моль (0,43283(5) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 2,70 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 2,375 г/см3 (при температуре плавления 660,32 °C и иных стандартных условиях, состояние вещества – жидкость), 2,289 г/см3 (при 1000 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления* | 660,32 °C (933,47 K, 1220,58 °F) |
| 403 | Температура кипения* | 2470 °C (2743 K, 4478 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,71 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 284 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,903 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 24,20 Дж/(K·моль) |
| 411 | Молярный объём | 9,993 см³/моль |
| 412 | Теплопроводность | 237 Вт/(м·К) (при стандартных условиях), 237 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,050 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 394 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7429-90-5 |
Примечание:
205* Эмпирический радиус атома алюминия согласно [1] и [3] составляет 143 пм.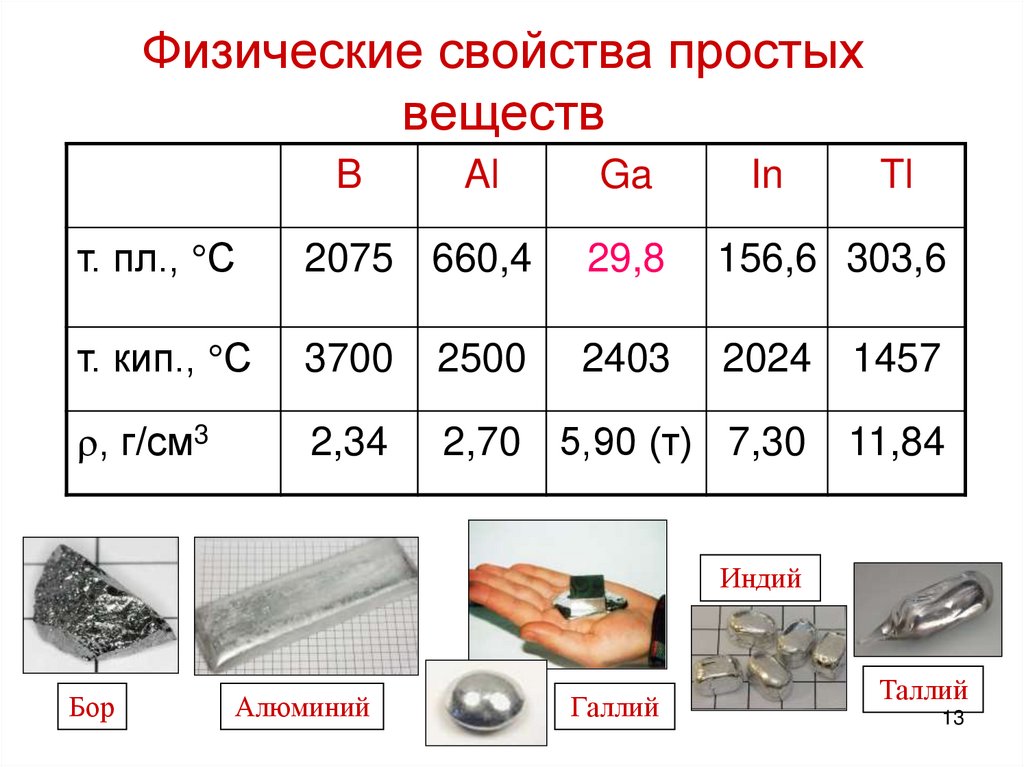
206* Ковалентный радиус алюминия согласно [1] и [3] составляет 121±4 пм.
401* Плотность алюминия согласно [3] и [4] составляет 2,6989 г/см 3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 2,699 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления алюминия согласно [3] составляет 660 °C (933,15 K, 1220 °F).
403* Температура кипения алюминия согласно [3] составляет 2518,82 °C ( 2792 K, 4565,88 °F).
407 * Удельная теплота плавления (энтальпия плавления ΔHпл) алюминия согласно [3] и [4] составляет 10,75 кДж/моль и 10,8 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) алюминия согласно [3] и [4] составляет 284,1 кДж/моль и 293 кДж/моль соответственно.
410* Молярная теплоёмкость алюминия согласно [3] составляет 24,20 Дж/(K·моль) и 24,35 Дж/(K·моль).
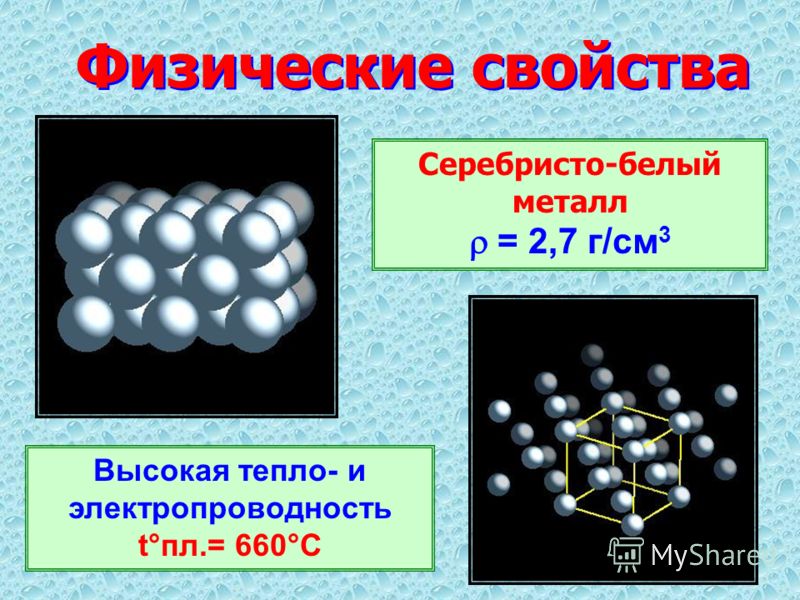
Физические свойства алюминия:
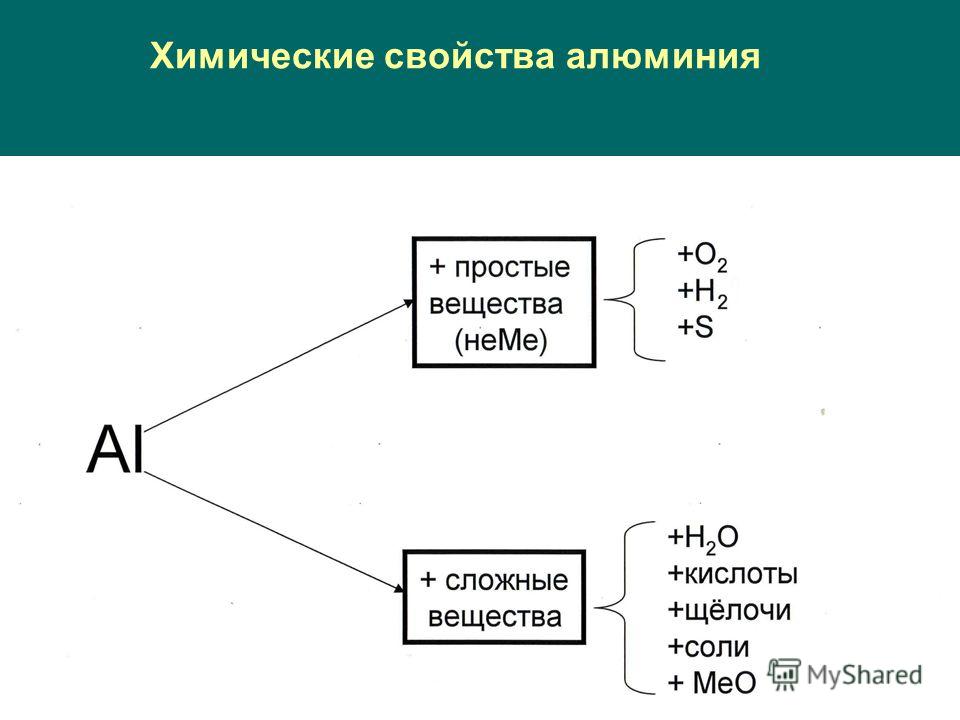
Химические свойства алюминия.
 Взаимодействие алюминия. Реакции с алюминием:
Взаимодействие алюминия. Реакции с алюминием:
Получение алюминия:
Применение алюминия:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.

- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Aluminium
- https://de.wikipedia.org/wiki/Aluminium
- https://ru.wikipedia.org/wiki/Алюминий
- http://chemister.
 ru/Database/properties.php?dbid=1&id=222
ru/Database/properties.php?dbid=1&id=222 - https://chemicalstudy.ru/alyuminiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
алюминий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле алюминия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 560
Алюминий: физические и химические свойства
Тема: «Алюминий: физические и химические свойства»
Учитель химии:
Леоненко Н. В.
В.
Урок изучения нового материала с мультимедийным сопровождением.
Цели:
• сформировать знания о физико-механических и химических свойствах алюминия на основе его положения в периодической системе, строения атома и кристалла;
• установить причинно-следственную связь между строением и свойствами при сравнении металлов I, II, III групп главных подгрупп;
• продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
• формировать навыки составления уравнений химических реакций с участием простых веществ;
• показать практическое значение химических знаний.
Оборудование: схема-кластер; видеоматериалы с демонстрационными опытами; презентация, компьютер, экран, проектор, наборы реактивов на столах (алюминиевая проволока, фольга, растворы соляной кислоты, гидроксида натрия).
Ход урока
Учитель: Из глины я обыкновенной,
Но я на редкость современный,
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока-
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я…………..(алюминием).
Сообщение темы и целей урока (запись темы в тетради)
Учитель: «Однажды
к древнеримскому императору Тиберию пришел ремесленник и принес чашу невиданной
красоты, изготовленную из серебристого и на удивление легкого металла. На
вопрос императора о названии чудесного металла ремесленник ответил, что металл
получен им из … глины и пока не имеет названия. Император, испугавшись, что
новый металл, который можно получать из обыкновенной глины, обесценит серебро и
подорвет могущество Рима, повелел чашу уничтожить, ремесленника обезглавить,
его мастерскую сравнять с землей!». Теперь, по прошествии тысячелетий, мы не
можем сказать, сколько правды лежит в основе этой легенды, рассказанной римским
историком Плинием Старшим в своей «Естественной истории», но значительная доля
правды в ней кроется. Действительно, алюминий-серебристо-белый, но в отличие от
серебра, на удивление легкий металл, который в принципе можно получить даже из
глины. Не случайно у нас в России в XIX столетии алюминий называли «глиний».
Не случайно у нас в России в XIX столетии алюминий называли «глиний».
Сегодня нам предстоит знакомство с алюминием как химическим элементом, так и простым веществом.
Обратите внимание: на ваших столах находятся схемы-кластеры. Именно по ним мы будем поэтапно изучать самый распространенный металл на земле.
Каждому ряду предлагается самостоятельная работа.
Самостоятельная работа.
1 ряд.
Дать характеристику элементу №13 по положению в периодической таблице.
2 ряд.
Указать состав ядра алюминия и строение электронной оболочки.
3 ряд.
Сопоставить строение атомов натрия, магния, алюминия и сделать вывод о химической активности этих металлов.
Ответы учащихся:
• Алюминий-металл, находится в 3 группе главной подгруппе, третьем малом периоде; порядковый номер-13, Аr(Аl)=27.
• Строение атома: Z(Аl)=13, е(Аl)=13, N(Аl)= Аr-Z= 27-13=14
Аl 1s2,2s2,2р6,3s2,3р1
Аl 1s2,2s2,2р6,3s1,3р2
Выводы: Степень
окисления: +3, следовательно, алюминий в реакциях будет восстановитель.
Тип химической связи: металлическая.
Тип кристаллической решетки: металлическая.
• Металлические свойства ярче выражены у кальция и еще сильнее у натрия по сравнению с алюминием, так как в ряду Na—Са—Аl число электронов на внешнем энергетическом уровне увеличивается, сила притяжения между ядром и электронами внешнего энергетического уровня увеличивается, атомный радиус уменьшается, энергия ионизации увеличивается, электроотрицательность увеличивается. Следовательно, химическая активность в ряду уменьшается.
Учитель: Но в электрохимическом ряду напряжения металлов алюминий расположен сразу после щелочноземельных металлов. Следовательно, можно предположить о его достаточной химической активности. Поэтому в природе алюминий в свободном виде не встречается. В природе алюминий встречается в виде:
— бокситов,
— каолина,
— нефелина и т. д. (Слайд- )
Месторождения алюминиевого сырья имеются на Урале, в Казахстане, Башкирии.
Учитель: Рассмотрев особенности химического элемента алюминия, перейдем к изучению простого вещества.
Лабораторная работа по теме:
«Физические свойства алюминия»
Инструктивная карта.
1. Рассмотрите алюминиевую проволоку и фольгу.
2. Определите агрегатное состояние вещества алюминия.
3. Какого цвета образцы металла?
4. Определите, имеет ли блеск металл?
5. Опустите кусочек проволоки в воду. Наблюдается ли растворение алюминия в воде?
6. Кратко запишите свои наблюдения согласно плану:
— агрегатное состояние,
— цвет,
— блеск,
— пластичность,
— растворимость в воде.
Дополнение учителя:
— легкий металл; плотность=2,7г/см3
— легкоплавкий металл: tпл.=660оС
— электропроводен (3-е место по электропроводности),
— алюминий в воде не растворяется, т.к. на его поверхности образуется оксидная пленка.
(Слайд-физические
свойства алюминия).
Учитель: Мы с вами выяснили, что в химических реакциях алюминий будет проявлять восстановительные свойства. С какими же веществами он должен взаимодействовать?
Учащиеся: Как с простыми, так и со сложными веществами.
Учитель: Записываем: Химические свойства алюминия.
I. Алюминий взаимодействует с простыми веществами- неметаллами.
Опыт: Сгорание порошка алюминия.
Горение бенгальской свечи.
Учитель: Пока горит бенгальская свеча, записываем уравнение химической реакции и разбираем его, как ОВР. 4Аl+3О2=2Аl2О3
Опыт: Взаимодействие алюминия с йодом: смешиваем порошок алюминия с йодом в соотношении 1:15, в середину смеси капаем две капли воды. Врезультате реакции образуется иодит алюминия и фиолетовые пары йода.
Учитель: Записываем уравнение реакции и разбираем его как ОВР.
2Аl+3I2=2АlI3
Видео: — взаимодействие алюминия с бромом;
— взаимодействие алюминия с серой.
Учитель: Записываем уравнения реакций и разбираем как ОВР.
2Аl+3Вr2=2АlВr3
2Аl+3S=Аl2S3
Учитель: Уравнения реакций взаимодействия алюминия с азотом, углеродом и фосфором записываем в молекулярном виде, а дома разбираем как ОВР.
2Аl+N2=2АlN(t800оС)
4Аl+3С=Аl4С3(t2000оС)
Аl+Р=АlР(t500оС)
II. Алюминий взаимодействует со сложными веществами.
Лабораторная работа по теме:
«Взаимодействие алюминия с кислотами и щелочами».
Инструктивная карта.
1. Возьмите две пробирки. В каждую положите по кусочку алюминия. Прилейте в одну из них 1-2 мл. раствора соляной кислоты, а в другую столько же раствора щелочи (NаОН). Что наблюдаете? Пробирки слегка нагрейте.
2. Запишите уравнения соответствующих реакций.
3. Сделайте выводы.
Учащиеся
записывают уравнения реакций на доске и разбирают их в свете ОВР.
2Аl+6HCl=2AlCl3+3h3
2Al+2NaOH+2h3O=2NaAlO2+3h3
Вывод: Алюминий проявляет амфотерные свойства, так как взаимодействует как с растворами кислот, так и с растворами щелочей.
Учитель: Для алюминия характерными являются реакции взаимодействия с солями, в состав которых входит менее активный металл: (Cлайд )
2АL+3СиSO4=Al2(SO4)3+3Cu,
а также алюминотермия- взаимодействие более активного металла с оксидом менее активного металла: 8Аl+ 3Fe3O4=9Fe+4Al2O3
Учитель: Алюминий взаимодействует с водой (без оксидной пленки):
2 Аl+6h3O=2Al(OH)3+3h3
Записанные уравнения реакций дома разобрать как окислительно-восстановительные.
Алюминий не реагирует с коцентрированными азотной и серной кислотами на холоде.
Учитель: Получение алюминия:
Из минералов в промышленности алюминий может быть получен в основном электролизом расплава:
2Аl2О3——4Аl+3О2
При получении алюминия используют также металлический натрий:
АlCl3+3Na=Al+3NaCl
(метод датского ученого Г. Эрстеда, впервые получившего алюминий).
Эрстеда, впервые получившего алюминий).
Опираясь на физические и химические свойства, а также получение, рассмотрим применение алюминия.
Учащий ся.
Применение алюминия и его сплавов во всех видах транспорта, а в особенности воздушного, привело к уменьшению собственной массы транспортных средств и к резкому увеличению эффективности их использования.
Авиаконструкции, моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и многие другие детали также изготавливают из алюминия и его сплавов.
Алюминий и его сплавы применяют также при отделки железнодорожных вагонов,
изготовлении корпусов и дымовых труб, спасательных лодок, радарных матч,
трапов.Активно используют алюминий и его сплавы в электротехнической
промышленности для изготовления кабелей, шинопроводов, конденсаторов,
выпрямителей переменного тока. В приборостроении алюминий и его сплавы
используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры. Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли
народного хозяйства, где бы не находил применение алюминий.
Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли
народного хозяйства, где бы не находил применение алюминий.
Закрепление.
Тест.
1
ряд.
1.Какова
электронная конфигурация атома алюминия?
А) 1s22s22p1 Б)1s22s22p3
B) 1s22s22p63s23p1 Г) 1s22s22p63s23p63d14s2
2. С
какими из указанных веществ реагирует алюминий?
А) СаО Б) HCl
B) Cl2 Г) NaOH
2
ряд.
1.
Какие из указанных металлов являются более активными, чем алюминий?
А) Na Б) Cu
B) Ca Г) Fe
2. Наиболее характерная степень окисления алюминия:
А) +1 Б) +2
В) +3 Г) +4
3 ряд.
1. Алюминий в химических реакциях проявляет свойства:
А) окислителя Б) инертного соединения
В) восстановителя Г) окислителя и восстановителя
2. В промышленности алюминий получают:
В промышленности алюминий получают:
А) используя в качестве восстановителя металлический натрий
Б) электролизом расплава оксида алюминия
В) используя в качестве восстановителя оксид углерода (П)
Г) электролизом раствора солей алюминия
• Правильные ответы:
1 ряд. | 1 ряд | 2 ряд | 2 ряд | 3 ряд | 3 ряд |
1 | 2 | 1 | 2 | 1 | 2 |
Выводы:
1. Алюминий- самый распространенный химический элемент- метал в земной коре.
Алюминий- самый распространенный химический элемент- метал в земной коре.
2. В химических реакциях алюминий является восстановителем, его степень окисления равна +3.
3. Алюминий- активный металл, взаимодействует как с простыми, так и со сложными веществами.
4. Алюминий- амфотерный металл, так как реагирует и с кислотами и со щелочами.
5. В промышленности алюминий получают электролизом расплава оксида алюминия.
Это интересно!!!
Металлический алюминий первым выделил в 1825 году датский химик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года Фридрих Велер усовершенствовал метод, заменив амальгаму калия чистым калием.
Домашнее задание: параграф 13, упр.2-5.
Типы химических
реакций.
Фрагмент урока: Проведение лабораторной работы по теме «Типы химических реакций».
Цели:
• сформировать знания об основных типах химических реакций, выполнив лабораторную работу и, закрепив имеющиеся знания на примере демонстрационного эксперимента;
• установить причинно-следственную связь между строением и свойствами веществ при определении типов химических реакций и составлении уравнений реакций;
• продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
• формировать навыки составления уравнений химических реакций с участием простых и сложных веществ;
• показать практическое значение химических знаний.
Оборудование: схема-кластер;
видеоматериалы с демонстрационными опытами; презентация, компьютер, экран,
проектор, наборы реактивов на столах (пероксид водорода, оксид марганца (IV),
лучинка, спички, цинк, раствор соляной кислоты, магниевая лента).
Методы: обучения— 1. эвристический,
• диалогический,
• программированный;
преподавания- 1. побуждающий,
• стимулирующий,
• инструктивный,
• объяснительный;
учения- 1. частично-поисковый,
• практический,
• репродуктивный.
Ход урока.
Актуализация знаний.
Дать определения реакциям соединения, замещения, разложения.
Предполагаемый ответ. Реакции соединения— это реакции, в результате которых из нескольких простых или сложных веществ
образуется одно более сложное вещество.
Реакции разложения— это реакции, в результате которых из одного сложного вещества образуется несколько простых или сложных веществ.
Реакции
замещения—
это реакции между простым и сложным веществами, в результате которых атомы
простого вещества замещают атомы в сложном веществе.
Лабораторная работа по теме «Типы химических реакций».
Задание 1.
В химический стакан налить пероксид водорода, далее добавить оксид марганца (IV) и внести в верхнюю часть стакана тлеющую лучинку. Что наблюдаете? Какой газ выделился? Написать уравнение реакции разложения пероксида водорода. Слить воду из стакана в пустую емкость, добавив к твердому остатку перосид водорода и внести тлеющую лучинку. Что наблюдаете? Сделайте вывод.
Задание 2.
В пробирку поместите таблетки цинка и прилейте раствор соляной или хлороводородной кислоты. Что наблюдаете? Запишите уравнение реакции. Сделайте вывод.
Задание 3.
Сожгите магниевую ленту. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Проверь свои знания по теме «Типы химических реакций».
Опыт
1.
В один цилиндр помещаем раствор аммиака, а в другой цилиндр немного
концентрированной соляной кислоты. Соединяем отверстия цилиндров и наблюдаем
появление «дыма»- хлорида аммония. Написать уравнение реакции. Вывод?
Соединяем отверстия цилиндров и наблюдаем
появление «дыма»- хлорида аммония. Написать уравнение реакции. Вывод?
Опыт 2. Взаимодействие натрия с водой. Что наблюдаете? Написать уравнение реакции. Вывод?
Опыт 3. Разложение перманганата калия. Что наблюдаете? Напишите уравнение реакции. Вывод?
Написать уравнения реакций.
Задания на экране.
Распределить предложенные уравнения реакций по типам:
соединения;
замещения;
разложения.
Выводы:
1. Химическая реакция- это процесс превращения исходных веществ в продукты реакции.
2. Уравнение реакции- это условная запись химической реакции.
3. Реакции классифицируются по исходным веществам и продуктам реакции на р. соединения, р. замещения и р. разложения; по тепловому эффекту: на экзотермические и эндотермические.
4. Все химические реакции находят большое применение в народном хозяйстве.
Домашнее задание: Параграф 29,30,31.
Блог — Superior Industries International, Inc.

Оглянитесь в любом автосалоне, и вы заметите, что большинство автомобилей, продаваемых в США, имеют диски из алюминиевого сплава или «диски», как их иногда называют. Когда-то довольно редкий вариант, легкосплавные диски имеют…
Подробнее…
Алюминиевые колесные диски, может быть непросто поддерживать в чистоте и блеске. Грязь и грязь накапливаются быстро; Ваш автомобиль собирает много грязи с дорог и тормозных колодок автомобиля. Конечно, можно…
Подробнее…
Автомобильные колеса подвергаются наибольшему воздействию на дороге, чем любая другая часть автомобиля. Столкновение с выбоинами, бордюрами и другими объектами может привести к повреждению сторон алюминиевых колес. Если эти повреждения устранить, они могут привести к тому, что колесо…
Столкновение с выбоинами, бордюрами и другими объектами может привести к повреждению сторон алюминиевых колес. Если эти повреждения устранить, они могут привести к тому, что колесо…
Подробнее…
Независимо от того, каким транспортным средством вы управляете и где бы вы ни находились, поддержание ваших колес в хорошем состоянии может быть непростой задачей. Более того, когда у вас алюминиевые колеса, требуется довольно много обслуживания для тех, кто хочет сохранить их…
Подробнее…
Целью очистки окисленных алюминиевых дисков является предотвращение точечной коррозии, которую трудно исправить или восстановить. Вам нужно немного потрудиться, чтобы изменить внешний вид колес. Этот метод очистки очень эффективен и надежен. Вещи, которые вам требуются: Несколько…
Этот метод очистки очень эффективен и надежен. Вещи, которые вам требуются: Несколько…
Подробнее…
Алюминиевые колеса в семь раз дороже, чем стальные. Только по этой причине легко понять, почему так много производителей автомобилей предпочитают производить свою продукцию со стальными колесами, а также почему так много людей заменят…
Подробнее…
Независимо от того, купили ли вы новую тачку и вам не нравятся заводские колеса, которые поставлялись с ней, или восстанавливаете стареющую красавицу, вам не нужно выкладывать сотни долларов за комплект совершенно новых алюминиевых колес. Можно восстановить…
Подробнее. ..
..
Алюминиевые диски могут сиять как хром, если их очистить и отполировать до совершенства. Поскольку алюминий является одним из самых мягких металлов, он хорошо поддается полировке. Если вы хотите, чтобы ваши алюминиевые диски были в хорошем состоянии, вам следует чистить и…
Подробнее…
Алюминиевые диски становятся все более популярными на легковых и грузовых автомобилях всех марок и моделей. На это есть ряд веских причин. Вот пять причин, по которым вам следует заменить эти стальные диски на алюминиевые. Коррозия…
Подробнее…
В настоящее время алюминий является вторым наиболее широко используемым металлом в мире после железа. Алюминий представляет собой пластичный металлический элемент серебристо-белого цвета. Это самый распространенный металлический элемент в земной коре, хотя в концентрированном виде он обычно не встречается…
Алюминий представляет собой пластичный металлический элемент серебристо-белого цвета. Это самый распространенный металлический элемент в земной коре, хотя в концентрированном виде он обычно не встречается…
Подробнее…
Прочнее и легче Алюминиевые или легкосплавные диски, изготовленные в основном из алюминия, определенно могут быть дороже по цене, чем другие варианты, но вы получаете что-то более прочное и легкое. Хотя вряд ли…
Подробнее…
Глядя на автомобили, вы часто видите различные типы колес — стальные, легкосплавные, алюминиевые и магниевые (сплав магния). В этой статье мы поговорим о плюсах и минусах последних двух. Конечно, есть ряд причин, по которым вы можете…
Конечно, есть ряд причин, по которым вы можете…
Подробнее…
Колеса многих транспортных средств, которые вы видите, изготовлены из литого алюминия, так как сплав в них легкий и прочный. Алюминиевые сплавы, используемые для колес, обычно содержат 97% алюминия. Второй металл добавляется для обеспечения долговечности, так как чистый алюминий слишком…
Подробнее…
Окружающая среда может быть острой проблемой, но это не значит, что люди хорошо понимают, как лучше защитить то, что их окружает. Ситуация усложняется тем, что компании могут отказываться от стандартов из-за того, что это может отразиться на их прибыли. …
Подробнее. ..
..
Мы добавили новые замечательные функции и обновили наш контент, чтобы предоставить вам самую свежую информацию о нашей компании. Чаще проверяйте наличие обновлений.
Подробнее…
Изменение свойств алюминия
Из-за своих уникальных свойств алюминий является одним из наиболее часто используемых металлов в промышленном секторе, а коммерческое производство этого металла началось в конце девятнадцатого века. Этот элемент встречается в своем естественном состоянии в сочетании с кислородом и другими элементами и является третьим по распространенности металлом в земной коре. Он легко обрабатывается и имеет структуру Face Centered Cubic (FCC), что делает его очень универсальным. Из-за своей низкой плотности и высокой теплопроводности алюминиевые сплавы являются жизнеспособной альтернативой ферромагнитным материалам в трибологических приложениях. Легирование, холодная обработка и термическая обработка могут использоваться для модификации микроструктуры алюминиевых сплавов, а также для улучшения механических характеристик сплавов. Настоящая работа в основном посвящена исследованию влияния изменения состава на характеристики износа и прочность на сжатие алюминиевого сплава Al6463, что было достигнуто путем изменения состава двух основных легирующих элементов, магния (Mg) и кремния (Si). ), в сплаве.
Легирование, холодная обработка и термическая обработка могут использоваться для модификации микроструктуры алюминиевых сплавов, а также для улучшения механических характеристик сплавов. Настоящая работа в основном посвящена исследованию влияния изменения состава на характеристики износа и прочность на сжатие алюминиевого сплава Al6463, что было достигнуто путем изменения состава двух основных легирующих элементов, магния (Mg) и кремния (Si). ), в сплаве.
Алюминий представляет собой металлоподобный элемент, обладающий как металлическими, так и неметаллическими характеристиками, относящийся к семействам бора и углерода. Он содержится в элементарных элементах боре и углероде. Несмотря на то, что алюминий является одним из самых распространенных материалов на планете, его необходимо получить из бокситовой руды и пройти производственный процесс, прежде чем его можно будет использовать для производства экономически чистого и жизнеспособного алюминия.
Нумерованный 4-значный ряд от 1xxx до 8xxx используется для классификации алюминия в зависимости от легирующих элементов, присутствующих в металле.
Медь, магний, марганец, кремний и цинк — это лишь некоторые из часто добавляемых элементов. Существуют сотни различных составов сплавов, которые можно изготовить из них.
Это влияет на внешний вид и возможность изготовления этих конкретных металлических композиций. По сравнению с чистым алюминием добавление элементов повышает прочность, обрабатываемость, коррозионную стойкость, электропроводность и плотность материала.
Физические свойства
Физические свойства алюминия связаны с его видимой формой и структурой до того, как он подвергся какой-либо химической модификации.
Физические свойства алюминия описаны ниже:
Цвет и состояние | Это твердое вещество, немагнитное, неблестящее, серебристо-белого цвета с небольшим голубоватым оттенком и немагнитное. |
Структура | Алюминий имеет гранецентрированную кубическую структуру, устойчивую до точки плавления, а также легкий вес. |
Поверхность | Алюминиевые поверхности могут иметь высокую отражательную способность. |
Твердость | Коммерчески чистый алюминий мягкий. При легировании и отпуске приобретает дополнительную прочность. |
Пластичность | Высокая пластичность. Алюминий можно бить очень тонко. |
Пластичность | Высокая пластичность. Алюминий чрезвычайно податлив и может быть согнут или изогнут различными способами. |
Тепловое расширение | Алюминий имеет коэффициент теплового расширения 23,2. Это что-то среднее между цинком, который имеет более широкий спектр применения, и сталью, спектр применения которой в два раза меньше, чем у алюминия. |
Электропроводность | Хорошие электрические и тепловые проводники. |
Коррозия | Алюминий устойчив к коррозии благодаря наличию самозащитного оксидного слоя на его поверхности. |
Плотность | Алюминий имеет низкую плотность 2,70 грамма на кубический сантиметр, измеренную по гравитации по сравнению с водой. По сравнению с плотностью железа/стали, которая составляет 7,87, это значительная разница. |
Температура плавления и кипения | Алюминий представляет собой металл с температурой плавления примерно 1220°F и температурой кипения примерно 4478°F. Это технически чистый алюминий. Когда алюминий сплавляется, свойства металла меняются. |
Химические свойства
Когда вещество подвергается химическому изменению или реакции, его характеристики или поведение изменяются. Другими словами, необходимо потревожить атомы вещества, чтобы увидеть его химические характеристики. Во время реакции и после ее завершения ученые могут наблюдать произошедшее нарушение на атомном уровне.
Химические свойства алюминия подробно обсуждаются ниже:
Распространение | Алюминий встречается в природе в виде соединения, большая часть которого содержится в бокситовой руде. |
Окисление | Когда алюминий подвергается воздействию влажного воздуха, он образует оксид алюминия, который представляет собой соединение алюминия и кислорода. |
Пирофор | Когда алюминий находится в виде порошка, он быстро загорается при воздействии источника тепла. |
Способность формовать сплавы | Существуют сотни различных составов алюминиевых сплавов. Железо, медь, марганец, кремний, магний и цинк являются одними из легирующих компонентов, как и другие металлы. |
Реакция с водой | Алюминий довольно быстро реагирует при контакте с горячей водой. |
Реагирует с щелочами | Реагирует с гидроксидом натрия. |
Реакционная способность с кислотой | Алюминий взаимодействует с горячими кислотами и образует оксид алюминия. |
Механические свойства
Механические характеристики используются для описания связи материала между напряжением и деформацией, а также для оценки степени его эластичности в ответ на приложенную нагрузку.
Механические свойства алюминия подробно описаны ниже:
Эластичность при растяжении | 10000 ksi — модуль Юнга алюминия. Для сравнения, медь имеет предел прочности на растяжение 17550 тысяч фунтов на квадратный дюйм, а древесина имеет предел прочности на разрыв 1595 тысяч фунтов на квадратный дюйм. |
Прочность на растяжение ULTIMATE | 13 000 PSI |
Устойчивости | 5000 пс.0115 23100 Psi |
Elongation at break | 15-28% |
Shear Strength | 9000 Psi |
Fatigue strength | 5000 Psi |
Заключение
Алюминиевый сплав часто считается наиболее предпочтительным металлом для тех, кто работает в промышленности.

 Никель
Никель
 Америций
Америций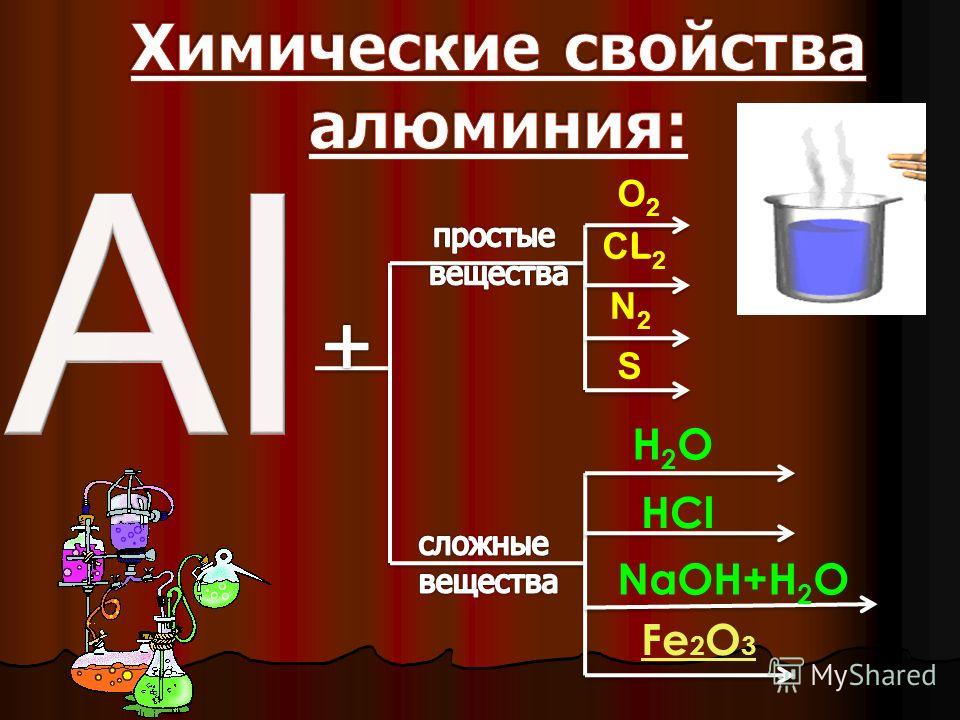 ru/Database/properties.php?dbid=1&id=222
ru/Database/properties.php?dbid=1&id=222