Презентация по химии «Амфотерность алюминия и его соединений» (9 класс)
10 класс
Амфотерность алюминия и его соединений.
Бозаджи Н.М.,
учитель химии,
высшая категория
В результате изучения темы ,вы будете способны:
1.Обобщить знания об алюминии и его соединениях,
2.Опытным путем изучить амфотерность оксида и гидроксида алюминия,
3.Уметь составлять уравнения реакций с участием соединений алюминия в свете ТЭД,
4.Показать большое практическое значение алюминия и его соединений.
5.Осуществлять рефлексию учебной деятельности
Я металл серебристый и легкий
И зовусь самолетный металл.
И покрыт я оксидною пленкой
Чтоб меня кислород не достал!
«Люди гибнут за металл» В.Гете.
Задание 1.
1. Подумайте, почему алюминий так дорого ценился?
2.
3. Назовите формулы этих соединений.
Алюминий и его свойства
Задание 2. Закончите уравнения реакций
1.Al + O 2
2.Al + H 2 O
3.Al + Сl 2
4.Al + HСl
5.Al +HgСl 2
6.Al + Fе 3 О 4
2Al + 3O 2 = 2Al 2 O 3
2Al + 6H 2 O= 2Al(OH) 3 + 3H 2
2Al + 3Сl 2 = 2AlСl 3
2Al + 6HСl= 2AlСl 3 + 3H 2
2Al + 3HgСl 2 = 2AlСl 3 + 3Hg
8Al + 3Fе 3 О 4 = 4Al 2 O 3 + 9Fе
Проблема
Как осуществить превращения: ?
1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ?
2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al
↓ ?
Na[Al(OH) 4 ]
Алюминий
и его соединения
проявляют
амфотерные свойства
При добавлении к таким веществам кислоты, они проявляют основные свойства, а при добавлении к ним щелочи – кислотные свойства .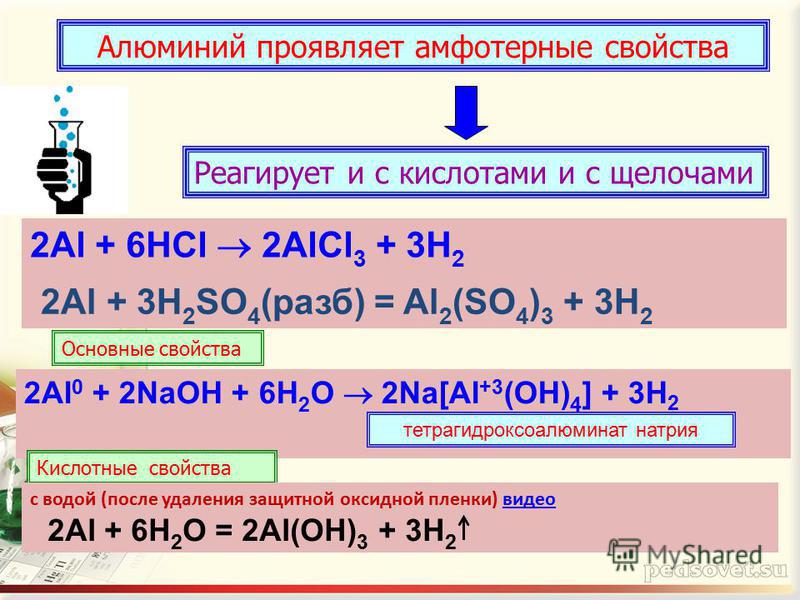
Такая кислотно-основная двойственность химических свойств получила название
«Амфотерность»
способность соединений проявлять либо кислотные либо основные свойства, в зависимости от того с чем они реагируют.
Алюминий проявляет амфотерные свойства
Реагирует и с кислотами и с щелочами
Проявляет сновные свойства
2Al + 6HCl 2AlCl 3 + 3H 2
Проявляет кислотные свойства
2Al 0 + 2NaOH + 6H 2 O 2Na[Al +3 (OH) 4 ] + 3H 2
тетрагидроксоалюминат натрия
Оксид алюминия
- Глинозем
- Корунд
- Рубин
- Сапфир
Al 2 O 3
O=Al–O–Al=O
4Al + 3O 2 2Al 2 O 3
t
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
Амфотерный оксид
Как основной оксид:
Al 2 O 3 + 6HCl 2AlCl 3 + 3H 2 O
Как кислотный оксид:
Al 2 O 3 + 2NaOH + 3H 2 O 2Na[Al(OH) 4 ]
Al 2 O 3 + 2NaOH 2NaAlO 2 + H 2 O
Гидроксид алюминия
Al(OH) 3
AlCl 3 + 3NaOH Al(OH) 3 + 3NaCl
Al(OH) 3 — амфотерный гидроксид
Al(OH) 3 — амфотерный гидроксид
Гидроксид алюминия можно записать как основание и как кислоту
Al( OH ) 3
=
H 3 AlO 3
Al O 3 H 3
=
Основание
Кислота
ХИМИЧЕСКИЙ ХАМЕЛЕОН
AlCl 3 +3NaOH= Al(OH) 3 ↓ +3NaCl
КИСЛОТА
ИЗБЫТОК
ЩЕЛОЧИ
Al(OH) 3
Осадок исчезает
Осадок исчезает
Реагирует как кислота
Реагирует как основание
Амфотерный гидроксид
Как основание :
Al(OH) 3 + 3HCl AlCl 3 + 3H 2 O
Как кислота
Al(OH) 3 + NaOH Na[Al(OH) 4 ]
тетрогидроксоалюминат
натрия
H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O
алюминат натрия
Проверь свои знания! Осуществи превращения:
Na 3 AlO 3
Al Al 2 O 3 AlCl 3 Al(OH) 3
Al 2 (SO 4 ) 3
Проблема
Как осуществить превращения: ?
1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ?
2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al
↓ ?
Na[Al(OH) 4 ]
Применение
Биологическое значение алюминия
Болезнь Альцгеймера?
Акселерация?
Рефлексия
1. На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок я… 5.Мое настроение… 6.Материал урока мне был…
На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок я… 5.Мое настроение… 6.Материал урока мне был…
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.
- Выучить конспект.
- Решить ЦП
- стр.232 упр.1-в
- решить ЦП классной работы
Классный урок на «Радио России – Тамбов», эфир 15 мая 2020 года
Автор ГТРК «ТАМБОВ» На чтение 11 мин. Просмотров 748 ОпубликованоВ уроке химии для девятиклассников кандидат технических наук, учитель химии из 29-го тамбовского лицея Елена Эдуардовна Дегтерева рассказывает о способах получения, физических и химических свойствах алюминия.
Алюминий. Получение алюминия. Физические и химические свойства. Применение. Сегодня я хочу рассказать о самом распространённом металле в земной коре, о алюминии. Алюминий по распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию.
Элемент алюминий расположен в III группе, главной подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al) → 27.
Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний.
Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.
Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т.
Сегодня я хочу рассказать о самом распространённом металле в земной коре, о алюминии. Алюминий по распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию.
Элемент алюминий расположен в III группе, главной подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al) → 27.
Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний.
Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.
Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т.
 Особое место среди минералов занимает криолит Na
Особое место среди минералов занимает криолит Na В настоящее время рубины и сапфиры получают искусственно и используют для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Получение алюминия
Каждый из нас держал в руках изделия из алюминия, так как сейчас из этого металла делают множество приборов, корпуса телефонов, посуду и многое другое. Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе).
Однако так было не всегда.
С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота.
В настоящее время рубины и сапфиры получают искусственно и используют для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Получение алюминия
Каждый из нас держал в руках изделия из алюминия, так как сейчас из этого металла делают множество приборов, корпуса телефонов, посуду и многое другое. Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе).
Однако так было не всегда.
С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота.
 Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия.
С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах.
Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС. Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов.
В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру.
Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия.
С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах.
Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС. Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов.
В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру. Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ?
Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-. Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия.
Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка.
Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла.
Катод (-): Al3+ +3е = Al
На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-.
Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ?
Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-. Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия.
Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка.
Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла.
Катод (-): Al3+ +3е = Al
На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-. При этом происходит следующий электродный процесс:
Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2
При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза:
Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В. Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает».
Физические свойства алюминия
Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС).
При этом происходит следующий электродный процесс:
Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2
При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза:
Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В. Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает».
Физические свойства алюминия
Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС). На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления.
Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди.
По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли. Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин).
Рассмотрим химические свойства алюминия.
В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл.
На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления.
Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди.
По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли. Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин).
Рассмотрим химические свойства алюминия.
В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл. В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3.
Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).
В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3.
Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).
- С галогенами (с такими как Cl2 и Вr2). Реакция протекает бурно при комнатной температуре:
2Al + 3Сl2 → 2AlСl 3 хлорид алюминия2Al + 3 Вr2 → 2AlВr2 бромид алюминия
Очень интересно протекает реакция алюминия с йодом.
Если смешать порошок алюминия и йода то реакция не начнётся, для инициации реакции в смесь добавляют каплю воды, от которой происходит смачивание компонентов и смесь загорается сама собой с выделением фиолетового дыма из паров йода, таким образом вода в этой реакции является катализатором.
- Для начала реакции с другими неметаллами (с S, C, N2, Р), требуется нагревание, зато дальнейшее взаимодействие, сопровождается выделением большого количества теплоты.
При этом образуются бинарные соединения 2Al + 3S → Al2S3 сульфид алюминия 4Al + 3C → Al4C3 карбид алюминия 2Al +N2 → 2AlN нитрид алюминия Al + P → AlP фосфид алюминия
- С водородом Al непосредственно не реагирует.
При нагревании на воздухе алюминий окисляется с поверхности, не загораясь, и образуется оксид алюминия Al2O3. 4Аl + 3O2 = 2Al2O3 +Q
Алюминий соединяется с кислородом воздуха и при обычной температуре, на его поверхности тотчас образуется тончайшая, плотная плёнка, она трудно проницаема для кислорода и предохраняет металл от дальнейшего окисления.
Если же сильно нагреть фольгу алюминия или порошок алюминия, то они воспламеняются и сгорают ослепительным пламенем.
Способность порошка алюминия гореть ослепительным пламенем используется в пиротехнике – производстве бенгальских огней, салютов, фейерверков.
Алюминий реагирует со сложными веществами: 1.Так очищенный от оксидной плёнки алюминий способен реагировать с водой. От защитной плёнки можно избавиться механически (очистив поверхность наждачной бумагой) и химически, погрузив алюминий на несколько минут в раствор кислоты, щёлочи или в жидкую ртуть. В результате реакции с водой образуется гидроксид алюминия и водород.
2Al + 6H2O = 2Al(OH)3 + 3H2
4Аl + 3O2 = 2Al2O3 +Q
Алюминий соединяется с кислородом воздуха и при обычной температуре, на его поверхности тотчас образуется тончайшая, плотная плёнка, она трудно проницаема для кислорода и предохраняет металл от дальнейшего окисления.
Если же сильно нагреть фольгу алюминия или порошок алюминия, то они воспламеняются и сгорают ослепительным пламенем.
Способность порошка алюминия гореть ослепительным пламенем используется в пиротехнике – производстве бенгальских огней, салютов, фейерверков.
Алюминий реагирует со сложными веществами: 1.Так очищенный от оксидной плёнки алюминий способен реагировать с водой. От защитной плёнки можно избавиться механически (очистив поверхность наждачной бумагой) и химически, погрузив алюминий на несколько минут в раствор кислоты, щёлочи или в жидкую ртуть. В результате реакции с водой образуется гидроксид алюминия и водород.
2Al + 6H2O = 2Al(OH)3 + 3H2
- Одно из важнейших химических свойств алюминия – способность вытеснять металлы из их оксидов – используют в металлургии.
 Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией:
Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией:
2Al + Cr2O3 = Al2O3 + 2Cr
Для получения высоких температур, используют реакцию, сгорания термитной смеси — смеси оксида железа (II и III) и порошка алюминия:
8Al + 3Fe3O4 =4 Al2O3 + 9Fe
Выделяющейся в этой реакции теплоты достаточно для расплавления получающегося железа, потому этот процесс используют для сварки и резки стальных изделий.
3. Как активный металл алюминий реагирует с растворами кислот с выделением водорода.
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб.) = Al2(SO4)3 + 3H2А вот концентрированные серная и азотная кислоты пассивируют алюминий при обычной температуре, образуя на поверхности металла, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II):
Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O
При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O
Поэтому эти кислоты перевозят в алюминиевых цистернах.
С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II):
Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O
При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O
- Алюминий – амфотерныйметалл, поэтому он взаимодействует со щелочами.
При нагревании с конц. растворами щелочей алюминий образует комплексные соли (тетрагидроксоалюминаты), при этом выделяется водород.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
Применение
Большую часть производимого алюминия (его производство в мире стоит на 2-м месте после выплавки чугуна и стали) используют для производства сплавов. Они легки, относительно прочны, электропроводны, коррозионноустойчивы, поэтому находят широкое применение в различных областях техники и быту.
Сплавы алюминия используют в самолёто- и ракетостроении. Недаром алюминий называют крылатым металлом.
Алюминий используют для получения металлов, методом алюмотермии.
В строительстве: гофрированными листами алюминиевых сплавов покрывают крыши, а также строят из них различные складские помещения.
Высокая электрическая проводимость чистого алюминия используется в электротехнике. Из сплавов алюминия изготовляют электропровода.
Порошок алюминия сохраняет металлический блеск и используется как краска «серебрянка». Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения.
Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ.
Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины.
Они легки, относительно прочны, электропроводны, коррозионноустойчивы, поэтому находят широкое применение в различных областях техники и быту.
Сплавы алюминия используют в самолёто- и ракетостроении. Недаром алюминий называют крылатым металлом.
Алюминий используют для получения металлов, методом алюмотермии.
В строительстве: гофрированными листами алюминиевых сплавов покрывают крыши, а также строят из них различные складские помещения.
Высокая электрическая проводимость чистого алюминия используется в электротехнике. Из сплавов алюминия изготовляют электропровода.
Порошок алюминия сохраняет металлический блеск и используется как краска «серебрянка». Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения.
Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ.
Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины. Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности.
Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.
Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности.
Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.
неорганическая химия — Почему оксид алюминия амфотерный?
Для ответа на этот вопрос я буду использовать подход, описанный в следующей книге: Arrow Pushing in Inorganic Chemistry; Логический подход к химии элементов главной группы
Для начала просмотрите мой ответ. на этот вопрос: почему хромат устойчив в щелочной среде, а дихромат устойчив в кислой среде? прочитать о предисловии к этому методу, включая потенциальные проблемы.
По сути, в книге рассказывается об определении типа реактивности неорганических молекул по их структуре. Хотя это может не отражать со 100% точностью фактический путь реакции, мы можем считать его довольно хорошим приближением к тому, что происходит в реальности. В то время как полностью правильный механизм может быть обнаружен только экспериментально, мы можем получить вероятных механизмов, используя метод толкания стрелок, и это должно, по крайней мере, отражать реальный путь в достаточной степени, если не полностью.
Теперь, если мы посмотрим на химические формулы оксида алюминия и оксида галлия ($\ce{Al2O3}$ и $\ce{Ga2O3}$), мы можем предположить, что эти звенья обладают аналогичной мостиковой димерной структурой. как показано ниже для оксида алюминия (тот же структурный скелет действителен и для оксида галлия, просто заменив алюминий галлием ниже):
Эта структура теперь обладает некоторыми уникальными свойствами. -}$ . Если используемое основание было $\ce{NaOH}$, то эти продукты лучше указывать как $\ce{NaAlO2}$ для алюминия. В аналогичном случае вы бы получили $\ce{NaGaO2}$, если бы мы начали с оксида галлия. 9-}$, чтобы образовать еще один моль $\ce{AlOCl}$ (показан на следующей диаграмме).
-}$ . Если используемое основание было $\ce{NaOH}$, то эти продукты лучше указывать как $\ce{NaAlO2}$ для алюминия. В аналогичном случае вы бы получили $\ce{NaGaO2}$, если бы мы начали с оксида галлия. 9-}$, чтобы образовать еще один моль $\ce{AlOCl}$ (показан на следующей диаграмме).
После этого $\ce{AlOCl}$ может быть вовлечен в повторяющийся процесс протонирования, воздействия хлоридом и удаления воды с получением следующих конечных продуктов:
Продукты этих реакций можно проверить на наличие оксидов алюминия и галлия на их страницах в Википедии соответственно.
Итак, мы видим, что одна из основных причин амфотерной природы оксидов может быть их мостиковой структурой, что позволяет им реагировать как с кислотами, так и с основаниями, как показано выше.
Теперь, что касается оксида индия, формула этого соединения, как указано здесь, $\ce{In2O3}$, что имеет сходство с формулами $\ce{Al2O3}$ и $\ce{Ga2O3}$, которые мы указали выше. Итак, я ожидаю, что этот оксид по крайней мере будет обладать некоторыми амфотерными свойствами. Это действительно так, как указано здесь для гидроксида индия (поскольку гидроксиды представляют собой просто гидратированные формы своих оксидов, мы можем ожидать аналогичной природы и для оксида индия):
Итак, я ожидаю, что этот оксид по крайней мере будет обладать некоторыми амфотерными свойствами. Это действительно так, как указано здесь для гидроксида индия (поскольку гидроксиды представляют собой просто гидратированные формы своих оксидов, мы можем ожидать аналогичной природы и для оксида индия):
Результат убедительно показал, что In(OH)3 является лишь слегка амфотерным, будучи гораздо более щелочным, чем кислым.
Кроме того, на странице Википедии для оксида индия четко указано, что этот оксид растворяется в кислотах, но не в щелочи. Это в значительной степени ожидаемо, потому что, когда вы перемещаетесь вниз по группе, элементы имеют тенденцию становиться более металлическими по своей природе, и, следовательно, их оксиды также становятся более основными. Таким образом, амфотерный оксид, слегка склоняющийся к основному концу, кажется приемлемым для оксида индия (III). Реакция между кислотой и $\ce{In2O3}$ должна проходить по общей схеме, проиллюстрированной выше для $\ce{Al2O3}$ и $\ce{HCl}$, и давать аналогичные продукты.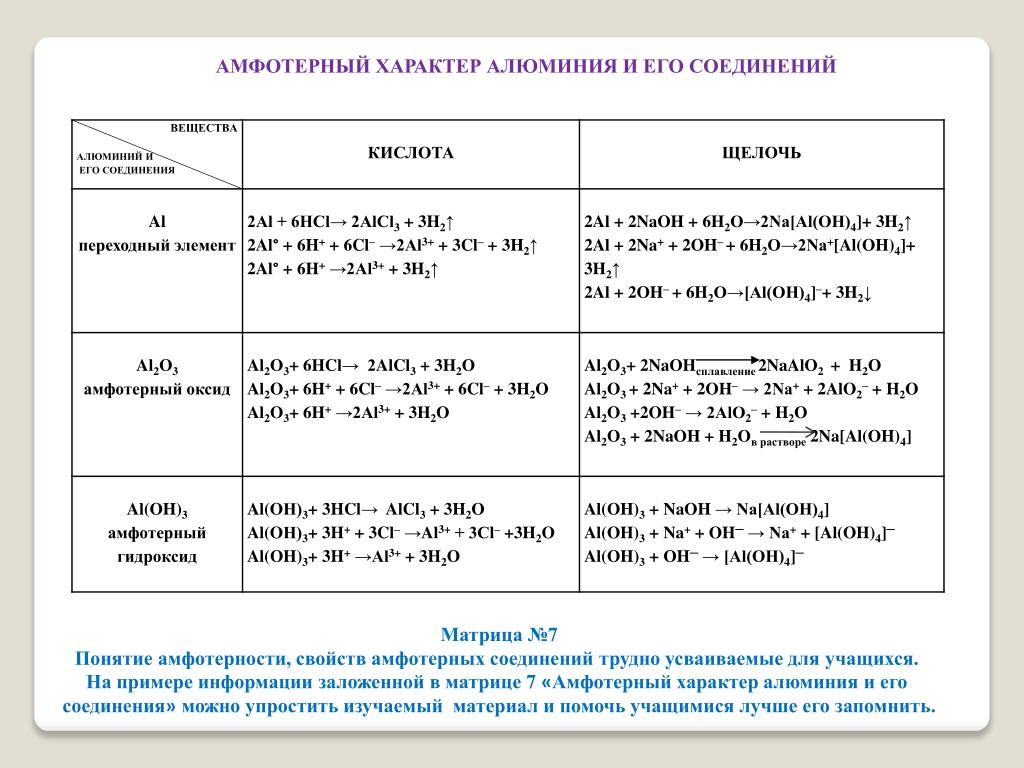 Это действительно так, как видно здесь
Это действительно так, как видно здесь
Что касается таллия, то из-за эффекта инертной пары он обычно образует оксид, в котором таллий находится в степени окисления +1, с формулой $\ce{Tl2O}$, как указано здесь. Это не укладывается в общую формулировку $\ce{Al2O3}$ и $\ce{Ga2O3}$, которую мы обсуждали выше. Следовательно, можно было бы ожидать, что этот оксид просто станет более основным, чем другие члены группы (поскольку это оксид самого нижнего элемента группы) и не будет проявлять особых признаков амфотерной природы. Это совпадает с тем, что здесь указано.
Прежде чем закончить ответ, я хотел бы повторить мысль, которую я высказал в начале ответа:
Все эти пути являются просто возможными механизмами, и нет никакого способа узнать, являются ли они полностью правильными или нет. не без экспериментов. Тем не менее, они являются весьма вероятными предположениями, и вы можете ожидать, что эти пути представляют действительные механизмы в хорошем приближении
Амфотерная природа алюминия
19 декабря 2022 г. 19 декабря 2022 г.
| 11:25
19 декабря 2022 г.
| 11:25
Вы когда-нибудь слышали о чем-то, что называется «амфотерной природой»? Этот термин используется для описания вещества, которое может действовать как кислота или основание, в зависимости от его окружения. Одним из примеров этого является алюминий — металл с поистине замечательными свойствами. Давайте посмотрим, что делает алюминий таким особенным.
Алюминий является одним из самых универсальных элементов благодаря своей амфотерной природе. Это означает, что алюминий способен растворяться как в кислотах, так и в основаниях и, следовательно, способен реагировать с ними обоими. Алюминий 9Способность 0008 вступать в реакцию с различными веществами делает его ключевым элементом в химии и нашла применение в медицине, технике и других отраслях промышленности. Амфотерный статус алюминия позволяет химикам создавать ряд различных соединений — от водорастворимых солей алюминия для медицинского применения до промышленных красок и покрытий, устойчивых к щелочам. Универсальность алюминия делает его незаменимым помощником в лабораториях по всему миру!
Универсальность алюминия делает его незаменимым помощником в лабораториях по всему миру!
Что такое амфотеризм?
Во-первых, давайте начнем с определения того, что такое амфотеризм. Амфотерная молекула — это молекула, которая может реагировать и как кислота, и как основание при различных обстоятельствах. Это означает, что при воздействии разных сред одна и та же молекула может стать либо кислой, либо основной — все зависит от условий.
Как алюминий проявляет амфотеризм?
При воздействии других элементов алюминий может вступать в реакцию либо как кислота, либо как основание. Например, при воздействии воды алюминий образует ионы гидроксида и становится щелочным; однако при воздействии двуокиси углерода он образует ионы водорода и становится кислым. Это делает алюминий невероятно универсальным и способным взаимодействовать со многими другими веществами различными способами.
Почему важна амфотерность алюминия?
Амфотерная природа алюминия позволяет использовать его для различных целей и продуктов, таких как оксид алюминия (Al2O3) для производства стекла; хлорид алюминия для водоподготовки; сульфат алюминия для окрашивания тканей; нитрат алюминия для производства удобрений.

 Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией:
Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией: