Азотная кислота, действие на алюминий
Взаимодействие алюминия с кислотами можно наблюдать на следующих примерах в пробирки наливают 2 н. растворы соляной, серной и азотной кислот и опускают в каждую по кусочку алюминиевой проволоки. Нужно обратить внимание учащихся на бурную реакцию в пробирке с соляной кислотой и на отсутствие реакции в пробирке с азотной кислотой. Азотная кислота пассивирует алюминий. В этом можно убедиться, погрузив алюминиевую проволоку сначала в азотную кислоту (на 5—10 мин.), а затем — в соляную кислоту на алюминий, обработанный азотной кислотой, соляная кислота почти не действует. Следует иметь в виду, что в концентрированной азотной кислоте при нагревании алюминий растворяется. [c.77]Плотность алюминия 2,5—2,7 г/смК На воздухе алюминий быстро окисляется кислородом и покрывается прочной окисной пленкой, которая и защищает его от дальнейшей коррозии. Аналогичное действие на алюминий производит концентрированная азотная кислота. Устойчивость алюминия против азотной кислоты представлена следующими данными
Однако очень разбавленные и очень концентрированные растворы азотной и серной кислот на алюминий практически не действуют — происходит пассивация — оксидная пленка упрочняется. В умеренно концентрированных растворах этих кислот алюминий растворяется. [c.340]
Опустите кусочек алюминия в пробирку с небольшим количеством концентрированной азотной кислоты. Действует ли кислота на алюминий на холоду Почему Осторожно нагрейте раствор. Что наблюдается Обратите внимание на цвет выделяющегося газа. [c.64]
Опыт 8. Испытывают действие концентрированной (65%-ная пл. 1,4) азотной кислоты на алюминий на холоду. Концентрированная азотная кислота пассивирует алюминий. [c.142]
Как уже было сказано в работе 24, алюминий покрыт окисной пленкой, защищающей его от коррозии. На алюминий действуют едкие щелочи, соляная и серная кислоты. Концентрированная азотная кислота пассивирует алюминий, упрочняя защитную пленку на его поверхности. [c.199]
Реакция останавливается на первой стадии в тех случаях, когда образующиеся окислы металлов не растворяются в азотной кислоте. Так, нри действии крепкой азотной кислоты на алюминий на поверхности металла образуется тонкая плотная пленка окислов, нерастворимая в концентрированной НКОд и поэтому защищающая алюминий от дальнейшей коррозии. [c.232]
Азотная кислота обладает высокой реакционной способностью и по отношению к неорганическим веществам. Так, она растворяет почти все металлы. Стойким к концентрированной азотной кислоте (более 80%) является алюминий. Высокая температура, а также примесь серной кислоты увеличивают растворяющее действие азотной кислоты на алюминий. Существует большое число сплавов, стойких по отношению к азотной кислоте. В основном это хромоникелевые стали различных марок.
Водяной пар, первоначально содержащийся в воздухе или получающийся вследствие течи котлов, может явиться причиной образования значительных количеств кислоты, что ведет к разъеданию котлов. Этот недостаток можно свести к минимуму, если не давать температуре падать до тех значений, при которых уже делается возможным образование значительных количеств N0 . Когда газ достигает этой температуры, он поступает в алюминиевые трубы, погруженные в воду. Однако при некоторых обстоятельствах азотная кислота действует даже и на алюминий поэтому следует тщательно избегать течи, которая дала бы возможность воде проникнуть в холодильники. [c.87]
Подобно алюминию, обладает амфотерными свойствами. Минеральные кислоты медленно растворяют галлий на холоду и быстро—при нагревании. Азотная кислота действует на него слабее других. Растворяется и в щелочах, образуя галлаты. Легко взаимодействует с галогенами при незначительном нагревании, при более сильном — с серой. С водородом и азотом непосредственно не соединяется. При нагревании в атмосфере аммиака выше 900° образуется нитрид. [c.79]
Опыт 7. В отдельных пробирках испытывают действие разбавленных соляной и азотной кислот на алюминий. [c.142]
При окислении хрома холодной хлороводородной кислотой получается голубой раствор r lg и выделяется Hg. При обычных условиях образуется темно-зеленый раствор r lg. Серная и азотная кислоты действуют на металлический хром, как на алюминий. Водными растворами щелочей хром из-за амфотерности своего гидроксида окисляется в гидроксокомплекс [ r(OH)g] с выделением водорода. [c.425]
Технический алюминий легко растворяется в соляной кислоте, но с повышением степени его чистоты растворимость резко падает. Серная кислота действует на алюминий очень медленно. От действия концентрированр10й азотной кислоты его защищает окисная пленка. При нагревании пленка трескается и алюминий начинает растворяться в кислоте. Разбавленная азотная кислота растворяет алюминий.
Когда начнет выделяться водород, вынуть проволоку из соляной кислоты, обмыть ее водой и погрузить в концентрированную азотную кислоту. Вынув проволоку из азотной кислоты, обмыть ее водой и снова опустить в соляную кислоту наблюдать пассивирующее действие азотной кислоты на алюминий [c.63]
В производстве азотной кислоты действуют различные корродирующие среды азотная кислота различной концентрации, окислы азота и аммиачно-воздушная смесь при высокой температуре. Аппаратура для подготовки аммиачно-воздушной смеси может быть изготовлена из углеродистой стали, однако в стальных аппаратах всегда образуются частицы ржавчины и окалины, загрязняющие газ. Поэтому аммиачный и воздушный фильтры, смесители. и воздухоподогреватели изготовляют из алюминия или кислотостойкой стали. При выборе. материалов для контактного аппарата необходимо исходить из следующих условий [c.282]
Метилциклогексан бурно окисляется дымящей азотной кислотой, а кислоты более слабой концентрации действуют на него ояновременно как нитрующим, так и акжляющ И М образом. Нитросерная кислота почти не реагирует с этим углеводородом как при нагревании в запаянных трубках (при 70°), так и при нагревании в открытом сосуде (при 80°). Метилциклогексан при нитровании кис ю-той уд. в. 1,2 дает с выходом около 58 7о три изомерных мононитросоединения, в число которых входят первичный, вторичный и третичный продукты. Наметкиным было установлено, что если в качестве нитрующего средства взять вместо азотной кислоты азотнокислый алюминий, то в данном случае выход продуктов нитрования может быть увеличен до 72%. Строение и ф изические константы получающихся при нитровании мононитросоединений могут быть представлены следующими формулами
Al + HNO3 = ? уравнение реакции
В результате растворения навески металлического алюминия в азотной кислоте (Al + HNO3 = ?) может происходить образование различных продуктов. Это зависит от концентрации раствора кислоты. Так, в случае разбавленного раствора продуктами взаимодействия являются нитрат алюминия, оксид азота (I) и вода; очень разбавленного — нитрат алюминия, нитрат аммония и вода. Молекулярные уравнения реакции имеют вид:
Запишем ионные уравнения, учитывая, что простые вещества, оксиды и вода на ионы не распадаются, т.е. не диссоциируют.
Алюминий – тринадцатый элемент Периодической таблицы. Обозначение – Al от латинского «aluminium». Расположен в третьем периоде, IIIА группе. Относится к металлам. Заряд ядра равен 13. Электронная конфигурация выглядит следующим образом:
Алюминий – самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8% (масс.).
Алюминий пассивируется в воде, концентрированной азотной кислоте и растворе дихромата калия из-за образования устойчивой оксидной пленки; амальгамированный металл реагирует с водой. Реакционноспособный, сильный восстановитель. Проявляет амфотерные свойства, реагирует с разбавленными кислотами и щелочами.
Азотная кислота, подготовка к ЕГЭ по химии
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.)
→ KHSO4 + HNO3↑Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O

Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O
Zn + HNO3(3% — оч. разб.) → Zn(NO3)2 + NH4NO3 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al2O3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
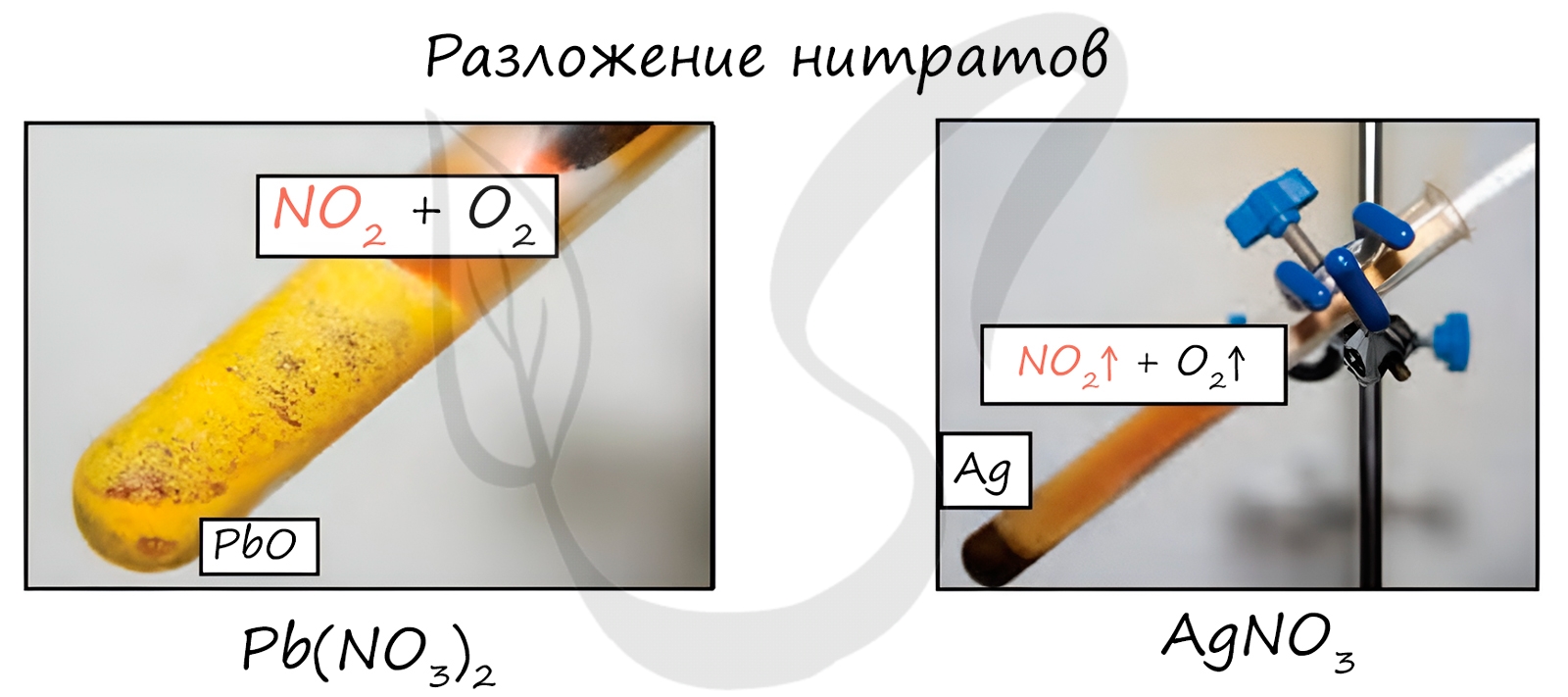
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства алюминия.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s22s22p63s23p1. Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
4Аl + 3О2 = 2Аl2О3
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
2Al + 3I2 =2AlI3
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
2Al + 3Br2 = 2AlBr3
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
2Al + 3Cl2 = 2AlCl3
с серой
При нагревании до 150-200 оС или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 oC образуется нитрид алюминия:
с углеродом
При температуре около 2000oC алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
а) 2Аl + 3Н2SO4(разб.) = Аl2(SO4)3 + 3H2↑
2Аl0 + 6Н+ = 2Аl3+ + 3H20;
б) 2AI + 6HCl = 2AICl3 + 3H2↑
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(разб.) = 8Al(NO3)3 +3N2O↑ + 15H2O
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
I мерников, бочек для крепкой азотной кислоты. Разбавленная азотная кислота оказывает заметное корродирующее действие на алюминий. Алюминий стоек к крепкой серной кислоте и к олеуму при температурах до 100°. К разбавленной серной кислоте и к соляной кислоте алюминий нестоек. К уксусной кислоте алюминий достаточно стоек, вследствие чего применяется для изготовления аппаратуры для ацетилирования и для других производств, имеющих дело X уксусной кислотой. К едким щелочам металл совершенно нестоек и быстро в них растворяется . К аммиаку, а также к кислым газам, как, например, сернистый газ и сероводород, алюминий достаточно стоек. К раствору поваренной соли стойкость его недостаточна. На воздухе металл совершенно не изменяется. Из многочисленных сплавов алюминия в химической промышленности имеет значение лишь сплав его с 13—-14% кремния (силумин), обладающий более высокой, по сравнению с алюминием, стойкостью к крепкой горячей азотной кислоте. [c.30]
Процесс химической очистки алюминия и его сплавов [2] может осуществляться как кислотами, так и щелочами. Последние действуют одновременно и как травильный раствор, и как обезжиривающее средство и часто требуют дополнительной обработки кислотой. Магний и его сплавы [21 проходят травление в разбавленной азотной кислоте и бихроматах. [c.152]
Азотная кислота обладает высокой реакционной способностью и по отношению к неорганическим веществам. Так, она растворяет почти все металлы. Стойким к концентрированной азотной кислоте (более 80%) является алюминий. Высокая температура, а также примесь серной кислоты увеличивают растворяющее действие азотной кислоты на алюминий. Существует большое число сплавов, стойких по отношению к азотной кислоте. В основном это хромоникелевые стали различных марок. [c.135]
Алюминий (ГОСТ 11069—74) и его сплавы (ГОСТ 4784—74, СТ СЭВ 730—77, СТ СЭВ 996—78) применяют для изготовления резервуаров, колонн, теплообменников, реакционных и других аппаратов, работающих в интервале температур от —196 до +150°С при давлении до 0,6 МПа. Алюминий химически стоек к агрессивному действию концентрированной азотной кислоты, сернистых соединений и паров серы, а также многих органических соединений, но не стоек к действию щелочных растворов. Положительными свойствами алюминия является его высокая теплопроводность (в 4,5 раза выше, чем у стали), малая плотность и высокая пластичность, обеспечивающая хорошую прокатываемость и способность штамповаться. Однако алюминий имеет малую прочность. [c.13]
Горячая концентрированная азотная кислота растворяет все металлы, за исключением хрома и алюминия, пассивность которых объясняется образованием оксидной пленки на поверхности. При действии концентрированной азотной кислоты на олово, вольфрам и сурьму образуются малорастворимые кислоты, что позволяет отделить эти металлы фильтрованием сразу же после растворения сплавов. [c.225]
Бериллий подобно алюминию пассивируется при действии азотной кислоты. Его электропроводность превосходит электропроводность меди твердость его почти равна твердости кварца. Иногда им пользуются вместо алюминия в качестве окна в рентгеновских трубках. Изучены некоторые его сплавы. Прибавление окиси бериллия вместо окиси кальция к стеклу увеличивает твердость последнего и повышает точку плавления, но высокая цена препятствует его промышленному использованию. ВеО может применяться в качестве огнеупора взамен MgO. [c.584]
Наиболее химически стойкими металлами, применяемыми в ракетной технике, являются алюминий и его сплавы, высококремнистое железо, а также некоторые сорта нержавеющих сталей, например хромистые и хромоникелевые стали [37]. Обычная малоуглеродистая сталь, а также медь, латунь, бронза, свинец и др. быстро разрушаются под действием окислителей на основе азотной кислоты. [c.663]
Особенно большое значение нержавеющая сталь имеет при изготовлении химической аппаратуры, где чаще всего применяются стали, содержащие 14—20% хрома, 7—12% никеля и не более 0,2% углерода. Особый сплав, отличающийся большой стойкостью действию кислот и щелочей, имеет состав никеля—58%, молибдена—17%, хрома—14%, вольфрама—5%, железа—6%. Получают также стойкие сплавы из цветных металлов. Например, сплав, стойкий к концентрированной азотной кислоте, ряду органических кислот, окислам азота и т. д., имеет состав алюминия—95%, меди—4%, магния—0,5% и марганца—0,5%. Для химического аппаратостроения очень пригодными оказались высококремнистые кислотоупорные чугуны с содержанием 15—18% Е .. Щелочноупорный чугун готовят с малым содерн анием кремния (так как кремний частично растворяется в щелочах). [c.341]
Медь. Взаимодействие меди с кислородом начинается при комнатной температуре и резко возрастает при нагревании с образованием пленки закиси меди (красного цвета). Медь сохраняет прочность и ударную вязкость при низких температурах и поэтому нашла широкое применение в технике глубокого холода. Медь не обладает стойкостью к действию азотной кислоты и горячей серной кислоты, относительно устойчива к действию органических кислот. Широкое распространение получили сплавы меди с другими компонентами оловом, цинком, свинцом, никелем, алюминием, марганцем, золотом и др. Наиболее распространенными являются сплавы меди с цинком (латуни), с оловом (бронзы), с никелем (ЛАН), с железом и марганцем (ЛЖМ), [c.258]
После нанесения последнего слоя необходимо произвести закалку покрытия путем погружения всего изделия в холодную воду или путем орошения покрытой поверхности водой. По крытие хорошо держится на алюминии и его сплавах на простой и специальных сталях, на цинке и никеле, но не держится на меди. Покрытие не раз
Алюминий. Химия алюминия и его соединений
1. Положение алюминия в периодической системе химических элементов
2. Электронное строение алюминия
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой
7.1.3. Взаимодействие с фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с щелочами
7.2.6. Взаимодействие с окислителями
Оксид алюминия
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с основными оксидами
2.2. Взаимодействие с основаниями
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотными оксидами
2.5. Взаимодействие с кислотами
2.6. Взаимодействие с восстановителями
2.7. Вытеснение более летучих оксидов из солей
Гидроксид алюминия
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с щелочами
2.4. Разложение при нагревании
Соли алюминия
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположены в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии:
+13Al 1s22s22p63s23p1 1s  2s
2s  2p
2p  3s
3s  3p
3p 
Электронная конфигурация алюминия в возбужденном состоянии:
+13Al* 1s22s22p63s13p2 1s  2s
2s  2p
2p  3s
3s  3p
3p 
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.

Температура плавления 660оС, температура кипения 1450оС, плотность алюминия 2,7 г/см3.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3) — гидрат оксида алюминия

Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.

Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970оС) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
Al2O3 → Al3+ + AlO33-
На катоде происходит восстановление ионов алюминия:
Катод: Al3+ +3e → Al0
На аноде происходит окисление алюминат-ионов:
Анод: 4AlO33- — 12e → 2Al2O3 + 3O2
Суммарное уравнение электролиза расплава оксида алюминия:
2Al2O3 → 4Al + 3O2
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → 4Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами. При этом образуется белый аморфный осадок гидроксида алюминия.
Например, хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Al(OH)3 + NaOH = Na[Al(OH)4]
Обратите внимание, если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4+
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель. Поэтому он реагирует со многими неметаллами.
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
2Al + 3I2 → 2AlI3
1.2. Алюминий реагирует с серой с образованием сульфидов:
2Al + 3S → Al2S3
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000оС с образованием нитрида:
2Al +N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
4Al + 3C → Al4C3
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки. А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al0 + 6H2+O → 2Al+3(OH)3 + 3H20

Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути (II):
3HgCl2 + 2Al → 2AlCl3 + 3Hg

Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, алюминий бурно реагирует с соляной кислотой:
2Al + 6HCl = 2AlCl3 + 3H2↑

2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2Al + 6H2SO4(конц.) → Al2(SO4)3 + 3SO2 + 6H2O
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
10Al + 36HNO3 (разб) → 3N2 + 10Al(NO3)3 + 18H2O
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
8Al + 30HNO3(оч.разб.) → 8Al(NO3)3 + 3NH4NO3 + 9H2O
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑

Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → NaAlO2 + 3H2↑ + Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов. Процесс восстановления металлов из оксидов называется алюмотермия.
Например, алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3

Еще пример: алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
2Al + 3Na2O2 → 2NaAlO2 + 2Na2O
8Al + 3KNO3 + 5KOH + 18H2O → 8K[Al(OH)4] + 3NH3
10Al + 6KMnO4 + 24H2SO4 → 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
2Al + NaNO2 + NaOH + 5H2O → 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH → 3K2MnO4 + K[Al(OH)4]
4Al + K2Cr2O7 → 2Cr + 2KAlO2 + Al2O3
Алюминий – ценный промышленный металл, который подвергается вторичной переработке. Узнать подробнее о приеме алюминия на переработку, а также об актуальных ценах на данный вид металла можно здесь.
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминия взаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH)3 → 2KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например, тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na[Al(OH)4] + CO2 → Al(OH)3↓ + NaHCO3
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
K[Al(OH)4] + CO2 → Al(OH)3 + KHCO3
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
Na[Al(OH)4] + SO2 → Al(OH)3↓ + NaHSO3
K[Al(OH)4] + SO2 → Al(OH)3 + KHSO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например, с соляной кислотой:
Na[Al(OH)4] + 4HCl(избыток) → NaCl + AlCl3 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Na[Al(OH)4] + НCl(недостаток) → Al(OH)3↓ + NaCl + H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Na[Al(OH)4] + HNO3(недостаток) → Al(OH)3↓ + NaNO3 + H2O
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
AlCl3 + 3Na[Al(OH)4] → 4Al(OH)3↓ + 3NaCl
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Na[Al(OH)4] → NaAlO2 + 2H2O↑
K[Al(OH)4] → KAlO2 + 2H2O
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al3+ + H2O = AlOH2+ + H+
II ступень: AlOH2+ + H2O = Al(OH)2+ + H+
III ступень: Al(OH)2+ + H2O = Al(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHSO3 → 2Al(OH)3 + 6SO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
2Al(NO3)3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaNO3 + 3CO2↑
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Al2O3 + Na2O → 2NaAlO2
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия:
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
NaAlO2 + 4HNO3 → Al(NO3)3 + NaNO3 + 2H2O
2NaAlO2 + 4H2SO4 → Al2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
KAlO2 + H2O = K[Al(OH)4]
NaAlO2 + 2H2O = Na[Al(OH)4]
Бинарные соединения
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
Al2 S3 + 8HNO3 → Al2(SO4)3 + 8NO2 + 4H2O
либо до серной кислоты (под действием горячей концентрированной кислоты):
Al2 S3 + 30HNO3(конц. гор.) → 2Al(NO3)3 + 24NO2 + 3H2SO4 + 12H2O
Сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl3 + NH4Cl
Также нитрид алюминия разлагается под действием воды:
AlN + 3H2O → Al(OH)3↓ + NH3
1) 1. Запишем уравнение реакции алюминия с разбавленной азотной кислотой расставив степени окисления всех элементов:
Al0 + H+N+5O3-2 (разб) = Al+3(N+5O3-2)3 + N+12O-2 + H2+O-2;
2. степени окисления изменяют алюминий и азот, составим уравнения электронного баланса:
Al0 – 3 e— → Al+3, отдавая электроны алюминий является восстановителем в процессе окисления;
N+5 + 4 e— → N+1, азот принимает электроны и является окислителем в процессе восстановления;
3. для постановки коэффициентов определяем общее кратное для отданных и принятых электронов и делим его на их количество:
12 : 4 = 3, мы должны поставить 3 перед восстановленным азотом, но его в системе уже 2, то есть фактически выходит, что его 3 * 2 = 6, значит и при постановке коэффициента перед алюминием нужно будет вдвое увеличить и его количество;
12 : 3 = 4, помним, что коэффициент удваивается 4 * 2 = 8, ставим 8 перед алюминием;
4. записываем уравнение, расставляя коэффициенты:
8Al + 30HNO3 (разб) = 8Al(NO3)3 + 3N2O + 15H2O.
2) 1. При обычных условиях концентрированная азотная кислота пассивирует алюминий, однако при нагревании возможна реакция:
Al0 + H+N+5O3-2 (конц) = Al+3(N+5O3-2)3 + N+4O2-2 + H2+O-2;
2. запишем уравнения электронного баланса:
Al0 – 3 e— → Al+3, алюминий выступает восстановителем и окисляется;
N+5 + 1 e— → N+4, азот выступает окислителем и восстанавливается;
3. общее кратное для 3 и 1 – 3:
3 : 3 = 1, перед алюминием подразумеваем коэффициент равный 1;
3 : 1 = 3, ставим 3 перед восстановленным азотом;
4. записываем уравнение, расставляя коэффициенты:
Al + 6HNO3 (конц) = Al(NO3)3 + 3NO2 + 3H2O.
Алюминий | химический элемент | Британика
Алюминий (Al) , также пишется Алюминий , химический элемент, легкий, серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы. Алюминий является наиболее распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. Из-за его химической активности алюминий никогда не встречается в металлической форме в природе, но его соединения присутствуют в большей или меньшей степени почти во всех породах, растительности и животных.Алюминий сосредоточен во внешних 10 милях (16 км) земной коры, из которых он составляет около 8 процентов по массе; его превышают по количеству только кислород и кремний. Название алюминий происходит от латинского слова alumen , используемого для описания квасцовых квасцов или сульфата алюминия-калия, KAl (SO 4 ) 2 ∙ 12H 2 O.
Encyclopædia Britannica, Inc.Британика Викторина
118 символов и названия периодической таблицы викторины
Bk
| атомный номер | 13 |
|---|---|
| атомный вес | 26.9815 |
| температура плавления | 660 ° C (1220 ° F) |
| точка кипения | 2467 ° C (4473 ° F) |
| удельный вес | 2,70 (при 20 ° C [68 ° F]) |
| валентность | 3 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 3 с 2 3 p 1 |
Возникновение, использование и свойства
Алюминий встречается в магматических породах в основном в виде алюмосиликатов в полевых шпатах, полевых шпатах и слюдах; в почве, полученной из них в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов.Боксит, смесь гидратированных оксидов алюминия, является основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), который встречается в нескольких изверженных породах, добывается как природный абразив или в его более мелких разновидностях, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других минералов алюминия, алунит и криолит имеют некоторое коммерческое значение.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Кристианом Эрстедом путем восстановления хлорида алюминия амальгамой калия.Британский химик сэр Хэмфри Дэви подготовил (1809 г.) железоалюминиевый сплав путем электролиза плавленого глинозема (оксида алюминия) и уже назвал элемент алюминием; позже слово было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Вёлер, используя металлический калий в качестве восстановителя, изготовил алюминиевую пудру (1827 г.) и маленькие шарики металла (1845 г.), из которых он смог определить некоторые его свойства.
Новый металл был представлен публике (1855) на выставке в Париже примерно в то время, когда он стал доступен (в небольших количествах при больших затратах) благодаря восстановлению натрия в расплавленном хлориде алюминия.Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Чарльз Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эрульт во Франции открыли (1886) современный способ промышленного производства алюминия: электролиз очищенного глинозема (Al 2 O ). 3 ) растворяют в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. Обработка алюминия.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняАлюминий добавляют в небольших количествах к определенным металлам, чтобы улучшить их свойства для специальных применений, как, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, умеренное количество других металлов и кремния добавляют к алюминию. Металл и его сплавы широко используются в авиастроении, строительных материалах, товарах длительного пользования (холодильники, кондиционеры, кухонные принадлежности), электрических проводниках, химическом и пищевом оборудовании.
Чистый алюминий (99,996%) довольно мягкий и слабый; коммерческий алюминий (чистота от 99 до 99,6%) с небольшим количеством кремния и железа твердый и прочный. Алюминий, пластичный и очень пластичный, может быть вытянут в проволоку или свернут в тонкую фольгу. Металл всего на треть плотнее железа или меди. Несмотря на то, что алюминий химически активен, он, тем не менее, обладает высокой устойчивостью к коррозии, поскольку на воздухе на его поверхности образуется прочная жесткая оксидная пленка.
Алюминий является отличным проводником тепла и электричества.Его теплопроводность составляет примерно половину теплопроводности меди; его электрическая проводимость, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий является стабильным изотопом алюминия-27. Металлический алюминий и его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Концентрированная азотная кислота, однако, может перевозиться в алюминиевых цистернах, поскольку она делает металл пассивным.Даже очень чистый алюминий активно подвергается воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и алюминат-иона. Из-за своего высокого сродства к кислороду мелкодисперсный алюминий при его воспламенении будет гореть в монооксиде углерода или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного нагрева алюминий инертен по отношению к сере.
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии.Алюминий может быть количественно проанализирован в виде оксида (формула Al 2 O 3 ) или в качестве производного органического соединения азота 8-гидроксихинолина. Производное имеет молекулярную формулу Al (C 9 H 6 ON) 3 .
Соединения
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al , 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в нескольких соединениях (например,например, кристаллический фторид алюминия [AlF 3 ] и хлорид алюминия [AlCl 3 ]), как известно, возникает голый ион Al 3+ , образовавшийся в результате потери этих электронов. Однако энергия, необходимая для образования иона Al 3+ , очень высока, и в большинстве случаев энергетически более выгодно для атома алюминия образовывать ковалентные соединения путем гибридизации sp 2 , как и бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al (H 2 O) 6 ] 3+ встречается как в водном растворе, так и в нескольких солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, который встречается в природе в виде корунда, также в больших количествах готовят для использования в производстве металлического алюминия и в производстве изоляторов, свечей зажигания и различных других продуктов. При нагревании глинозем развивает пористую структуру, которая позволяет ему адсорбировать водяной пар. Эта форма оксида алюминия, коммерчески известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей.Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (AAO), обычно получаемый путем электрохимического окисления алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые предусматривают множество применений. Это термически и механически стабильное соединение, а также оптически прозрачный и электрический изолятор. Размер пор и толщину AAO можно легко адаптировать к конкретным применениям, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим основным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием двойных гидратированных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl (SO 4 ) 2 · 12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; М может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен различными другими ионами М 3+ — например,например, галлий, индий, титан, ванадий, хром, марганец, железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, то есть синтетических органических реакций, участвующих в получении широкого спектра соединений, включая ароматические кетоны и антрохинон и его производные.Гидратированный хлорид алюминия, обычно известный как хлоргидрат алюминия, AlCl 3 H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который действует, сужая поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al (OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO — 2 .С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получены тетрогидроалюминаты (важные восстановители). Алюминийгидрид лития (LiAlH 4 ), образованный в результате реакции хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов, соответственно.
Эта статья была недавно исправлена и обновлена Эриком Грегерсеном, старшим редактором.Подробнее в этих статьях Британики:
элемент группы бора
— это бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и нионий (Nh).Они характеризуются как группа, имеющая три электрона во внешних частях их атомной структуры. Бор, самый легкий…
материаловедение: алюминий
Поскольку алюминий имеет примерно одну треть плотности стали, его замена стали в автомобилях представляется разумным подходом к снижению веса и, таким образом, увеличению экономии топлива и снижению вредных выбросов.Однако такие замены не могут быть сделаны без должного учета…
химическая промышленность: рафинирование алюминия
Фторная промышленность тесно связана с производством алюминия. Оксид алюминия (оксид алюминия, Al 2 O 3 ) может быть восстановлен до металлического алюминия электролизом при сплавлении с флюсом, состоящим из фторалюмината натрия (Na 3 AlF 6 ), обычно называемым криолитом.После запуска процесса криолит становится…
25 кг Алюминиевая барабанная упаковка Азотная кислота 98%
1 Наименование продукта: Азотная кислота
2 Формула: HNO3
3 Чистота: 55%, 60%, 65%, 68%, 98%
4 CAS № 7697-37-2
5 Код ТН ВЭД: 2808000090
6 № ООН: 2031
7 Класс опасности при транспортировке: 8
8 Группа упаковки: II
9 EINECS №: 231-714-2
10 Применение: удобрения, промышленный, органический синтез, рафинирование золота, красители, наркотики и т. Д.
11 Внешний вид: прозрачная жидкость
12 Стандарт производства: Исполнительный стандарт: GB / T626-06
Чистый нитрат — бесцветная прозрачная жидкость, азотная кислота — светло-желтая жидкость (растворимый диоксид азота), в обычных условиях бесцветная прозрачность Жидкость. Запах асфиксии сексуальной стимуляции. Содержание азотной кислоты составляет 68%, летучий белый туман в воздухе, образованный паром азотной кислоты и водяным паром в сочетании с каплями азотной кислоты.
Использование азотной кислоты
1 Его водная смесь используется для очистки пищевого и молочного оборудования благодаря своей способности легко удалять осажденные соединения кальция и магния.
2 При производстве удобрений он используется для производства удобрений, таких как нитрат кальция, нитрат аммония и т. Д.
3 Производство красителей и лекарств Используется при производстве красителей и лекарств из различных продуктов каменноугольной смолы
4 It также используется для изготовления нитратных солей, таких как нитрат аммония, нитрат серебра, нитрат кальция и т. д.
5 Очистка золота, используйте его для отделения золота от других материалов.
6 Используется для производства промышленных химикатов.
7 используется в научных лабораториях в школах для экспериментов при специфическом тестировании на хлорид.
8 используется в области медицины в чистом виде в качестве едкого вещества для избавления от шанкр и бородавок.
ОБРАЩЕНИЕ: носить средства индивидуальной защиты. Не вдыхать аэрозоли или туманы. Не глотать. Не попадать в глаза, на кожу или одежду. Держите источники возгорания вдали от оборудования для хранения, обработки и транспортировки серной кислоты.Расположите безопасную душевую кабину и станцию для промывания глаз рядом с зоной обработки химикатов. Используйте экстремальный уход при разбавлении водой. Всегда добавляйте кислоту в воду, а не наоборот.
ХРАНЕНИЕ: При хранении в нереакционноспособном контейнере держать контейнер плотно закрытым. Металлические и, в частности, углеродистая сталь, резервуары для хранения должны вентилироваться из-за выделения водорода, как указано выше.
1. Упаковано в пластиковый барабан 35 кг, 260 кг / барабан, 280 кг / барабан, 1.4MT / IBC
2. Отгрузка в течение 15 дней после получения предоплаты или LC
БЕСПЛАТНЫЙ ОБРАЗЕЦ азотной кислоты Доступно!
1.Превосходное качество: современное оборудование, строгий контроль качества и соответствие национальным стандартам.
2. Высокая экономическая эффективность: прямые продажи с завода делают цену более конкурентоспособной. Сотрудничество с крупными транспортными компаниями может обеспечить более выгодную стоимость доставки.
3. Транспорт: быстрая логистика, индивидуальные упаковочные пакеты.
Как с нами связаться?
Отправьте ваш запрос в подробности ниже, нажмите «Отправить» сейчас !!
Наши услуги
Почему выбирают нас?
1.Богатый опыт
Специализируется в этой области за более чем 11-летнюю историю
2. 11-50 торговых работников, 5000 квадратных метров фабрики
3. Все сертифицировано SGS
4. Бесплатный образец доступен
Бесплатные образцы рады подготовить. Клиент оплачивает экспресс-зарядку.
Мы обещаем то же качество, что и оптовое количество.
5. Строгая система контроля качества
У нас строгая система контроля качества, все наши специалисты являются профессионалами, они строго на контроле качества.
6. Быстрый ответ
Мы можем ответить в течение 24 часов, и среднее время ответа поставщика на полученные запросы составляет 14 часов.
7. Конкурентоспособная цена
Вы можете посетить наш завод в любое время, также вы можете взять образцы, мы уверены, что наша цена очень конкурентоспособна на этом рынке и качество является лучшим.
Теперь нажмите «Отправить» , чтобы узнать больше !!
Свяжитесь с нами сейчас !!
Лиза Ли
Wuhan Kangzheng Science & Technology Co., Ltd
Add: RM 1203,12F, 2 Block, No.139 Hangyang Avenue, район Hanyang, Ухань, Хубэй, Китай, 430050
TEL: 0086-027-84410680 FAX: 0086-027-84840839
Email: lisa ( at) whkzkj.com
Skype: lisalisa2155
Веб: www.kagrochem.com www.whkzkj.cn
для азотной кислоты
Алюминиевый резервуар для азотной кислоты
Описание продукта
Мы производим горизонтальный и вертикальный резервуар и верхний резервуар, которые изготовлены из нержавеющей стали, углеродистой стали и чистого алюминия.
Как правило, для разных носителей могут использоваться разные материалы.
Для агрессивных жидкостей, таких как концентрированная азотная кислота, уксусная кислота, в качестве опции можно использовать резервуар из чистого алюминия;
Для разбавленной азотной кислоты, резервуар из нержавеющей стали является опцией;
Для серной кислоты, резервуар из углеродистой стали является опцией.
Для специальных масштабов мы предоставляем индивидуальный дизайн и изготовление.
Фото:
Бак для хранения азотной кислоты (алюминиевый резервуар)
Упаковка и отгрузка
1. Деревянная упаковка, если необходимо.
2. Упаковано в полиэтиленовые пакеты, если для очень больших машин.
3.Торговый термин: FOB или CIF.
4. Морские перевозки.
FAQ
О сроках доставки
A —— Обычно мы отправляем посылки в срок FOB.Тем не менее, CIF также являются приемлемыми, что определяется клиентами.
О времени выполнения заказа
A —— Обычно это занимает около 15-20 дней после получения вашего заказа и предоплаты.
Однако, это будет зависеть от графика нашей производственной линии и сложности изделия.
Об условиях платежа
A —— Предварительно T / T или безотзывный аккредитив в поле зрения.
Оборудование может быть настроено, оставьте нам запрос, чтобы узнать более подробную информацию о цене, упаковке и доставке.
,