Алюминий, характеристика элемента и его соединений на основе размещения в периодической системе и строения атома. Физические и химические свойства алюминия. Амфотерность оксида и гидроксида алюминия.
В периодической системе алюминий находится в третьем периоде, в главной подгруппе третьей группы. Заряд ядра +13. Электронное строение атома 1s22s22p63s23p1. Металлический атомный радиус 0,143 нм, ковалентный — 0,126 нм, условный радиус иона Al3+ — 0,057 нм. Энергия ионизации Al – Al+ 5,99 эВ.
Наиболее характерная степень окисления
атома алюминия +3. Отрицательная степень
окисления проявляется редко. Во внешнем
электронном слое атома существуют
свободные d-подуровни. Благодаря
этому его координационное число в
соединениях может равняться не только
4 (AlCl4-, AlH4-, алюмосиликаты),
но и 6 (Al2O3,[Al(OH2)6]3+).
Алюминий — типичный амфотерный элемент.
Для него характерны не только анионные,
но и катионные комплексы. Так, в кислой
среде существует катионный аквакомплекс
[Al(OH
В виде простого вещества алюминий — серебристо-белый, довольно твердый металл с плотностью 2,7 г/см3 (т. пл. 660оС, т. кип. ~2500оС). Кристаллизуется в гранецентрированной кубической решетке. Характеризуется высокой тягучестью, теплопроводностью и электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов. При одинаковой электрической проводимости алюминиевый провод весит вдвое меньше медного.
На воздухе алюминий покрывается тончайшей
(0,00001 мм), но очень плотной пленкой оксида,
предохраняющей металл от дальнейшего
окисления и придающей ему матовый вид. При обработке поверхности алюминия
сильными окислителями (конц. HNO 3,
K2Cr2O7) или анодным
окислением толщина защитной пленки
возрастает. Устойчивость алюминия
позволяет изготавливать из него
химическую аппаратуру и емкости для
хранения и транспортировки азотной
кислоты.
При обработке поверхности алюминия
сильными окислителями (конц. HNO 3,
K2Cr2O7) или анодным
окислением толщина защитной пленки
возрастает. Устойчивость алюминия
позволяет изготавливать из него
химическую аппаратуру и емкости для
хранения и транспортировки азотной
кислоты.
Алюминий легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминиевая фольга (толщиной 0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Основную массу алюминия используют для
получения различных сплавов, наряду с
хорошими механическими качествами
характеризующихся своей легкостью.
Важнейшие из них — дюралюминий (94% Al, 4%
Cu, по 0,5% Mg, Mn, Fe и Si), силумин (85 — 90% Al, 10 —
14% Sk, 0,1% Na) и др. Алюминиевые сплавы
применяются в ракетной технике, в авиа-,
авто-, судо- и приборостроении, в
производстве посуды и во многих других
отраслях промышленности. По широте
применения сплавы алюминия занимают
второе место после стали и чугуна.
Алюминий, кроме того, применяется как легирующая добавка ко многим сплавам для придания им жаростойкости.
При накаливании мелко раздробленного алюминия он энергично сгорает на воздухе. Аналогично протекает и взаимодействие его с серой. С хлором и бромом соединение происходит уже при обычной температуре, с иодом — при нагревании. При очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом. Напротив, с водородом он не взаимодействует.
По отношению к воде алюминий вполне устойчив. Но если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция:
2Al + 6H2O = 2Al(OH)3 + 3H2
Сильно разбавленные, а также очень
концентрированные HNO 3 и H2SO4 на алюминий почти не действуют (на
холоду), тогда как при средних концентрациях
этих кислот он постепенно растворяется. Чистый алюминий довольно устойчив и по
отношению к соляной кислоте, но обычный
технический металл в ней растворяется.
Чистый алюминий довольно устойчив и по
отношению к соляной кислоте, но обычный
технический металл в ней растворяется.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона:
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород:
2Al + 6H2O = 2Al(OH)3 + 3H2
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OH)3 + NaOH = Na[Al(OH)4]
Суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Алюминий заметно растворяется в растворах
солей, имеющих вследствие их гидролиза
кислую или щелочную реакцию, например,
в растворе Na2CO3.
В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al 2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Ввиду нерастворимости Al2O3 в воде отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH— постепенно замещаются в аквокомплексах [Al(OH2)6]3+ молекулы воды:
[Al(OH2)6]3+ + OH— = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH— = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH— = [Al(OH)3(OH2)3]0 + H2
Al(OH)3 представляет собой объемистый
студенистый осадок белого цвета,
практически нерастворимый в воде, но
легко растворяющийся в кислотах и
сильных щелочах. Он имеет, следовательно,
амфотерный характер. Однако и основные
и особенно кислотные его свойства
выражены довольно слабо. В избытке NH4OH
гидроксид алюминия нерастворим. Одна
из форм дегидратированного гидроксида
— алюмогель используется в технике в
качестве адсорбента.
Он имеет, следовательно,
амфотерный характер. Однако и основные
и особенно кислотные его свойства
выражены довольно слабо. В избытке NH4OH
гидроксид алюминия нерастворим. Одна
из форм дегидратированного гидроксида
— алюмогель используется в технике в
качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных
металлов в воде хорошо растворимы, но
ввиду сильного гидролиза растворы их
устойчивы лишь при наличии достаточного
избытка щелочи. Алюминаты, производящиеся
от более слабых оснований, гидролизованы
в растворе практически нацело и поэтому
могут быть получены только сухим путем
(сплавлением Al 2O3 с оксидами
соответствующих металлов). Образуются
метаалюминаты, по своему составу
производящиеся от метаалюминиевой
кислоты HAlO2. Большинство из них в
воде нерастворимо.
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия и слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Галогениды алюминия в обычных условиях
— бесцветные кристаллические вещества.
В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих
аналогов. Он тугоплавок, мало растворяется
в воде, химически неактивен. Основной
способ получения AlF
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и
иодом легкоплавки, весьма реакционноспособны
и хорошо растворимы не только в воде,
но и во многих органических растворителях. Взаимодействие галогенидов алюминия
с водой сопровождается значительным
выделением теплоты. В водном растворе
все они сильно гидролизованы, но в
отличие от типичных кислотных галогенидов
неметаллов их гидролиз неполный и
обратимый. Будучи заметно летучими уже
при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе
(вследствие гидролиза). Они могут быть
получены прямым взаимодействием простых
веществ.
Взаимодействие галогенидов алюминия
с водой сопровождается значительным
выделением теплоты. В водном растворе
все они сильно гидролизованы, но в
отличие от типичных кислотных галогенидов
неметаллов их гидролиз неполный и
обратимый. Будучи заметно летучими уже
при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе
(вследствие гидролиза). Они могут быть
получены прямым взаимодействием простых
веществ.
Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12H2O
применяются в больших количествах для
дубления кож, а также в красильном деле
в качестве протравы для хлопчатобумажных
тканей. В последнем случае действие
квасцов основано на том, что образующиеся
вследствие их гидролиза гидроксид
алюминия отлагается в волокнах ткани
в мелкодисперсном состоянии и, адсордбируя
краситель, прочно удерживает его на
волокне.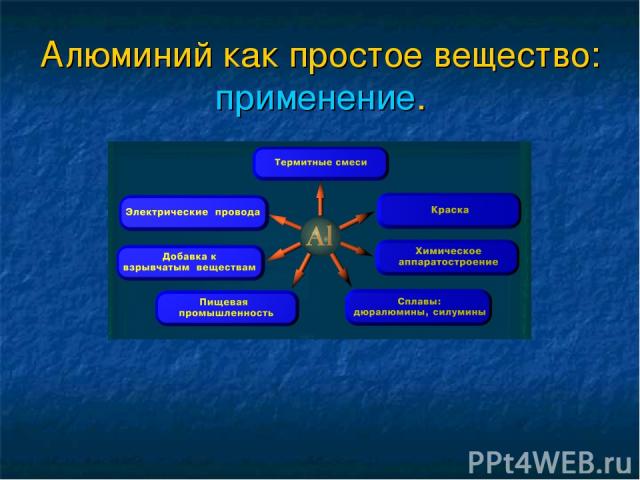
Из остальных производных алюминия
следует упомянуть его ацетат (иначе —
уксуснокислую соль) Al(CH3COO)
Несмотря на наличие громадных количеств алюминия в почках, растениях, как правило, содержат мало этого элемента. Еще значительно меньше его содержание в животных организмах. У человека оно составляет лишь десятитысячные доли процента по массе. Биологическая роль алюминия не выяснена. Токсичностью соединения его не обладают.
Характеристика алюминия. Алюминий: общая характеристика
Каждый химический элемент можно рассмотреть с точки зрения трех наук: физики, химии и биологии. И в этой статье мы постараемся как можно точнее дать характеристику алюминию. Это химический элемент, находящийся в третьей группе и третьем периоде, согласно таблице Менделеева. Алюминий — металл, который обладает средней химической активностью. Также в его соединениях можно наблюдать амфотерные свойства. Атомная масса алюминия составляет двадцать шесть грамм на моль.
Алюминий — металл, который обладает средней химической активностью. Также в его соединениях можно наблюдать амфотерные свойства. Атомная масса алюминия составляет двадцать шесть грамм на моль.
Физическая характеристика алюминия
При нормальных условиях он представляет собой твердое вещество. Формула алюминия очень проста. Он состоит из атомов (не объединятся в молекулы), которые выстроены с помощью кристаллической решетки в сплошное вещество. Цвет алюминия — серебристо-белый. Кроме того, он обладает металлическим блеском, как и все другие вещества данной группы. Цвет алюминия, используемого в промышленности, может быть различным в связи с присутствием в сплаве примесей. Это достаточно легкий металл.
Его плотность равняется 2,7 г/см3, то есть он приблизительно в три раза легче, чем железо. В этом он может уступить разве что магнию, который еще легче рассматриваемого металла. Твердость алюминия довольно низкая. В ней он уступает большинству металлов. Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Плавление алюминия происходит при температуре всего в 660 градусов по шкале Цельсия. А закипает он при нагревании до температуры две тысячи четыреста пятьдесят два градуса по Цельсию. Это очень пластичный и легкоплавкий металл. На этом физическая характеристика алюминия не заканчивается. Еще хотелось бы отметить, что данный металл обладает самой лучшей после меди и серебра электропроводностью.
Распространенность в природе
Алюминий, технические характеристики которого мы только что рассмотрели, достаточно часто встречается в окружающей среде. Его можно наблюдать в составе многих минералов. Элемент алюминий — четвертый среди всех по распространенности в природе. Его массовая доля в земной коре составляет почти девять процентов. Основные минералы, в составе которых присутствуют его атомы, это боксит, корунд, криолит. Первый — это горная порода, которая состоит из оксидов железа, кремния и рассматриваемого металла, также в структуре присутствуют молекулы воды. Он имеет неоднородную окраску: фрагменты серого, красновато-коричневого и других цветов, которые зависят от наличия различных примесей. От тридцати до шестидесяти процентов данной породы — алюминий, фото которого можно увидеть выше. Кроме того, очень распространенным в природе минералом является корунд.
Он имеет неоднородную окраску: фрагменты серого, красновато-коричневого и других цветов, которые зависят от наличия различных примесей. От тридцати до шестидесяти процентов данной породы — алюминий, фото которого можно увидеть выше. Кроме того, очень распространенным в природе минералом является корунд.
Это оксид алюминия. Его химическая формула — Al2O3. Он может обладать красным, желтым, голубым либо коричневым цветом. Его твердость по шкале Мооса составляет девять единиц. К разновидностям корунда относятся всем известные сапфиры и рубины, лейкосапфиры, а также падпараджа (желтый сапфир).
Криолит — это минерал, имеющий более сложную химическую формулу. Он состоит из фторидов алюминия и натрия — AlF3•3NaF. Выглядит как бесцветный или сероватый камень, обладающий низкой твердостью — всего три по шкале Мооса. В современном мире его синтезируют искусственно в лабораторных условиях. Он применяется в металлургии.
Также алюминий можно встретить в природе в составе глин, основным компонентов которых являются оксиды кремния и рассматриваемого металла, связанные с молекулами воды. Кроме того, данный химический элемент можно наблюдать в составе нефелинов, химическая формула которых выглядит следующим образом: KNa3[AlSiO4]4.
Кроме того, данный химический элемент можно наблюдать в составе нефелинов, химическая формула которых выглядит следующим образом: KNa3[AlSiO4]4.
Получение
Характеристика алюминия предусматривает рассмотрение способов его синтеза. Существует несколько методов. Производство алюминия первым способом происходит в три этапа. Последним из них является процедура электролиза на катоде и угольном аноде. Для проведения подобного процесса необходим оксид алюминия, а также такие вспомогательные вещества, как криолит (формула — Na3AlF6) и фторид кальция (CaF2). Для того чтобы произошел процесс разложения растворенного в воде оксида алюминия, нужно его вместе с расплавленным криолитом и кальция фторидом нагреть до температуры минимум в девятьсот пятьдесят градусов по шкале Цельсия, а затем пропустить сквозь эти вещества ток силой в восемьдесят тысяч ампер и напряжением в пять-восемь вольт. Таким образом, вследствие данного процесса на катоде осядет алюминий, а на аноде будут собираться молекулы кислорода, которые, в свою очередь, окисляют анод и превращают его в углекислый газ. Перед проведением данной процедуры боксит, в виде которого добывается алюминия оксид, предварительно очищается от примесей, а также проходит процесс его обезвоживания.
Перед проведением данной процедуры боксит, в виде которого добывается алюминия оксид, предварительно очищается от примесей, а также проходит процесс его обезвоживания.
Производство алюминия способом, описанным выше, является очень распространенным в металлургии. Также существует метод, изобретенный в 1827 году Ф. Велером. Он заключается в том, что алюминий можно добыть с помощью химической реакции между его хлоридом и калием. Осуществить подобный процесс можно, только создав специальные условия в виде очень высокой температуры и вакуума. Так, из одного моль хлорида и такого же объема калия можно получить один моль алюминия и три моль хлорида калия как побочного продукта. Данную реакцию можно записать в виде такого уравнения: АІСІ3 + 3К = АІ + 3КСІ. Указанный метод не приобрел большой популярности в металлургии.
Характеристика алюминия с точки зрения химии
Как уже было сказано выше, это простое вещество, которое состоит из атомов, не объединенных в молекулы. Подобные структуры формируют почти все металлы. Алюминий обладает достаточно высокой химической активностью и сильными восстановительными свойствами. Химическая характеристика алюминия начнется с описания его реакций с другими простыми веществами, а далее будут описаны взаимодействия со сложными неорганическими соединениями.
Алюминий обладает достаточно высокой химической активностью и сильными восстановительными свойствами. Химическая характеристика алюминия начнется с описания его реакций с другими простыми веществами, а далее будут описаны взаимодействия со сложными неорганическими соединениями.
Алюминий и простые вещества
К таковым относится, в первую очередь, кислород — самое распространенное соединение на планете. Из него на двадцать один процент состоит атмосфера Земли. Реакции данного вещества с любыми другими называются окислением, или горением. Оно обычно происходит при высоких температурах. Но в случае с алюминием возможно окисление в нормальных условиях — так образуется пленка оксида. Если же данный металл измельчить, он будет гореть, выделяя при этом большое количество энергии в виде тепла. Для проведения реакции между алюминием и кислородом нужны эти компоненты в молярном соотношении 4:3, в результате чего получим две части оксида.
Данное химическое взаимодействие выражается в виде следующего уравнения: 4АІ + 3О2 = 2АІО3. Также возможны реакции алюминия с галогенами, к которым относятся фтор, йод, бром и хлор. Названия данных процессов происходят от названий соответствующих галогенов: фторирование, йодирование, бромирование и хлорирование. Это типичные реакции присоединения.
Также возможны реакции алюминия с галогенами, к которым относятся фтор, йод, бром и хлор. Названия данных процессов происходят от названий соответствующих галогенов: фторирование, йодирование, бромирование и хлорирование. Это типичные реакции присоединения.
Для примера приведем взаимодействие алюминия с хлором. Такого рода процесс может произойти только на холоде.
Так, взяв два моль алюминия и три моль хлора, получим в результате два моль хлорида рассматриваемого металла. Уравнение этой реакции выглядит следующим образом: 2АІ + 3СІ = 2АІСІ3. Таким же способом можно получить фторид алюминия, его бромид и йодид.
С серой рассматриваемое вещество реагирует только при нагревании. Для проведения взаимодействия между этими двумя соединениями нужно взять их в молярных пропорциях два к трем, и образуется одна часть сульфида алюминия. Уравнение реакции имеет такой вид: 2Al + 3S = Al2S3.
Кроме того, при высоких температурах алюминий взаимодействует и с карбоном, образуя карбид, и с азотом, образуя нитрид. Можно привести в пример следующие уравнения химических реакций: 4АІ + 3С = АІ4С3; 2Al + N2 = 2AlN.
Можно привести в пример следующие уравнения химических реакций: 4АІ + 3С = АІ4С3; 2Al + N2 = 2AlN.
Взаимодействие со сложными веществами
К ним относятся вода, соли, кислоты, основания, оксиды. Со всеми этими химическими соединениями алюминий реагирует по-разному. Давайте разберем подробнее каждый случай.
Реакция с водой
С самым распространенным на Земле сложным веществом алюминий взаимодействует при нагревании. Происходит это только в случае предварительного снятия пленки из оксида. В результате взаимодействия образуется амфотерный гидроксид, а также в воздух выделяется водород. Взяв две части алюминия и шесть частей воды, получим гидроксид и водород в молярных пропорциях два к трем. Записывается уравнение этой реакции так: 2АІ + 6Н2О = 2АІ(ОН)3 + 3Н2.
Взаимодействие с кислотами, основаниями и оксидами
Как и другие активные металлы, алюминий способен вступать в реакцию замещения. При этом он может вытеснить водород из кислоты либо катион более пассивного металла из его соли. В результате таких взаимодействий образуется соль алюминия, а также выделяется водород (в случае с кислотой) либо выпадает в осадок чистый металл (тот, который менее активен, чем рассматриваемый). Во втором случае и проявляются восстановительные свойства, которые упоминались выше. В пример можно привести взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется в воздух водород. Подобного рода реакция выражается в виде следующего уравнения: 2АІ + 6НСІ = 2АІСІ3 + 3Н2.
В результате таких взаимодействий образуется соль алюминия, а также выделяется водород (в случае с кислотой) либо выпадает в осадок чистый металл (тот, который менее активен, чем рассматриваемый). Во втором случае и проявляются восстановительные свойства, которые упоминались выше. В пример можно привести взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется в воздух водород. Подобного рода реакция выражается в виде следующего уравнения: 2АІ + 6НСІ = 2АІСІ3 + 3Н2.
Примером взаимодействия алюминия с солью может служить его реакция с сульфатом меди. Взяв эти два компонента, в итоге мы получим сульфат алюминия и чистую медь, которая выпадет в виде осадка. С такими кислотами, как серная и азотная, алюминий реагирует своеобразно. К примеру, при добавлении алюминия в разбавленный раствор нитратной кислоты в молярном соотношении восемь частей к тридцати образуется восемь частей нитрата рассматриваемого металла, три части оксида азота и пятнадцать — воды. Уравнение данной реакции записывают таким образом: 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15h3O. Указанный процесс происходит только при наличии высокой температуры.
Уравнение данной реакции записывают таким образом: 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15h3O. Указанный процесс происходит только при наличии высокой температуры.
Если же смешать алюминий и слабый раствор сульфатной кислоты в молярных пропорциях два к трем, то получим сульфат рассматриваемого металла и водород в соотношении один к трем. То есть произойдет обыкновенная реакция замещения, как и в случае с другими кислотами. Для наглядности приведем уравнение: 2Al + 3h3SO4 = Al2(SO4)3 + 3h3. Однако с концентрированным раствором этой же кислоты все сложнее. Здесь так же, как и в случае с нитратной, образуется побочный продукт, но уже не в виде оксида, а в виде серы, и вода. Если мы возьмем два необходимых нам компонента в молярном соотношении два к четырем, то в результате получим по одной части соли рассматриваемого металла и серы, а также четыре — воды. Данное химическое взаимодействие можно выразить с помощью следующего уравнения: 2Al + 4h3SO4 = Al2(SO4)3 + S + 4h3O.
Кроме того, алюминий способен реагировать с растворами щелочей. Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
И последнее, что нужно рассмотреть, это закономерности взаимодействия алюминия с некоторыми оксидами. Самый распространенный и используемый случай — реакция Бекетова. Она, так же, как и многие другие из рассмотренных выше, происходит только при высоких температурах. Итак, для ее осуществления необходимо взять два моль алюминия и один моль оксида феррума. В результате взаимодействия этих двух веществ получим оксид алюминия и свободное железо в количестве один и два моль соответственно.
Использование рассматриваемого металла в промышленности
Отметим, что применение алюминия — очень частое явление. Прежде всего, в нем нуждается авиационная отрасль. Наряду со сплавами магния, здесь используются и сплавы на основе рассматриваемого металла. Можно сказать, что среднестатистический самолет на 50% состоит из сплавов алюминия, а его двигатель — на 25%. Также применение алюминия осуществляется в процессе изготовления проводов и кабелей благодаря его отличной электропроводности. Кроме того, данный металл и его сплавы широко применяются в автомобилестроении. Из этих материалов состоят корпусы автомобилей, автобусов, троллейбусов, некоторых трамваев, а также вагонов обычных и электропоездов.
Прежде всего, в нем нуждается авиационная отрасль. Наряду со сплавами магния, здесь используются и сплавы на основе рассматриваемого металла. Можно сказать, что среднестатистический самолет на 50% состоит из сплавов алюминия, а его двигатель — на 25%. Также применение алюминия осуществляется в процессе изготовления проводов и кабелей благодаря его отличной электропроводности. Кроме того, данный металл и его сплавы широко применяются в автомобилестроении. Из этих материалов состоят корпусы автомобилей, автобусов, троллейбусов, некоторых трамваев, а также вагонов обычных и электропоездов.
Также его используют и в менее масштабных целях, например, для производства упаковок для пищевых и других продуктов, посуды. Для того чтобы изготовить серебристую краску, необходим порошок рассматриваемого металла. Такая краска нужна для того, чтобы защитить железо от коррозии. Можно сказать, что алюминий — второй по частоте использования в промышленности металл после феррума. Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Роль в природе
Как уже было написано выше, алюминий в большом количестве содержится в земной коре. Он особенно важен для живых организмов. Алюминий участвует в регуляции процессов роста, формирует соединительные ткани, такие, как костная, связочная и другие. Благодаря данному микроэлементу быстрее осуществляются процессы регенерации тканей организма. Его нехватка характеризуется следующими симптомами: нарушения развития и роста у детей, у взрослых — хроническая усталость, пониженная работоспособность, нарушение координации движений, снижение темпов регенерации тканей, ослабевание мышц, особенно в конечностях. Такое явление может возникнуть, если вы употребляете слишком мало продуктов с содержанием данного микроэлемента.
Такое явление может возникнуть, если вы употребляете слишком мало продуктов с содержанием данного микроэлемента.
Однако более частой проблемой является избыток алюминия в организме. При этом нередко наблюдаются такие симптомы: нервозность, депрессия, нарушения сна, снижение памяти, стрессоустойчивости, размягчение опорно-двигательного аппарата, что может привести к частым переломам и растяжениям. При длительном избытке алюминия в организме часто возникают проблемы в работе практически каждой системы органов.
К такому явлению может привести целый ряд причин. В первую очередь это алюминиевая посуда. Учеными уже давно доказано, что посуда, изготовленная из рассматриваемого металла, непригодна для приготовления в ней пищи, так как при высокой температуре часть алюминия попадает в пищу, и вследствие этого вы употребляете намного больше этого микроэлемента, чем нужно организму.
Вторая причина — регулярное применение косметических средств с содержанием рассматриваемого металла или его солей. Перед применением любого продукта нужно внимательно читать его состав. Не исключением являются и косметические средства.
Перед применением любого продукта нужно внимательно читать его состав. Не исключением являются и косметические средства.
Третья причина — прием препаратов, в которых содержится много алюминия, на протяжении длительного времени. А также неправильное употребление витаминов и пищевых добавок, в состав которых входит данный микроэлемент.
Теперь давайте разберемся, в каких продуктах содержится алюминий, чтобы регулировать свой рацион и организовывать меню правильно. В первую очередь это морковь, плавленые сыры, пшеница, квасцы, картофель. Из фруктов рекомендуются авокадо и персики. Кроме того, богаты алюминием белокочанная капуста, рис, многие лечебные травы. Также катионы рассматриваемого металла могут содержаться в питьевой воде. Чтобы избежать повышенного или пониженного содержания алюминия в организме (впрочем, так же, как и любого другого микроэлемента), нужно тщательным образом следить за своим питанием и стараться сделать его как можно более сбалансированным.
6063 Алюминий: знакомство с его свойствами и применением
Выбор сплава играет важную роль в вашем проекте экструзии алюминия.
6063 алюминий является наиболее популярным сплавом для экструзии, поэтому его следует учитывать. Этот сплав широко используется в архитектуре. Из-за этого его часто называют архитектурным алюминием.
Это сплав средней прочности, который используется для таких применений, как перила, оконные рамы, дверные рамы, крыши, балюстрады, рамы вывесок, торговое оборудование, ирригационные трубы, строительные изделия, электрические, морские, трубопроводы, оборудование для отдыха, хранение цистерны, рамы грузовиков и прицепы.
Этот сплав часто выдавливается в трубы и каналы для использования в архитектурных проектах.
Вот некоторые общие характеристики 6063
Этот сплав обладает средней прочностью, хорошей коррозионной стойкостью, свариваемостью и обрабатываемостью. Он также достаточно поддается механической обработке. Загрузите PDF-файл с его характеристиками и свойствами материала.
| Характеристика | Оценка |
|---|---|
| Прочность | Средняя |
| Corrosion Resistance | Good |
| Weldability & Brazability | Good |
| Workability | Good |
| Machinability | Fair |
By tempering this alloy, greater strength can be достигнуто.
Свойства материалов 6063-T5, 6063-T6, 6063-T832 Алюминий
Одними из наиболее распространенных вариантов отпуска для этого сплава являются T5, T6 и T832.
Физические свойства алюминия 6063
Здесь мы можем видеть плотность сплава. Обратите внимание, что нет разницы в плотности между состояниями Т5, Т6 и Т832.
| Собственность | 6063-T5 | 6063-T6 | 6063-T832 |
|---|---|---|---|
| Плотность | 2,70 G/CC | CC | CC | CC | CC | CC | CC | CC | CC | 0,0975 фунта/дюйм³ | 2,70 г/куб.см | 0,0975 фунта/дюйм³ | 2,70 г/куб.см | 0,0975 фунта/дюйм³ |
Механические свойства алюминия 6063
Здесь мы можем увидеть предел прочности при растяжении, предел текучести и модуль упругости как для состояний Т4, так и для состояний Т6.
| Собственность | 6063-T5 | 6063-T6 | 6063-T832 |
|---|---|---|---|
| Прочность на термин | 186 MPA | 27000 psi | 241 МПа | 35000 psi | 290 МПа | 42000 psi |
| Предел текучести | 145 МПа | 21000 фунтов на квадратный дюйм | 214 МПа | 31000 psi | 269 МПа | 39000 psi |
| Модуль упругости | 68,9 ГПа | 10000 тыс. фунтов/кв.дюйм фунтов/кв.дюйм | 68,9 ГПа | 10000 тыс.фунтов/кв.дюйм | 69,0 ГПа | 10000 ksi |
Тепловые свойства алюминия 6063
Здесь мы можем увидеть некоторые тепловые свойства сплава, включая коэффициент теплового расширения и теплопроводность. Включены состояния Т5, Т6 и Т832.
| Собственность | 6063-T5 | 6063-T6 | 6063-T832 |
|---|---|---|---|
| Коэффициент термического расширения @ 20,0-100 ° C | 21,8 µ µ/M-M-° C | 12,1 мкдюйм/дюйм-°F | 21,8 мкм/м-°C | 12,1 мкдюйм/дюйм-°F | 21,8 мкм/м-°C | 12,1 мкдюйм/дюйм-°F |
| Теплопроводность | 209 Вт/м-K | 1450 БТЕ-дюйм/час-фут²-°F | 200 Вт/м-K | 1390 БТЕ-дюйм/час-фут²-°F | 200 Вт/м-K | 1390 БТЕ-дюйм/час-фут²-°F |
Примечание. Приведенные выше свойства материала взяты из Matweb, здесь, здесь и здесь. Обратите внимание, что они не могут быть проверены на 100%.
Возможно, вас интересует состав сплава 6063.
Химический состав алюминия 6063
Этот сплав является частью серии сплавов 6000. Таким образом, его основными легирующими элементами являются магний и кремний. Магний добавляют для повышения прочности, а кремний добавляют для снижения температуры плавления металла. Здесь мы можем увидеть рекомендации по химическому составу алюминия 6063.
| Element | Minimum % | Maximum % | |
|---|---|---|---|
| Magnesium | 0.45 | 0.9 | |
| Silicon | 0.2 | 0.6 | |
| Iron | No Min | 0.35 | |
| Медь | Нет Мин. | 0.1 | |
| Марганец | Нет Мин.0027 | No Min | 0.1 |
| Zinc | No Min | 0.1 | |
| Titanium | 0.0 | 0.1 | |
| Other Elements | No Min | 0. 05 each0.15 in total 05 each0.15 in total |
Теперь, когда мы увидели химический состав 6063, давайте поговорим о том, как этот сплав сравнивается с некоторыми другими ключевыми вариантами.
Сравнение алюминия 6063 с другими сплавами
Сплав 6063 является наиболее распространенным для экструзии, но вы можете рассмотреть другие варианты для вашего конкретного применения. Ниже приведены некоторые другие распространенные сплавы, которые часто рассматриваются в качестве альтернативы.
6063 по сравнению с 6061
Эти два сплава являются наиболее популярными для экструзии, причем 6063 занимает первое место, а алюминий 6061 — второе место. Оба являются частью серии 6000 и в основном легированы магнием и кремнием. Таким образом, они обладают многими одинаковыми качествами. Они обладают аналогичной коррозионной стойкостью, свариваемостью и обрабатываемостью. Они оба могут использоваться в самых разных приложениях.
Одно из ключевых отличий состоит в том, что 6061 более прочная из двух, и в состоянии Т6 ее прочность примерно равна прочности конструкционной стали. Таким образом, он часто используется для структурных приложений. С другой стороны, одним из преимуществ 6063 является то, что из него легче формировать сложные формы с гладкими поверхностями. Он также очень подходит для анодирования и обладает лучшей коррозионной стойкостью Узнать больше »
Таким образом, он часто используется для структурных приложений. С другой стороны, одним из преимуществ 6063 является то, что из него легче формировать сложные формы с гладкими поверхностями. Он также очень подходит для анодирования и обладает лучшей коррозионной стойкостью Узнать больше »
Резюме
6063 Алюминий является наиболее распространенным выбором для экструзии благодаря его превосходной экструдируемости, высокой коррозионной стойкости и способности формовать сложные формы. Он часто используется для архитектурных приложений из-за его приятного внешнего вида и приемлемой прочности.
Загрузите наш PDF-файл о свойствах алюминия 6063, чтобы сохранить его в качестве справочного материала.
Все о 3003 Алюминий (свойства, прочность и применение)
Алюминий — самый распространенный элемент в земной коре, а в металлической форме — бесценный ресурс для большинства отраслей промышленности. Существует много типов металлического алюминия, называемых алюминиевыми сплавами, и каждый из них имеет свои уникальные свойства материала, которые подходят для любого количества задач. Процесс легирования включает введение металлических элементов (цинк, магний, медь и т. д.) в основной металл (в данном случае алюминий) для улучшения его свойств материала. Существует так много типов, что алюминиевые сплавы стали самостоятельным классом металлов, и Алюминиевая ассоциация разработала четырехзначную систему наименования для их организации на основе легирующих элементов и общих характеристик. В этой статье будет освещен алюминиевый сплав 3003, который является одним из наиболее широко распространенных и используемых типов алюминия. Этот сплав относится к серии сплавов 3xxx, в которых в качестве основного легирующего элемента используется марганец, и считается одним из лучших алюминиевых сплавов общего назначения. В этой статье будут рассмотрены физические свойства, прочность и использование алюминия 3003, и благодаря этому исследованию станет ясно, сколько применений может иметь этот сплав.
Процесс легирования включает введение металлических элементов (цинк, магний, медь и т. д.) в основной металл (в данном случае алюминий) для улучшения его свойств материала. Существует так много типов, что алюминиевые сплавы стали самостоятельным классом металлов, и Алюминиевая ассоциация разработала четырехзначную систему наименования для их организации на основе легирующих элементов и общих характеристик. В этой статье будет освещен алюминиевый сплав 3003, который является одним из наиболее широко распространенных и используемых типов алюминия. Этот сплав относится к серии сплавов 3xxx, в которых в качестве основного легирующего элемента используется марганец, и считается одним из лучших алюминиевых сплавов общего назначения. В этой статье будут рассмотрены физические свойства, прочность и использование алюминия 3003, и благодаря этому исследованию станет ясно, сколько применений может иметь этот сплав.
Физические свойства алюминия 3003
Алюминиевые сплавы различаются по типам и процентному содержанию легирующих элементов. Сплавы с содержанием легирующих элементов менее 4 % называются «деформируемыми», а сплавы с содержанием легирующих элементов до 22 % — «литыми». Эта статья касается только деформируемых сплавов, но между деформируемыми сплавами существует важное обозначение в зависимости от того, как они упрочняются. Некоторые деформируемые сплавы можно упрочнить с помощью высокотемпературного процесса, называемого термической обработкой (дополнительную информацию об этом см. в нашей статье об алюминиевом сплаве 7075), или подвергнуть деформационному упрочнению (иногда называемому «нагартовкой»). Сплавы класса 3ххх не подлежат термической обработке, то есть их можно упрочнить только в процессе наклепа. В этом методе упрочнения используется механическая деформация (прокатка, удар молотком и т. д.), чтобы изменить молекулярную структуру металла, сделав его более прочным, но менее пластичным. Для получения более подробной информации об этом процессе, пожалуйста, не стесняйтесь читать все об алюминиевом сплаве 5052, еще одном распространенном сплаве, не поддающемся термообработке.
Сплавы с содержанием легирующих элементов менее 4 % называются «деформируемыми», а сплавы с содержанием легирующих элементов до 22 % — «литыми». Эта статья касается только деформируемых сплавов, но между деформируемыми сплавами существует важное обозначение в зависимости от того, как они упрочняются. Некоторые деформируемые сплавы можно упрочнить с помощью высокотемпературного процесса, называемого термической обработкой (дополнительную информацию об этом см. в нашей статье об алюминиевом сплаве 7075), или подвергнуть деформационному упрочнению (иногда называемому «нагартовкой»). Сплавы класса 3ххх не подлежат термической обработке, то есть их можно упрочнить только в процессе наклепа. В этом методе упрочнения используется механическая деформация (прокатка, удар молотком и т. д.), чтобы изменить молекулярную структуру металла, сделав его более прочным, но менее пластичным. Для получения более подробной информации об этом процессе, пожалуйста, не стесняйтесь читать все об алюминиевом сплаве 5052, еще одном распространенном сплаве, не поддающемся термообработке. Обозначений алюминиевого сплава 3003 в зависимости от его нагартовки еще больше, но для краткости мы выделим только один вид – алюминий 3003 с закалкой h28 (3003-h28).
Обозначений алюминиевого сплава 3003 в зависимости от его нагартовки еще больше, но для краткости мы выделим только один вид – алюминий 3003 с закалкой h28 (3003-h28).
типа 3003 определяется как сплав алюминия, который номинально содержит 0,12% Cu, 1,2% Mn и 98,6% Al. Обратите внимание, что эти проценты немного колеблются в зависимости от способа изготовления алюминиевого сплава, а другие следовые примеси могут быть обнаружены в естественных количествах. Алюминиевый сплав 3003 довольно прост по составу, в основном из-за того, что для получения сплава к алюминию можно успешно добавить только определенное количество марганца (~ 1,5% Mn). Плотность алюминия марки 3003 составляет 2,73 г/см3 (0,0986 фунтов/дюйм³).
Механические свойства
При выборе алюминия 3003 должны быть известны определенные показатели, такие как предел текучести, предел прочности, прочность на сдвиг, модуль упругости и модуль сдвига. Как объяснялось ранее, все механические значения были взяты из алюминиевого сплава 3003-х28, но известно, что значения прочности немного меняются в зависимости от процесса закалки. Соответствующие меры кратко объясняются и резюмируются ниже в этом разделе и в Таблице 1 соответственно.
Соответствующие меры кратко объясняются и резюмируются ниже в этом разделе и в Таблице 1 соответственно.
Пределы текучести и предела прочности имеют жизненно важное значение для спецификации материала и представляют собой максимальную величину напряжения в определенных точках процесса деформации. Предел текучести при растяжении для алюминиевого сплава 3003 составляет 186 МПа (27 000 фунтов на квадратный дюйм), а предел прочности составляет 200 МПа (29 000 фунтов на квадратный дюйм), что делает алюминий 3003 умеренно прочным материалом. Предел текучести используется чаще, поскольку он определяет максимальную величину напряжения перед пластической (или остаточной) деформацией, что является необходимым ограничением для статических приложений (конструкции, архитектура и т. д.). Предел прочности — это максимальное напряжение, достигаемое во время пластической деформации, и это полезно в определенных случаях, когда это применимо. Для более глубокого понимания этих значений, не стесняйтесь посетить нашу статью об алюминиевом сплаве 7075.
3003 обычно вырезают из листового металла, где он подвергается нагрузкам сдвига. Эти типы напряжений возникают из-за противоположных сил вдоль плоскости, и их можно понять, представив ножницы, разрезающие бумагу. Когда лезвия ножниц смыкаются, две противодействующие силы увеличиваются вдоль плоской плоскости бумаги, и силы сдвига деформируют или «режут» бумагу. Резка листового металла работает почти так же, хотя и с гораздо более тяжелым оборудованием, чем ножницы, и с алюминием вместо бумаги. Мера того, насколько материал устойчив к напряжениям сдвига, называется прочностью на сдвиг, и ее полезно знать для сплавов, которые можно использовать в качестве листового металла, таких как алюминий 3003. Для алюминиевого сплава типа 3003 прочность на сдвиг составляет 110 МПа (16 000 фунтов на квадратный дюйм), что означает, что ему относительно легко придать любую желаемую форму.
Реакция материала на определенные напряжения (или силы в некоторой области) определяется его модулем упругости и модулем сдвига. Эти значения рассчитываются на основе эмпирических стресс-тестов, когда возрастающее напряжение и его физическое воздействие на кусок сплава фиксируются на кривой зависимости напряжения от деформации. Модуль упругости и модуль сдвига — это просто наклоны этих графиков в области упругости или в области, где кусок алюминия будет непостоянно деформироваться (подумайте, как резиновая лента, где материал «щелкает» обратно в свою первоначальную форму). ). Этот наклон является мерой сопротивления материала деформации и может быть полезен для общего понимания прочности материала. Для алюминия марки 3003 модуль упругости и модуль сдвига составляют 68,9.ГПа (10 000 тысяч фунтов на квадратный дюйм) и 25 ГПа (3630 тысяч фунтов на квадратный дюйм) соответственно.
Эти значения рассчитываются на основе эмпирических стресс-тестов, когда возрастающее напряжение и его физическое воздействие на кусок сплава фиксируются на кривой зависимости напряжения от деформации. Модуль упругости и модуль сдвига — это просто наклоны этих графиков в области упругости или в области, где кусок алюминия будет непостоянно деформироваться (подумайте, как резиновая лента, где материал «щелкает» обратно в свою первоначальную форму). ). Этот наклон является мерой сопротивления материала деформации и может быть полезен для общего понимания прочности материала. Для алюминия марки 3003 модуль упругости и модуль сдвига составляют 68,9.ГПа (10 000 тысяч фунтов на квадратный дюйм) и 25 ГПа (3630 тысяч фунтов на квадратный дюйм) соответственно.
Таблица 1: Сводка механических свойств алюминиевого сплава 3003.
Механические свойства | Метрическая система | Английский |
Предельная прочность на растяжение | 200 МПа | 29000 фунтов на кв. |
Предел текучести при растяжении | 186 МПа | 27000 фунтов на кв. дюйм |
Прочность на сдвиг | 110 МПа | 16000 фунтов на кв. дюйм |
Модуль упругости | 68,9 ГПа | 10000 тысяч фунтов на квадратный дюйм |
Модуль сдвига | 25 ГПа | 3630 тысяч фунтов на квадратный дюйм |
Применение алюминия 3003
Алюминийтипа 3003 считается самым популярным алюминиевым сплавом из-за его умеренной прочности, хорошей обрабатываемости и приемлемой коррозионной стойкости. Он превосходен во многих областях применения, настолько многих, что известен как сплав «общего назначения». Из-за этого трудно охватить все области применения алюминия 3003, но некоторые популярные области применения включают:
- Листовой металл
- Строительные принадлежности
- Химическое оборудование
- Грузовики и прицепы
- Топливные баки
- Шкафы
Резюме
В этой статье представлен краткий обзор свойств, прочности и применения алюминия 3003. Для получения информации о других продуктах обратитесь к нашим дополнительным руководствам или посетите платформу поиска поставщиков Thomas, чтобы найти потенциальные источники поставок или просмотреть подробную информацию о конкретных продуктах. У нас также есть руководства по другим типам алюминия, включая алюминий 5052, алюминий 6061 и алюминий 7075.
Для получения информации о других продуктах обратитесь к нашим дополнительным руководствам или посетите платформу поиска поставщиков Thomas, чтобы найти потенциальные источники поставок или просмотреть подробную информацию о конкретных продуктах. У нас также есть руководства по другим типам алюминия, включая алюминий 5052, алюминий 6061 и алюминий 7075.
Другие изделия из алюминия
- Ведущие поставщики и производители алюминия в США
- Различные типы марок алюминия (свойства и применение)
- Все об алюминии 6061 (свойства, прочность и применение)
- Все об алюминии 7075 (свойства, прочность и применение)
- Все об алюминии 5052 (свойства, прочность и применение)
- Все об алюминии 2024 (свойства, прочность и применение)
- Все об алюминии 6063 (свойства, прочность и применение) Алюминий
- 6061 и алюминий 6063 — различия в свойствах, прочности и использовании Алюминий
- 6061 и алюминий 5052 — различия в свойствах, прочности и использовании Алюминий
- 6061 и алюминий 2024 — различия в свойствах, прочности и использовании Алюминий
- 3003 и алюминий 6061 — различия в свойствах, прочности и использовании
Источники:
- https://www.


 дюйм
дюйм