Основные свойства алюминия: области применения
Вопросы, рассмотренные в материале:
- Как был открыт алюминий и каковы его основные свойства
- Основные физические свойства алюминия
- Основные химические свойства алюминия
- Как применяют основные свойства алюминия
- Как используют основные свойства алюминия в строительстве
Основные свойства алюминия делают этот материал по-настоящему универсальным и ценным. Его используют во всех видах промышленного производства, в сельском хозяйстве, в быту, в коммерции. Обладает огромным количеством преимуществ по отношению к стали и другим видам металла.
Самые популярные сферы применения алюминия – изготовление металлоконструкций и металлообработка. О том, какие свойства металла и где конкретно они нашли свое применение, читайте далее.
Как был открыт алюминий и каковы его основные свойства
Алюминий представляет собой парамагнитный металл, достаточно легкий, имеющий серебристый цвет.
Алюминий активно используется в большинстве сфер производства. Его сплавы применяются для изготовления бытовой техники, транспорта, в машиностроении и электротехнике. Капитальное строительство также не может обойтись без него.
Он чрезвычайно распространен в земной коре, являясь первым из металлов и третьим химическим элементом (первое место у кислорода, второе – у кремния). Доля алюминия в наших недрах – 8,8 %. Металл является частью большого количества горных пород и минералов, основной из которых – алюмосиликат.
В виде соединений алюминий находится в базальтах, полевых шпатах, гранитах, глине и пр. Однако в основном его получают из бокситов, которые достаточно редко встречаются в виде месторождений.
Рекомендуем статьи по металлообработке
- Марки сталей: классификация и расшифровка
- Марки алюминия и области их применения
- Дефекты металлический изделий: причины и методика поиска
Ткани животных и растений содержат алюминий в виде микроэлемента. Некоторые организмы, например, моллюски и плауны, являются его концентраторами, накапливая в своих органах.
Человечеству с давних времен знакомо соединение алюминия под названием алюмокалиевые квасцы. Применялось оно в процессе выделки кожи, в качестве средства, которое, набухая, связывает различные компоненты смеси. Во второй половине XVIII в. ученые открыли оксид алюминия. А вот вещество в чистом виде получили значительно позже.
Впервые это удалось Ч. К. Эрстеду, который выделил алюминий из хлорида. Проводя опыт, он обрабатывал соли калия амальгамой, в результате чего выделился порошок серого цвета, признанный всеми чистым алюминием.
Проводя опыт, он обрабатывал соли калия амальгамой, в результате чего выделился порошок серого цвета, признанный всеми чистым алюминием.
В дальнейшем, исследуя металл, ученые определили его химические свойства, проявляющиеся в высокой способности к восстановлению и активности. Именно поэтому с алюминием долгое время не работали.
Но уже в 1854 г. французский ученый Девиль, применив электролиз расплава, сумел получить металл в слитках. Данный метод используется и сейчас. В промышленных масштабах алюминий стали производить в начале XX в., когда предприятия смогли получить доступ к большому количеству электроэнергии.
Сегодня алюминий является одним из самых используемых в производстве бытовой техники и строительстве металлом.
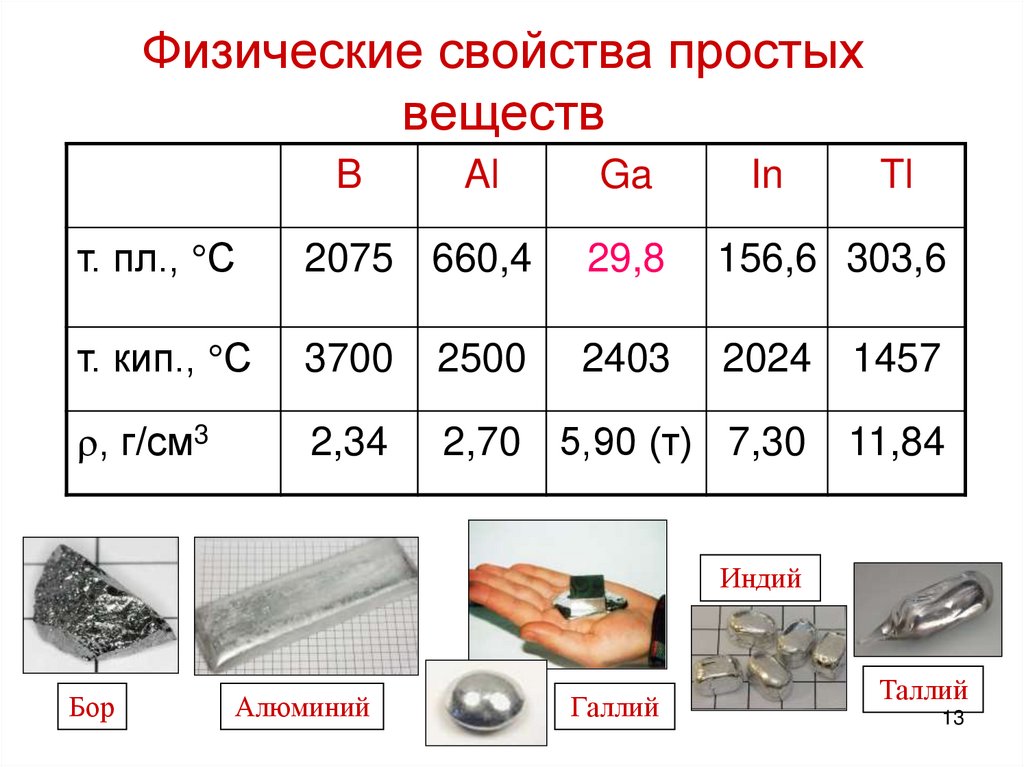
Основные физические свойства алюминия
Основные характеристики алюминия – высокая электро- и теплопроводность, пластичность, устойчивость к холоду и коррозии. Его можно обрабатывать посредством прокатки, ковки, штамповки, волочения.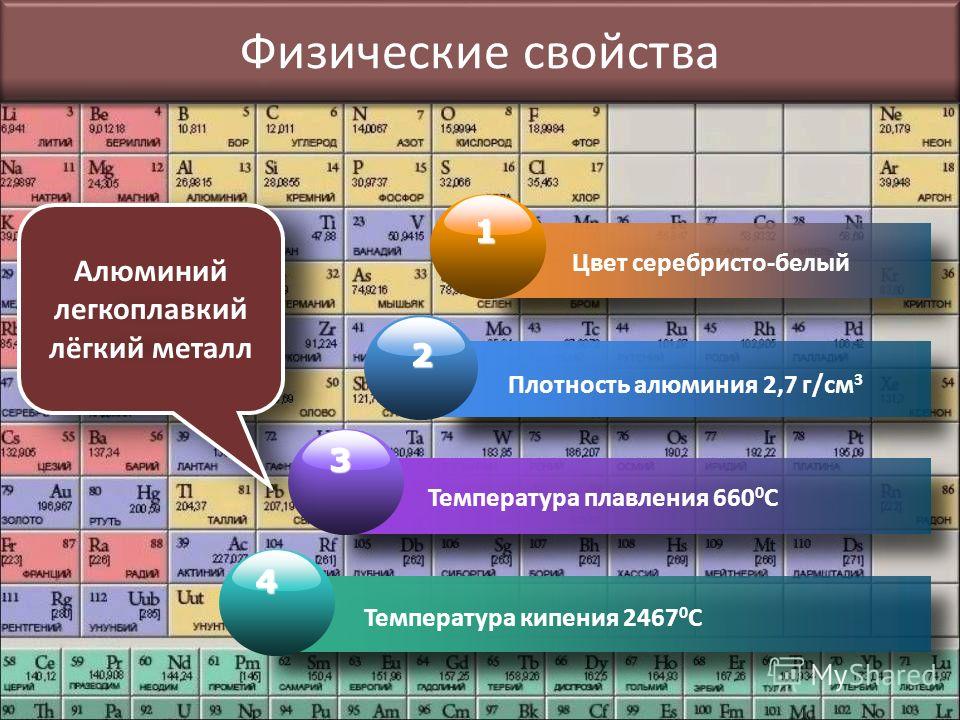 Алюминий прекрасно поддается сварке.
Алюминий прекрасно поддается сварке.
Примеси, присутствующие в металле в различных количествах, значительно ухудшают механические, технологические и физико-химические свойства чистого алюминия. Основными из них являются титан, кремний, железо, медь и цинк.
По степени очистки алюминий разделяют на технический металл и высокой чистоты. На практике различия данных типов – в стойкости к коррозии в различной среде. Стоимость напрямую зависит от чистоты алюминия. Технический металл подходит для производства проката, различных сплавов, кабельно-проводниковых изделий. Чистый используют для специальных целей.
Алюминий обладает высокой электропроводностью, уступая только золоту, серебру, меди. Однако сочетание данного показателя с малой плотностью позволяет использовать его при производстве кабельно-проводниковых изделий наравне с медью. Электропроводность металла может увеличиваться при длительном отжиге или ухудшаться при нагартовке.
Увеличивая чистоту алюминия, производители повышают его теплопроводность. Снизить данное свойство способны примеси меди, марганца и магния. Более высокую теплопроводность имеют исключительно медь и серебро. Именно благодаря данному свойству данный металл используют для производства радиаторов охлаждения и теплообменников.
Удельная теплоемкость алюминия, как и температура его плавления, достаточно высока. Данные показатели значительно превышают аналогичные значения большей части металлов. С повышением чистоты металла увеличивается и его способность отражать от поверхности световые лучи. Алюминий хорошо поддается полировке и прекрасно анодируется.
Металл близок по свойствам к кислороду, его поверхность на воздухе быстро затягивается пленкой из оксида алюминия – тонкой и прочной. Обладая антикоррозионными свойствами, она защищает металл от образования ржавчины и предупреждает дальнейшее окисление. Алюминий не взаимодействует с азотной кислотой (концентрированной и разбавленной) и органическими кислотами, он стоек к воздействию пресной, соленой воды.
Эти особенности алюминия придают ему устойчивость к коррозии, что и используется людьми. Именно поэтому его особенно широко применяют в строительстве. Интерес к нему увеличивается еще и по причине его легкости в сочетании с прочностью и мягкостью. Такие характеристики есть далеко не у всякого вещества.
Помимо вышеуказанных, алюминий имеет еще несколько интересных физических свойств:
- Ковкость и пластичность – алюминий стал материалом изготовления прочной и легкой тонкой фольги, а также проволоки.
- Плавление происходит при температуре +660 °С.
- Температура кипения +2 450 °С.
- Плотность – 2,7 г/см³.
- Наличие объемной гранецентрированной металлической кристаллической решетки.
- Тип связи – металлический.
Области использования алюминия определяются его химическими и физическими свойствами. Характеристики металла, рассмотренные выше, применяются в бытовых целях.
Основные химические свойства алюминия
С химической точки зрения алюминий является чрезвычайно сильным восстановителем, имеющим способность в чистом виде быть высоко активным веществом. Основное условие – убрать оксидную пленку.
Алюминий способен вступать в реакции с:
- щелочными соединениями;
- кислотами;
- серой;
- галогенами.
Алюминий не взаимодействует в обычных условиях с водой. Йод – единственный из галогенов, с которым у металла происходит реакция без нагревания. Для взаимодействия с прочими требуется увеличение температуры.
Рассмотрим несколько примеров, показывающих химические свойства данного металла. Это уравнения, иллюстрирующие взаимодействие с:
- щелочами: 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2;
- кислотами: AL + HCL = AlCL3 + H2;
- серой: 2AL + 3S = AL2S3;
- галогенами: AL + Hal = ALHal3.

Основным свойством алюминия считается его способность восстанавливать иные вещества из их соединений.
Реакции его взаимодействия с оксидами иных металлов хорошо показывают все восстановительные свойства вещества. Алюминий прекрасно выделяет металлы из различных соединений. Примером может служить: Cr2O3 + AL = AL2O3 + Cr.
Металлургическая промышленность активно использует эту способность алюминия. Методика получения веществ, которая основывается на данной реакции, называется алюминотермия. Химическая индустрия использует алюминий чаще всего для получения иных металлов.
Как применяют основные свойства алюминия
Алюминий в чистом виде имеет слабые механические свойства. Именно поэтому наиболее часто применяют его сплавы.
Таких сплавов достаточно много, вот основные из них:
- алюминий с марганцем;
- дюралюминий;
- алюминий с магнием;
- алюминий с медью;
- авиаль;
- силумины.

В основе этих сплавов лежит алюминий, отличаются они исключительно добавками. Последние же делают материал прочным, легким в обработке, более стойким к износу, коррозии.
Есть несколько основных областей применения алюминия (чистого или в виде сплава). Из металла изготавливают:
- фольгу и проволоку для бытового использования;
- посуду;
- морские и речные суда;
- самолеты;
- реакторы;
- космические аппараты;
- архитектурные и строительные элементы и конструкции.
Алюминий является одним из самых важных металлов наравне с железом и его сплавами. Эти два элемента таблицы Менделеева наиболее широко применяются человеком в своей деятельности.
Как используют основные свойства алюминия в строительстве
Строительство – одна из основных отраслей-потребителей алюминия. 25 % всего вырабатываемого металла используется именно в ней. Современный облик мегаполисов был бы невозможен без использования алюминия. Он дает возможность создавать функциональные и красивые здания, стремящиеся ввысь. Небоскребы офисных центров имеют фасады из стекла, закрепленные на прочных, легких рамах из алюминия.
Современный облик мегаполисов был бы невозможен без использования алюминия. Он дает возможность создавать функциональные и красивые здания, стремящиеся ввысь. Небоскребы офисных центров имеют фасады из стекла, закрепленные на прочных, легких рамах из алюминия.
Современные торговые, развлекательные и выставочные центры в основе своей имеют каркас из алюминия. Конструкции из данного металла используются для возведения бассейнов, стадионов и других спортивных строений. Алюминий – один из самых востребованных у архитекторов, строителей, дизайнеров металлов. Почему? Давайте разберемся.
Алюминий – прочный и легкий металл, не поддающийся коррозии, имеющий долгий срок службы и совершенно нетоксичный. Он легко поддается обработке, сварке, паянию, его просто сверлить, распиливать, связывать и соединять шурупами. Этот металл способен принять любую форму посредством экструзии. Алюминий поможет воплотить самый смелый замысел архитектора. Из него изготавливаются конструкции, которые невозможно сделать из иных материалов: пластика, дерева или стали.
За прошлый век алюминий прошел путь от металла, редко используемого в строительстве из-за дороговизны и недостаточных объемов производства, до наиболее часто применяемого. 1920-е годы стали переломными. Благодаря электролизной технологии значительно снизилась стоимость его производства – в 5 раз. Алюминий стали применять в производстве стеновых панелей и водостоков, декоративных элементов, а не только для сводов и отделки крыш.
Empire State Building – первый небоскреб, при возведении которого широко применялся алюминий. Он был построен в 1931 году и оставался самым высоким в мире до 1970 г.
Алюминий активно использовался в конструкциях этого здания. В интерьере его также применяли достаточно широко. Фреска, расположенная на стенах и полке лобби, являющаяся визитной карточкой сооружения, сделана из алюминия и золота в 23 карата.
80 лет – таков минимальный срок эксплуатации конструкций из алюминия. Применение этого металла не ограничено климатическими условиями, его свойства остаются прежними при температурах от -80 °С и до +300 °C. Пожары редко могут разрушить алюминиевые сооружения. Низкие же температуры, наоборот, увеличивают его прочность.
Применение этого металла не ограничено климатическими условиями, его свойства остаются прежними при температурах от -80 °С и до +300 °C. Пожары редко могут разрушить алюминиевые сооружения. Низкие же температуры, наоборот, увеличивают его прочность.
Примером может служить алюминиевый сайдинг. Отражающее покрытие в виде фольги и теплоизоляция создают вместе с ним прекрасную защиту от холода, которая в 4 раза более эффективна, чем облицовка кирпичом толщиной 10 см или камнем толщиной 20 см. Именно поэтому алюминий все чаще можно встретить при строительстве объектов в условиях холодного климата: в РФ – на Северном Урале, в Якутии и Сибири.
Но еще более важным качеством алюминия является его легкость. При одинаковой жесткости пластина из алюминия в два раза легче стальной. И все благодаря низкому удельному весу. Если посчитать, то выйдет, что вес алюминиевой конструкции при равной несущей способности в два, а иногда и в три раза ниже массы стальной и в семь раз ниже железобетонной.
В настоящее время алюминий используют для строительства небоскребов и иных высоких строений. Металл делает здание значительно легче, что удешевляет постройку за счет меньшей глубины фундамента. Ведь чем больший вес имеют сооружения, тем фундамент должен быть глубже. Разводные мосты, выполненные из алюминия, также имеют небольшой вес, что облегчает работу механизмов, противовесы для таких конструкций должны быть минимальными. Данный металл вообще дает возможность архитекторам не ограничивать фантазию. Да и работать с таким легким материалом значительно проще, быстрее и удобнее.
Алюминий, его физические и химические свойства. Химия. 9 класс. Конспект урока
авторы: Козлова Зинаида Аркадьевна, учитель химии высшей квалификационной категории МБОУ «Аксубаевская средняя общеобразовательная школа № 3» Аксубаевского муниципального р-на РТ
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
Цели урока:
- продолжить формирование представлений у учащихся о переходных элементах, умения составлять уравнения химических реакций с участием простых веществ;
- Развитие умений логически рассуждать, обобщать, делать выводы, работать с дополнительной литературой;
- Формирование умений работать в группе, способствовать формированию культуры умственного труда, уверенности в своих силах, воспитание коммуникативности, ответственности .
Оборудование: Алюминий (фольга, пудра, лист, проволока), растворы HCl, H2SO4, CuSO4,пробирки, штативы, дистиллированная вода.
Тип урока: изучение нового материала.
Вид урока: урок-исследование
1. Организационная часть урока
2. Актуализация знаний учащихся
Проверка домашнего задания: самопроверка и самооценка.
(На доске уравнения реакций.)
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. K → K2O → KOH → K2SO4
4K + O2 = 2K2O
K2O + H2O = 2KOH
2KOH + H2SO4 = K2SO4 + H2O
2. Mg → MgO → MgCl2 → Mg(OH)2 → MgO
2Mg + O2 = 2MgO
MgO + 2HCl = MgCl2 + h3O
MgCl2 + 2KOH = Mg(OH)2 + 2KCl
Mg(OH)2 = MgO + H2O
III. Изучение нового материала
1. Учитель: Сегодня вы проведете независимое расследование в удивительном мире металлов. Мы с вами уже познакомились с 2 семействами металлов. И поведем разговор о простом веществе – металле, рассмотрим его с точки зрения разных наук. Ведь, как известно, химия – наука, в которой переплелись и биология, и история и физика. А о каком металле пойдет речь, вы скажете сами, прослушав стих-загадку.
И поведем разговор о простом веществе – металле, рассмотрим его с точки зрения разных наук. Ведь, как известно, химия – наука, в которой переплелись и биология, и история и физика. А о каком металле пойдет речь, вы скажете сами, прослушав стих-загадку.
В тринадцатой квартире
Живу, известный в мире
Как проводник прекрасный.
Пластичен, серебрист.
Еще по части сплавов завоевал я славу
И в этом деле я специалист.
Вот мчусь я, словно ветер,
В космической ракете.
Спускаюсь в бездну моря,
Там знают все меня.
По внешности я видный,
Хоть пленкою оксидной
Покрыт, она мне – прочная броня.
Я мягкий, легкий, ковкий
Сверкаю в упаковке.
Обернуты конфеты блестящею фольгой.
Для плиток шоколада
Меня немало надо,
А раньше был я очень дорогой.
О каком металле пойдет речь?
(На доске появляется словосочетание «Крылатый металл».)
2. Для получения достоверных и разнообразных сведений об алюминии, мы разделимся на оперативные группы: историков, физиков, биологов и геологов. Каждая группа получит инструкцию по проведению расследования и необходимую литературу: учебники, рефераты учащихся, энциклопедию по неорганической химии, журнал «Химия в школе».
У каждого из вас карта независимого расследования. Ваша задача: заполнить все 4 блока по мере поступления сведений об алюминии. Итак, запишем тему урока «Алюминий, его физические и химические свойства».
Историки получают инструкцию и заполняют 1 блок «ИСТОРИЯ», физики – 2 блок «ФИЗИКА», биологи – 3 блок «БИОЛОГИЯ», геологи — 4 блок «ГЕОЛОГИЯ», а за мной остается 5 блок «Химические свойства алюминия.
Каждая группа работает по инструкции в течение 5 минут, затем – устный отчет каждой группы.
Инструкция составления исторической справки группой историков
Цель: Подготовить историческую справку об открытии алюминия.
Порядок действий:
- Прочитайте текст.
- Внесите в блок «ИСТОРИЯ» своей карты расследования сведения об открытии алюминия.
- Подготовьте устный отчет.
Инструкция проведения «следственного эксперимента» группой физиков
Цель: Выявить физические свойства алюминия.
Порядок действий:
- Покажите на таблице кристаллическую решетку алюминия.
- Прочитайте текст.
- Внесите в блок «ФИЗИКА» своей карты расследования сведения о физических свойствах алюминия и подумайте, какое физическое свойство алюминия вы могли бы продемонстрировать сами.
- Подготовьте устный отчет.
Инструкция проведения «биохимического анализа» группой биологов.
Цель: Выявить содержание алюминия в живой природе.
Порядок действий:
- Прочитайте текст.
- В блок «БИОЛОГИЯ» своей карты расследования внесите сведения о содержании алюминия в живых организмах.
- Подготовьте устный отчет.
Инструкция проведения «дактилоскопического исследования » группой геологов.
Цель: Выявить области распространения алюминия.
Порядок действий:
- Прочитайте текст.
- В блоке «ГЕОЛОГИЯ» своей карты расследования обозначьте места распространения алюминия.
- В виде, каких соединений встречается алюминий в природе? Покажите образцы.
- Подготовьте устный отчет.
3. Учитель на доске заполняет такую же карту расследования по мере выступления участников расследования. (Приложение 1.)
4. Учитель: Настало время провести химическую экспертизу предложенных материалов.
– Какова особенность строения атома алюминия?
– Как это отразится на химических свойствах?
– С какими веществами взаимодействует алюминий?
Объяснение учителя с демонстрацией опытов.
1. С неметаллами Г
2; S, C
2. С кислородом O
2 (демонстрация опыта)
3. C водой (при обычных условиях нет)
2 Al + 6 H2O =2Al (OH)3 + 3H2↑
4. С растворами кислот: HCl, H
2SO4 (лабораторный опыт)2Al + 6HCl = 2AlCl3 + 3H2↑
А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную пленку, которая препятствует дальнейшему протеканию реакции.
Где можно использовать это свойство алюминия?
5. С растворами щелочей, образуя алюминаты
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
Вывод: Алюминий – переходный металл.
6. С растворами солей (лабораторный опыт)
2Al + 3CuSO4 = Al2(SO4)2 + 3Cu
7.
 С оксидами металлов (алюминотермия)
С оксидами металлов (алюминотермия)2Al + 3Fe3O4 = Al2O3 + 9Fe
5. Итак, по результатам нашего расследования составьте досье на алюминий.
Алюминий – переходный металл, открытый сравнительно недавно. В химических реакциях – восстановитель с постоянной степенью окисления +3. Взаимодействует с простыми веществами: галогенами, серой, углеродом, кислородом. Также взаимодействует со сложными веществами: с водой, растворами кислот, щелочей. На его свойствах основано широкое применение алюминия в народном хозяйстве.
6. Выводы. Обобщение материала в форме игры «Логические цепочки».
Начало фразы «Алюминий – металл…». Далее ученик повторяет его и составляет предложения, характеризующие алюминий со словами
- «потому что»
- «следовательно»
- «однако»
IV. Итог урока
V.
 Домашнее задание
Домашнее задание§13. Проведите повторный физико-химический анализ – выучите материал по учебнику. Напишите «досье» на алюминий или сказку про алюминий.
Список литературы
- О.С.Габриелян «Химия. 9 класс». М.: Дрофа, 2005.
- О.С.Габриелян, И.Г. Остроумов «Настольная книга учителя. Химия, 9 класс». М.: Дрофа, 2002.
- Г.Е. Рудзитис, Ф.Г.Фельдман «Химия 9». М.: Просвещение, 1989.
- Энциклопедия школьника «Неорганическая химия». М.: Советская энциклопедия, 1975.
- Рефераты учащихся по элективному курсу «Металлы в окружающей среде и здоровье человека».
Физические свойства алюминия
25 августа 2022 г. 25 августа 2022 г. | 9:29
Что такое алюминий? Первый факт об алюминии заключается в том, что он является 13-м элементом в периодической таблице и имеет атомный символ Al. Это серебристо-белый, немагнитный, пластичный металл в естественном состоянии. На его долю приходится 8% земной коры по массе, что делает его самым распространенным металлом на планете.
Это серебристо-белый, немагнитный, пластичный металл в естественном состоянии. На его долю приходится 8% земной коры по массе, что делает его самым распространенным металлом на планете.
Внешний вид алюминия может различаться в зависимости от обработки поверхности. Полированная алюминиевая поверхность отражает примерно 92 процента видимого света. Его также можно использовать для отражения среднего и дальнего инфракрасного излучения.
Плотность большинства коммерческих сортов алюминия составляет 0,0975 фунта/дюйм3. Это примерно треть плотности стали. Это связано с тем, что алюминиевое ядро намного легче, но не заметно меньше. На практике единственные металлы, которые легче алюминия, относятся к группам 1 и 2, которые слишком реакционноспособны для конструкционного использования. Бериллий и магний являются единственными исключениями.
Физические свойства алюминия- За исключением магния, алюминий имеет самую низкую плотность среди всех промышленных металлов.
 Алюминий, при правильном покрытии, является отличным отражателем, особенно ультрафиолетового света.
Алюминий, при правильном покрытии, является отличным отражателем, особенно ультрафиолетового света. - Алюминий — серебристо-белый металл без запаха и вкуса. С увеличением кремния он становится пластичным и мягким. Кубическая структура кристалла алюминия гранецентрирована.
- Образование примесных выделений вызывает концентрацию решетки в менее чистом металле. На большинство других физических свойств также влияет чистота.
- За исключением магния, алюминий имеет самую низкую плотность среди всех коммерческих металлов. Алюминий
- также используется в качестве выборочной холодной или горячей стены, а также в качестве корпуса, который приближается к эффекту черного тела. Отражательная способность алюминия в инфракрасном диапазоне лишь немного выше, чем у золота и серебра.
- Температура плавления технически чистого алюминия составляет приблизительно 1220°F, а температура кипения составляет приблизительно 4478°F.
 При легировании алюминия эти свойства изменяются.
При легировании алюминия эти свойства изменяются.
- Реакция алюминия с воздухом:
В целом металлический алюминий не вступает в реакцию с воздухом, поскольку его поверхность покрыта тонким слоем оксида, защищающим металл от воздушных атак. Если оксидный слой поврежден и оголен металлический алюминий, он снова реагирует с кислородом, образуя амфотерный оксид (оксид алюминия (II)), Al2O3.
2Al2O3 = 4Al (т) + 3O2 (ж) (т)
- Реакция алюминия с кислотами:
Алюминий легко реагирует с минеральными кислотами с образованием растворов, содержащих водный ион Al(II), а также с выделением газообразного водорода, h3. Он растворяется в соляной кислоте (HCl), например, выделяя газообразный водород.
2Al(т) + 6HCl (водн.) + 3h3 2Al3+ (водн.) + 6Cl- (водн.) (г)
В присутствии азотной кислоты реагирует пассивно, образуя на своей поверхности защитный оксидный слой оксида алюминия .
2Al(NO3)3 + 3h3O = Al2O3 + 6 HNO3
- Алюминий Реакция со щелочами:
Алюминий реагирует со щелочами с образованием алюминатов с выделением газообразного водорода и h3. Поскольку кислород и алюминий имеют сравнимую электроотрицательность, алюминий может образовывать ковалентные связи с кислородом. Это важная причина образования алюминатов. Алюминий, например, реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия с выделением газообразного водорода.
2Al(s) + 2NaOH(aq) + 6h3O(g)
Piping Mart
Pipingmart — B2B портал, специализирующийся на промышленной, металлической и трубопроводной продукции. Кроме того, делитесь последней информацией и новостями, касающимися продуктов, материалов и различных типов марок, чтобы помочь бизнесу в этой отрасли.
Алюминий
Алюминий
|