Химия в действии, Ч.2
Химия в действии, Ч.2
Оглавление11. ПЕРИОДИЧЕСКИЙ ЗАКОН11.1 Периодичность СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ПЕРИОДИЧНОСТЬ ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 12. ВОДОРОД И ВОДА 12.1. ВОДОРОД ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА 12.2 Вода ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ КАЧЕСТВО ВОДЫ ЗАГРЯЗНЕНИЕ ВОДЫ ОЧИСТКА И ПОДГОТОВКА ВОДЫ ОКЕАНЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 13.  s-Металлы s-Металлы13.1 Структура и свойства s-металлов СТРУКТУРА ФИЗИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ 13.2 Соединения, образуемые s-металлами ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ ГИДРОКСИДЫ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ 13.3. Распространенность в природе, получение и применение ПОЛУЧЕНИЕ S-МЕТАЛЛОВ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ ПРИМЕНЕНИЕ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 14. d-ЭЛЕМЕНТЫ 14.1. Структура и свойства d-элементов d-ЭЛЕМЕНТЫ ФИЗИЧЕСКИЕ СВОЙСТВА ХИМИЧЕСКИЕ СВОЙСТВА 14.2 Химия семи d-элементов МАРГАНЕЦ ЖЕЛЕЗО КОБАЛЬТ НИКЕЛЬ МЕДЬ 14.3. Распространенность в природе, получение и применения ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 15.  ЭЛЕМЕНТЫ III-VI ГРУПП ЭЛЕМЕНТЫ III-VI ГРУПП15.1. Алюминий и другие элементы III группы БОР ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 15.2. IV группа периодической системы СОЕДИНЕНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД ПРИМЕНЕНИЯ УГЛЕРОДА ПРИМЕНЕНИЯ КРЕМНИЯ ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА 15.3. Элементы V группы РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА СОЕДИНЕНИЯ АЗОТА СОЕДИНЕНИЯ ФОСФОРА 15.4. Элементы VI группы. Кислород и сера КИСЛОРОД СОЕДИНЕНИЯ КИСЛОРОДА СЕРА СОЕДИНЕНИЯ СЕРЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ 16.1. Галогены ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ 16.2. Соединения галогенов ГАЛОГЕНОВОДОРОДЫ КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ 16.  3. Распространенность, получение и применение галогенов и их соединений 3. Распространенность, получение и применение галогенов и их соединенийПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ 16.4. Благородные газы СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ 7.1. Органическая химия НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ УГЛЕВОДОРОДЫ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 17.2. Молекулярная структура органических соединений КОНФОРМАЦИИ СТЕРЕОИЗОМЕРИЯ 17.3. Механизмы органических реакций ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 18. УГЛЕВОДОРОДЫ 18.1. Алифатические углеводороды АЛКАНЫ АЛКЕНЫ АЛКИНЫ 18.2. Арены БЕНЗОЛ МЕТИЛБЕНЗОЛ 18. 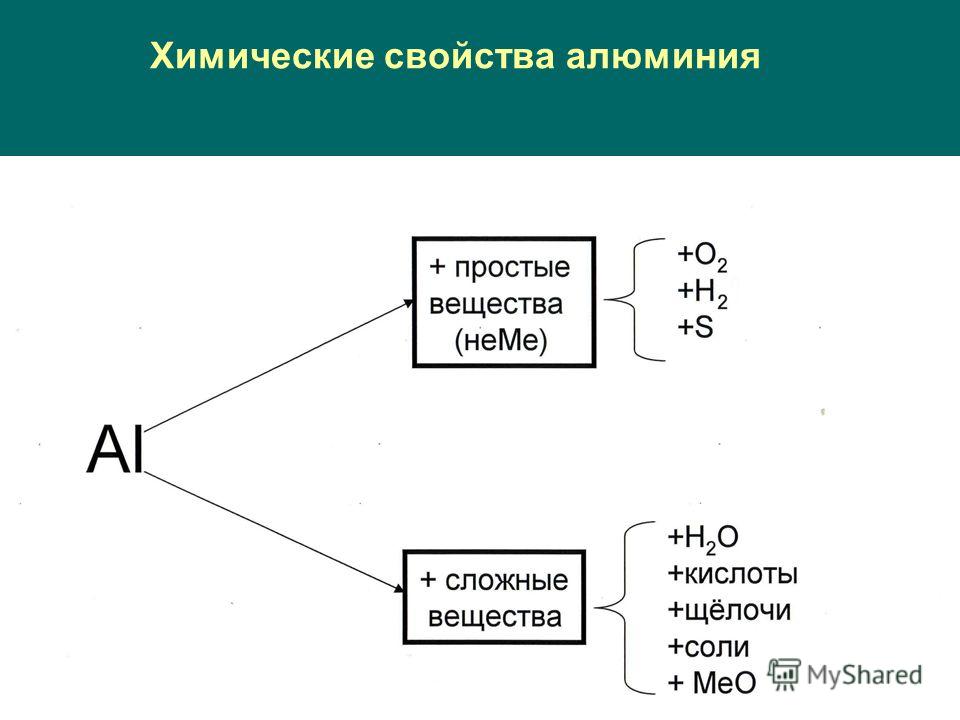 3. Природные источники, получение и применения 3. Природные источники, получение и примененияПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ ПЕРЕРАБОТКА НЕФТИ ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ 19.1. Органические галогенсодержащие соединения ГАЛОГЕНОАЛКЕНЫ ГАЛОГЕНОАРЕНЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ 19.2. Спирты, фенолы и эфиры ФЕНОЛЫ ПРОСТЫЕ ЭФИРЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ 19.3. Карбонильная группа ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ КАРБОНОВЫЕ КИСЛОТЫ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ АМИДЫ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ 19.4 Амины и родственные соединения СОЛИ ДИАЗОНИЯ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ 20.  1. Аминокислоты, пептиды и белки 1. Аминокислоты, пептиды и белкиАМИНОКИСЛОТЫ ПЕПТИДЫ БЕЛКИ 20.2. Углеводы и нуклеиновые кислоты НУКЛЕИНОВЫЕ КИСЛОТЫ 20.3. Жиры, масла и другие природные соединения ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ ВОСКИ ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ АЛКАЛОИДЫ 20.4. Полимеры ПОЛИМЕРИЗАЦИЯ НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО ВОПРОСЫ ДЛЯ ПРОВЕРКИ ПРИЛОЖЕНИЯ |
Алюминий, физические и химические свойства алюминия, оксида и гидроксида алюминия.
Алюминий
Нахождение в природе.
Алюминий – самый распространённый металл на Земле ( 3-е место после кислорода и кремния среди всех элементов). Общее содержание его в земной коре составляет около 9% по массе. Он встречается в соединениях, важнейшим из которых являются известные вам алюмосиликаты, составляющие основную массу земной коры, бокситы Al2O3 ∙ nh3O – горная порода, из которой получают алюминий, и коруд Al2O3.
Корунд, представляющий собой прозрачные кристаллы, окрашенные примесями в красный (рубины) и синий (сапфиры) цвет, являются самыми драгоценными камнями.
Физические свойства.
Алюминий – легкий серебристо-белый металл, плавится при температуре 600ºC. Он очень пластичен, легко вытягивается в проволоку и прокатывается в листы и фольгу толщиной менее 0.01 мм, хорошо проводит теплоту и электрический ток. С этим связано применение алюминия для изготовления электрических проводов.
Химические свойства.
Алюминий – активный металл, сильный восстановитель, поэтому он взаимодействует:
- С кислородом:
4Al + 3O2 = 2Al2O3
2 . С другими неметаллами при нагревании ( кроме реакций с галогенами):
2Al + 3Br2 = 2AlBr3 (бромид алюминия)
2Al + N2 = 2AlN (нитрид алюминия)
2Al + 3I2 = 2AlI3 (йодид алюминия)
2Al + 3S = Al2S3 (сульфид алюминия)
2Al + 3Br2 = 2AlBr3 (бромид алюминия)
3. С оксидами металлов:
С оксидами металлов:
2Al + Fe2O3 = 2Fe + Al2O3
4. С водой:
2Al + 6h3O = 2Al(OH)3 + h3
5. С растворами щёлочей:
2Al + 2NaOH + 2h3O = 2Na Al(OH) 4 + 3H 2
* Метаалюминат натрия
6. С разбавленными кислотами :
2Al + 6HCl = 2AlCl3 + 3h3
2Al + 6h3O = 2Al(OH)3 + h3
Реакция алюминия с разведенной серной кислотой протекает не достаточно интенсивно, что объясняется наличием на поверхности алюминия защитной оксидной пленки.
Добавление хлорид-ионов (в виде кристаллов NaCl) способствует разрушению защитной пленки на поверхности металла. Это приводит к значительному ускорению реакции.
Соединения алюминия.
По химическим свойствам это амфотерный оксид. Как основный он реагирует с кислотами:
Al2O3 +6HCl = 2AlCl3 + 3 h3O
Оксид алюминия Al2O3. Это вещество можно получить сжиганием порошка металлического алюминия или разложением гидроксида алюминия:
2Al(OH)3 = Al2O3 = 3h3O
как кислотный – со щелочами:
Al2O3 + 2NaOH (тверд) = 2NaAlO2* + h3O
метаалюминат натрия
Al2O3 + 2NaOH (раствор) + 3h3O
= 2Na Al(OH)4
Гидроксид алюминия Al(OH)3. Это белое твёрдое вещество, в воде не растворяется; его получают при взаимодействии раствора щелочи с раствором соли алюминия:
AlCl 3 + 3NaOH = Al(OH) 3 + 3NaCl
Как амфотерный гидроксид он реагирует с кислотами и основаниями:
Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O
Al(OH) 3 + NaOH (тверд) = NaAlO 2 + 2H 2 O
Al(OH) 3 + NaOH= Na Al(OH) 4
СПАСИБО за
- ВНИМАНИЕ
Химические свойства алюминия — 3 свойства, применение и решение Пример
Известный элемент «группы 13», который также является членом семейства боров, электронная конфигурация которого 1s2 2s2 2p6 3s2 3p1, известен как алюминий. При добавлении первых трех энтальпий ионизации алюминия могут образовываться ионы AI3+. Он обычно имеет степень окисления +3, а также является электроположительным элементом, как в случае с оксидом алюминия (Al2O3). Другой тип степеней окисления +2 и +1. Его защищает прозрачный слой оксида алюминия (Al2O3), который образуется на воздухе. Алюминий обладает физическими и химическими свойствами, и его использование также можно увидеть.
При добавлении первых трех энтальпий ионизации алюминия могут образовываться ионы AI3+. Он обычно имеет степень окисления +3, а также является электроположительным элементом, как в случае с оксидом алюминия (Al2O3). Другой тип степеней окисления +2 и +1. Его защищает прозрачный слой оксида алюминия (Al2O3), который образуется на воздухе. Алюминий обладает физическими и химическими свойствами, и его использование также можно увидеть.
Чтобы объяснить каковы свойства алюминия, 3 свойства алюминия могут быть описаны следующим образом:
Первым из трех химических свойств алюминия является реакция алюминия с воздухом. Металлический алюминий обычно не реагирует с воздухом, так как его поверхность покрыта оксидным слоем, который защищает покрытие от воздействия воздуха. Если оксидный слой поврежден, можно увидеть обнажение металлического алюминия, который вступает в реакцию с кислородом и способствует образованию амфотерного оксида (оксида алюминия (III)), Al2O3.

4Al (т) + 3O2 (ж) → 2Al2O3 (т)
2Al3+ (водн.) +6HCl (водн.) → 3h3 (г) + 6Cl– (водн.)
Так протекает реакция алюминия с соляная кислота бывает.
Третьим из трех химических свойств алюминия является реакция алюминия со щелочами. Эта реакция приводит к выделению газообразного водорода (h3). Электроотрицательность кислорода и алюминия позволяет алюминию образовывать ковалентные связи вместе с кислородом , если алюминий реагирует с теплым раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия с выделением газообразного водорода.
2Na+ (водн.) + 2[Al (OH)4]– + 3h3 (г) → 2Al (т) + 2NaOH (водн.) + 6h3O
Кроме трех свойств алюминия , которые являются химическими свойствами алюминия , у алюминия мало физических свойств.
Можно объяснить 3 физических свойства алюминия:
Алюминий – это металл серебристого цвета с голубоватым оттенком.

Температура плавления 660°C (1220°F), температура кипения 2327-2450°C (4221-4442°F).
Плотность алюминия составляет 2,708 грамма на кубический сантиметр, он одновременно ковкий и пластичный.
Использование алюминия
Алюминий используется в огромном ассортименте изделий, включая банки, фольгу, кухонную утварь, контуры окон, бочки для пива и детали самолетов. Это связано с его специфическими свойствами. Он имеет малую толщину, не токсичен, обладает высокой теплопроводностью, обладает невероятной коррозионной стойкостью и может легко отливаться, подвергаться механической обработке и формоваться.
Регулярно используется в качестве сплава, так как алюминий сам по себе нестабилен. Соединения с медью, марганцем, магнием и кремнием легкие, но стабильные. Они имеют большое значение в развитии самолетов и различных видов транспорта.
Биологическая роль алюминия
Помимо трех свойств алюминия – химических свойств алюминия и физических свойств алюминия, такой биологической роли не наблюдается. +3 растворяется в растении, делает его токсичным. Кислые почвы возникают из-за реакции алюминия с HCl , встречающейся в основном на Земле, с высвобождением AI3+ из их минералов, которые поглощают сельскохозяйственные культуры.
Решенный пример
1. Что происходит при реакции алюминия с HCl?
В результате реакции алюминия с соляной кислотой образуется жидкий хлорид алюминия, AlCl3, а также газообразный водород, h3.
Сбалансированное химическое уравнение объясняет эту единственную реакцию замещения, то есть
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3h3(g)↑
Помните, что эта реакция алюминия с соляной кислотой не будет происходит, когда мы добавляем кусок алюминия в раствор соляной кислоты. Это связано с тем, что кусок алюминия покрыт слоем оксида алюминия Al2O3, который защищает алюминий от реакции с водой. Соляной кислоте потребуется некоторое время, чтобы пройти через этот слой, но как только это произойдет, реакция пойдет быстрее, т.е. в соляной кислоте можно будет увидеть пузыри.
Соляной кислоте потребуется некоторое время, чтобы пройти через этот слой, но как только это произойдет, реакция пойдет быстрее, т.е. в соляной кислоте можно будет увидеть пузыри.
Интересный факт
В более чем 270 минералах чаще всего встречается алюминий.
Это один из самых распространенных минералов на Земле после кислорода и кремния.
Алюминий в глобальном масштабе является одним из наиболее используемых металлов, не содержащих железа.
Алюминий отражает почти 98% инфракрасных лучей и 92% видимого света.
В настоящее время Австралия является крупнейшим производителем алюминия.
Свойства алюминия (физические и химические)
Физические свойства алюминия:
| Внешний вид | Серебристо-белое твердое вещество. |
| Относительная плотность | 2,7 г/см 3 . |
| Температура кипения | 1484°С. |
| Температура плавления | 660 o С. |
| Твердость | Относительно мягкий металл. |
| Пластичность | Пластичный. Из него можно сделать очень тонкие листы. Поэтому его можно свернуть в фольгу. |
| Пластичность | Податливость. Возможность формовки или изгиба. |
| Проводимость | Хороший проводник тепла и электричества. |
| Кристаллическая структура | Куб. |
| Прочность на растяжение | Умеренная прочность на растяжение, но высокая в сплавах. |
Химические свойства алюминия
К химическим свойствам алюминия относятся следующие:
1.
 Реакция с воздухом:
Реакция с воздухом:На воздухе алюминий реагирует с кислородом с образованием оксида алюминия, Al 2 O 3 .
При обычной температуре и давлении этот оксид появляется в виде тонкого слоя на поверхности алюминия, который предотвращает дальнейшую реакцию с атмосферным кислородом, водой или паром при нормальных условиях. Поэтому говорят, что алюминий не подвержен коррозии.
Однако, если температуру повысить до 800 o C и выше, оставшийся алюминий будет реагировать с кислородом и азотом воздуха с образованием оксида алюминия Al 2 O 3 и нитрида AlN соответственно.
4Al (s) + 3O 2(g) → 2Al 2 O 3(s)
2Al (s) + N 2(g) → 2AlN (s)
2. Реакция с неметаллами:
Нагретый алюминий соединяется с рядом неметаллов, таких как галогены, сера, азот, фосфор и углерод, с выделением тепла.
Например, 2Al (s) + 3Cl 2 (g) → 2AlCl 3 (s)
3.
 Реакция с кислотами:
Реакция с кислотами:Алюминий медленно реагирует с разбавленной HCl, но быстрее с конц. HCl, Dixplaing Hydrogen
2AL (S) + 6HCl (AQ) → 2ALCL 3 (AQ) + 3H 2 (G)
HOR Concentration of H 2 40196 40196 40196 40196 40196 40196 40196. для выделения оксида серы(IV), SO 2 .
2Al (s) + 6H 2 SO 4(aq) → Al 2 (SO 4 ) 3(aq) + 6H 2 O (l) + 3SO 2( g)
Алюминий не реагирует с триоксонитратной(V) кислотой, HNO 3 как в разбавленном, так и в концентрированном состоянии. Это связано с образованием на его поверхности защитного тонкого слоя оксида алюминия. Следовательно, алюминиевые контейнеры обычно используются при транспортировке HNO 3 .
4. Реакция со щелочами:
В щелочах, таких как гидроксид натрия или гидроксид калия, алюминий растворяется с образованием комплексной соли с выделением водорода.

