5. Коэффициент растворимости нитрата алюминия при 20oC равен 62.6, а при 70oC – 122.2. Какая масса кристаллогидрата Al(no3)3∙9h3o выделится при охлаждении∙20.0 г насыщенного при 70oC раствора до 20oC?
6. Во сколько раз увеличится скорость реакции, имеющей энергию активации 20.0 кДж/моль, при повышении температуры с 20oC до 70oC?
7. В реакции N2 + 3H2 = 2NH3 начальные концентрации веществ были равны 6.7 моль/дм3 и 10.8 моль/дм3 соответственно, а равновесная концентрация NH3 составила 9.4 моль/дм3.. Найдите равновесные концентрации остальных веществ и константу равновесия.
8. Рассчитайте,
самопроизвольна ли в стандартных
условиях реакция CO(г) + Cl2(г) = COCl2(г).
Если реакция несамопроизвольна, укажите
температуру, выше (ниже) которой она
становится самопроизвольной (и наоборот,
если самопроизвольна, укажите температуру,
выше (ниже) которой она становится
несамопроизвольной).
9. Рассчитайте константу
гидролиза K3PO
10. Составьте уравнение реакции окисления антрацена C14H10 перманганатом калия в нейтральной (по окончании – слабощелочной) среде и расставьте в нем коэффициенты методом полуреакций, если известно, что при этом образуется антрахинон C14H8O2.
11. Рассчитайте ЭДС гальванического элемента, состоящего из следующих электродов: Fe, погруженный в раствор FeSO4 концентрацией 0.01 моль/дм3, и Cd, погруженный в раствор CdCl2 концентрацией 0.3 моль/дм3. Элемент находится при стандартной температуре.
12. Рассчитайте концентрацию иодид-ионов в растворе K2[HgI4] c массовой долей 0.05% ( = 1.00 г/см3).
Вариант 9
1.
2. С помощью справочных данных вычислите стандартную энтальпию сгорания фосфина PH3.
3. Определите тепловой эффект растворения вещества (кДж/моль), если при растворении 1.01 г этого вещества в 150 г воды температура в калориметре уменьшилась на 0.26oC. Молярная масса вещества 72 г/моль, постоянная калориметра 73 Дж/К
4. В 200 г воды растворили 40.00 г CoCl2∙6H2O. Плотность полученного раствора равна 1.123 г/см3. Рассчитайте 1) массовую долю 2) молярную долю 3) массовую концентрацию 4) молярную концентрацию 5) моляльность данного раствора.
5. Коэффициент
растворимости сульфата железа (II)
алюминия при 10 8,
а при 50oC
– 48.4. Какая масса
кристаллогидрата FeSO4∙7H2O
выделится при охлаждении∙50.0
г насыщенного при 50oC
раствора до 10oC?
8,
а при 50oC
– 48.4. Какая масса
кристаллогидрата FeSO4∙7H2O
выделится при охлаждении∙50.0
г насыщенного при 50oC
раствора до 10oC?
6. Во сколько раз увеличится скорость реакции, имеющей энергию активации 15.0 кДж/моль, при повышении температуры с 20oC до 100oC?
7. В реакции 2CH4(г) = C2H2(г) + 3H2(г). начальная концентрация вещества была равна 2.1 моль/дм3, а равновесная концентрация H2 составила 2.8 моль/дм3. Найдите равновесные концентрации остальных веществ и константу равновесия.
8. Рассчитайте,
самопроизвольна ли в стандартных
условиях реакция CH4(г) + H2O(г) = CO(г) + 3H 2(г) Если реакция несамопроизвольна, укажите
температуру, выше (ниже) которой она
становится самопроизвольной (и наоборот,
если самопроизвольна, укажите температуру,
выше (ниже) которой она становится
несамопроизвольной).
9. Рассчитайте константу гидролиза CdCl2, а также степень гидролиза и pH в растворе этой соли с концентрацией 0.01 моль/дм3.
10. Составьте уравнение реакции окисления орто-ксилола C8H10 перманганатом калия в нейтральной (к концу реакции – слабощелочной) среде и расставьте в нем коэффициенты методом полуреакций, если известно, что при этом образуется фталат калия C8H4O4K2.
11. Рассчитайте
ЭДС гальванического элемента, состоящего
из следующих электродов: Ni,
погруженный в раствор NiCl2 концентрацией 0.1 моль/дм
12. Рассчитайте концентрацию аммиака в растворе [Ni(NH3)6]SO4 c массовой долей 0.3% ( = 1.00 г/см3).
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 10
Количество вещества n (моль)
n=m\M
n=V\22. 4 (л\моль)
4 (л\моль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем \ массу \ кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4.Определите массу карбоната натрия количеством вещества 0.25 моль.
Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории: |
(Правила комментирования)
Напишите формулу и рассчитайте молярную массу нитрата алюминия.
Последняя обновленная дата: 23 февраля 2023
•
Всего просмотров: 236,7K
•
Просмотр сегодня: 2,22K
Ответ
Проверено
что соль азотной кислоты и алюминия представляет собой азотнокислый алюминий. Он выглядит как белое твердое вещество и растворяется в воде.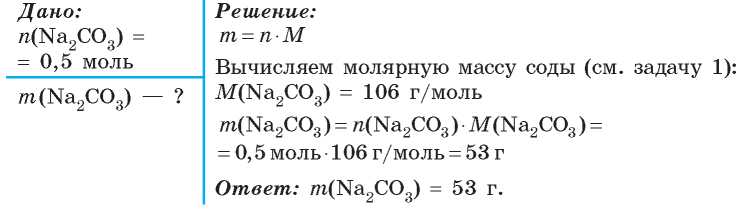 Мы можем рассчитать молярную массу соединения, используя атомную массу каждого элемента, присутствующего в соединении. Молярная масса нитрата алюминия с использованием атомной массы алюминия, атомной массы азота и атомной массы кислорода.
Мы можем рассчитать молярную массу соединения, используя атомную массу каждого элемента, присутствующего в соединении. Молярная масса нитрата алюминия с использованием атомной массы алюминия, атомной массы азота и атомной массы кислорода.
Полный пошаговый ответ:
Мы должны знать, что нитрат алюминия скорее может образовываться в результате реакции азотной коррозионной среды с хлоридом алюминия (III). В результате образуется нитрозилхлорид; он поднимается из устройства в виде газа. Тем более выгодно, что соль может быть получена реакцией на азотную кислоту с гидроксидом алюминия.
Алюминий в основном встречается в земной коре в сочетании с такими элементами, как кремний, кислород и фтор. $Al{\left( {N{O_3}} \right)_3}$ — химическая формула нитрата алюминия.
Мы можем определить молярную массу соединения по атомной массе каждого элемента, содержащегося в соединении.
Атомная масса алюминия составляет 26,98 а.е.м.$.
Атомная масса азота составляет 14,01 а. е.м.$.
е.м.$.
Атомная масса кислорода составляет 16,00 а.е.м.$.
Молярная масса $Al{\left( {N{O_3}} \right)_3}$ рассчитывается как
Молярная масса $Al{\left( {N{O_3}} \right)_3}$= $26,98 + 3\left( {14,01 + 16 \times 3} \right)$
Молярная масса $Al{\left( {N{O_3}} \right)_3}$=$213,01г/моль$
Молярная масса $Al{\left({N{O_3}} \right)_3}$ составляет $213,01 г/моль$. 9\circ C$ соответственно. Некоторые из применений нитрата алюминия включают:
1. Мощный окислитель
2. Ингибитор коррозии
3. Переработка нефти
4. Ламинаторы сердечника в трансформаторах
5. Извлечение урана
6. Извлечение актинидных элементов использует гидратированные соли нитрат алюминия.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверки 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класса 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды A Кальций класс 12 химия JEE_Main
Тенденции сомнений
Видео с вопросами: Определение количества атомов кислорода, присутствующих в данном количестве молей нитрата алюминия
Стенограмма видео
Сколько атомов кислорода в 4,0 умножить на 10 на три отрицательных моля Al(NO3)3? Дайте ответ с точностью до одной запятой место.
Моль — единица количества в системе СИ вещества. Один моль вещества равен 6,02214076 умножить на 10 в 23 степени сущностей. Это значение известно как Авогадро. число. Нам часто не нужно использовать Число Авогадро с таким уровнем точности и может округлить значение до 6,022 раза. 10 в 23 степени. Сущности могут относиться к любому объекту который подсчитывается, но в химии часто относится к атомам, молекулам, формульные единицы или частицы.
С этой справочной информацией в
ум, вернемся к вопросу. Мы хотим посчитать количество
атомов кислорода там, учитывая моли нитрата алюминия. Мы знаем из определения
моль, что один моль нитрата алюминия будет содержать 6,022 умножить на 10 в 23-й степени.
формульные единицы нитрата алюминия. Мы знаем, что начинаем с 4.0
умножить на 10 на отрицательную треть молей нитрата алюминия. Мы можем умножить это значение на наше
отношение, записанное в виде дроби, с молями нитрата алюминия в
в знаменателе, так что единицы молей нитрата алюминия сокращаются. Выполнение расчета дает нам
значение 2,4088 умножить на 10 до 21-й формульной единицы нитрата алюминия.
Мы знаем из определения
моль, что один моль нитрата алюминия будет содержать 6,022 умножить на 10 в 23-й степени.
формульные единицы нитрата алюминия. Мы знаем, что начинаем с 4.0
умножить на 10 на отрицательную треть молей нитрата алюминия. Мы можем умножить это значение на наше
отношение, записанное в виде дроби, с молями нитрата алюминия в
в знаменателе, так что единицы молей нитрата алюминия сокращаются. Выполнение расчета дает нам
значение 2,4088 умножить на 10 до 21-й формульной единицы нитрата алюминия.
Глядя на химическую формулу
нитрата алюминия, мы видим, что каждая формульная единица нитрата алюминия содержит три
нитрат-ионы. И каждый нитрат-ион содержит три
атомы кислорода. Это означает, что одна формульная единица
нитрат алюминия имеет девять атомов кислорода. Мы знаем, что 2,4088 раз
10 к 21-й формульной единице нитрата алюминия в 4,0 раза 10 к минусу
трети моля нитрата алюминия.


 Определите массу карбоната натрия количеством вещества 0.25 моль.
Определите массу карбоната натрия количеством вещества 0.25 моль.