Оборудование + Технология изготовления 2018

Спиртовая промышленность занимается производством этилового спирта из пищевого или не пищевого сырья.
Этиловый спирт, который производится из пищевых сырья, далее идет в производство алкогольных напитков, на изготовление автомобильного топлива и нужд радиоэлетроники.
В качестве сырья для получения пищевого спирта используется картофель, зерновые, корнеплоды, сахарная патока или меласса, плодово-ягодное сырье и виноградные продукты – материал, который богат углеводами.
В качестве сырья для получения технического спирта используются отходы деревоперерабатывающей или нефтеперерабатывающей отраслей. Последнее время все больше внимание уделяется использованию растительной биомассы в качестве исходного материала для получения спирта. Их подвергают кислотному гидролизу. Полученный продукт содержит большое количество вредных примесей и поэтому в пищевой промышленности технический спирт категорически запрещен к использованию.
Оборудование для производства спирта
Оборудование для производства состоит из трех отделов – бражной колонны, эпюрационной колонны и ректификационной колонны.
Основная линия производства состоит из следующего оборудования: нория, бункер надвесовой, весы дозатор, бункер подвесовой, шнековый дозатор, дробилка, смесители, чанок замеса, краны трехходовые, краны шаровые, вентиля, задвижки, трубопроводы ,насос центробежный, контактная головка, варочный аппарат, (низкотемпературное разваривание), насосы для перекачки сусла, насос дозатор, теплообменник сусла, краны трехходовые и шаровые с обратными клапанами, бродильные аппараты, дрожжанки, ловушка и маточник, насос для подачи бражки и дрожжевой, мерник серной кислоты, спиртоловушку, емкость промывных вод, подогреватель бражки, водяная секция подогревателя, конденсаторы, сепаратор, бардорегулятор, спиртоловушка, дефлегматор, конденсатор и холодильник, пеноловушка, вакуумпрерыватель, гидрозатвор, маслоотделитель, сборник сивушного масла, фонарь спиртовой.
Технология производства спирта + видео как делают
«Технология производства, в целом, состоит из трех последовательностей:
- Очистки сырья от различных примесей, подготовка солода или культуры специально подобранных плесневых грибов;
- Разваривания крахмалосодержащего сырья, процесс осахаривания крахмала, далее идет сбраживание осахаренного продукта и перегонка полученной бражки – это будет сырой спирт.
- И затем сырой спирт подвергается ректификации.
Ректификация – это очистка полученного первоначального сырого спирта. Содержание примесей в сыром спирте настолько высоко, что непосредственное его использование в пищевой промышленности недопустимо.
Вредные примеси, которые образуются в процессе производства этилового спирта – метиловый спирт — как продукт распада пектина, содержащегося в растительных тканях; сивушные масла – или смесь высших спиртов – их провоцирует изначально гидролиз белка, и последующее дезаминирование аминокислот, плюс некоторые промежуточные продукты спиртового брожения также могут провоцировать появление сивушных масел; сложные эфиры, фурфурол. Сложные эфиры также появляются в результате процессов брожения, когда этиловый спирт взаимодействует с сивушными маслами и органическими кислотами.
Все примеси классифицируются как промежуточные, хвостовые или головные.
Во время очистки используется разница кипения спиртов и эфиров. У этилового спирта температура кипения выше по сравнению с головными примесями – уксусным альдегидом, сложными эфирами. И в то же время у этилового спирта температура кипения ниже по сравнению с хвостовыми примесями – сивушными маслами и метиловым спиртом. Самую большую сложность представляют в процессе очистки именно промежуточные примеси.
Во время ректификации готовый продукт насыщается спиртом с восьмидесяти восьми процентов до 90-90,5%.
Кроме сивушных масел, в процессе производства этилового спирта получают еще барду и углекислый газ.
Сивушные масла перегоняют и получают высшие спирты, которые в дальнейшем будут использоваться в различных отраслях промышленности – медицинской, парфюмерной или лакокрасочной.
Углекислый газ очищается и сжижается или идет на производство сухого льда.
Послеспиртовая барда просушивается и идет на производство кормовых дрожжей, которые применяются в животноводстве в качестве кормовой добавки.
Классификация первоначального спирта-сырца идет в зависимости от содержания в нем посторонних примесей: Альфа, Люкс, Экстра, базис, высшей очистки, 1 сорт.
Технология гидролиза получила распространение по причине сокращения ископаемого органического сырья. Гидролиз позволяет получать спирт из растительной биомассы, которая является возобновляемым биоресурсом. Кроме гидролизного спирта выделяют еще и синтетический спирт. Его производство основывается на смешивании газа этана с водой под высоким давлением. При этом вода и газ не очищаются, в результате реакции образовываются побочные продукты, которые токсичны для организма человека.
Для того чтобы выделить технический спирт и сделать его непригодным для использования в пищевых целях, в его состав добавляют ингредиенты, которые изменяют его вкус и цвет с запахом – цвет чаще получается с синефиолетовым оттенком. К добавкам, которые используются в качестве денатурата, предъявляются определенные требования – низкая токсичность, чтобы снизить риск отравления и смертельного исхода, специфичность вкуса и цвета, стойкость в качестве маркера, чтобы его было сложно отделить от этилового спирта с применением современных технологических процессов и оборудования.
Видео как делают на водочном производстве:
На сегодняшний день большинство гидролизных заводов на территории России входят в состав министерства медицинской и микробиологической промышленности.
moybiznes.org
Производство этилового спирта
Московская Государственная Академия
Тонкой Химической Технологии
им. М.В. Ломоносова
Кафедра общей химической технологии
Курсовая работа
на тему: «Производство этилового спирта»
Москва
2003 г
Содержание
1. Введение
2. Исходное сырьё
3. Характеристика целевого продукта
4. Физико-химическое обоснование основных процессов производства этилового спирта
5. Описание технологической схемы процесса производства этилового спирта
6. Материальный баланс ХТС производства этанола на 9000кг 100% С2 Н5 ОН
7. Расчет основных технологических показателей процесса
8. Литература
1. Введение
Этиловый спирт находит широкое применение в народном хозяйстве в качестве растворителя, также применяется в производстве дивинила, в пищевой и медицинской промышленности, в качестве горючего для ракетных двигателей, антифриза и т.д., является важным промежуточным продуктом органического синтеза (в производстве сложных эфиров, целлулоида, искусственного шелка, ацетальдегида, уксусной кислоты, хлороформа, хлораля, диэтилового эфира и других продуктов).
Таким образом, этиловый спирт относится к числу многотоннажных продуктов основного органического синтеза, мировое производство этилового спирта составляет свыше 2,5 млн. т/г (по объему производства занимает первое место в мире среди всех органических продуктов).
2. Характеристика исходного сырья
В качестве исходного сырья в производстве этилового спирта используется этилен. В настоящее время основным способом его получения является пиролиз (высокотемпературный крекинг) углеводородов. Пиролизу подвергают фракции прямой перегонки нефти, состоящие алканов, циклоалканов, аренов, природные и попутные нефтяные газы, содержащие алканы.
Этилен образуется в результате реакций распада тяжелых алканов и дегидрирования низкомолекулярных алканов. Потенциальный выход этилена зависит от вида исходного сырья. Виды сырья, используемые в мировом производстве этилена, и их доля в общем балансе производства следующие:
Лучшим сырьем являются парафины, поскольку с повышением содержания водорода в исходных углеводородах выход алкенов возрастает.
3. Характеристика целевого продукта
Этанол C2 H5 OH является жидкостью, кипящей при температуре 78,390 С, с воздухом образует взрывоопасные смеси в пределах концентраций 3-20% (по объему). С водой дает азеотропную смесь, содержащую 95,6% спирта и кипящую при температуре 78,10 С. В виде такого ректификата этиловый спирт обычно и употребляют в технике.
4.Физико-химическое обоснование основных процессов производства этилового спирта
До недавнего времени производство этилового спирта основывалось на пищевом сырье – сбраживание крахмала из некоторых зерновых культур и картофеля с помощью ферментов, вырабатываемых дрожжевыми грибками. Этот способ сохранился и до сих пор, но он связан с большими затратами пищевого сырья и не может удовлетворить промышленность. Другой метод, также основанный на переработке растительного сырья, заключается в переработке древесины (гидролизный спирт). Древесина содержит до 50% целлюлозы, и при ее гидролизе водой в присутствии серной кислоты образуется глюкоза, которую подвергают затем спиртовому брожению:
(C6 H10 O5 )x + xH2 O — xC6 H12 O6 ,
C6 H12 O6 — 2C2 H5 OH + 2CO2 .
Синтетический этиловый спирт получают гидратацией этилена.
Гидратация этилена осуществляется двумя методами: при помощи серной кислоты (сернокислая гидратация) и непосредственным взаимодействием этилена с водяным паром в присутствии катализатора (парофазная каталитическая гидратация).
Сернокислая гидратация этилена
Сернокислый способ, предложенный А.М. Бутлеровым, получил промышленное осуществление только в послевоенные годы. Он состоит из следующих четырех стадий: 1) абсорбция этилена серной кислотой с образованием сернокислых эфиров; 2) гидролиз эфиров; 3) выделение спирта и его ректификация; 4) концентрирование серной кислоты.
Взаимодействие между этиленом и серной кислотой состоит из двух этапов: первый – физическое растворение этилена в серной кислоте и второй — гомогенное взаимодействие обоих компонентов с образованием алкилсульфатов по уравнениям:
C2 H4 + H2 SO4 = C2 H5 OSO3 H
C2 H5 OSO3 H + C2 H4 = (C2 H5 O)2 SO2.
Поглощение (абсорбция) этилена серной кислотой – процесс обратимый, экзотермический (DH=-50232 кДж/моль), протекает с уменьшением объема.
Скорость абсорбции этилена описывается уравнением:
dG/dt = K*F*P*f(с),
где G – количество поглощаемого этилена, t – время, К – коэффициент, зависящий от интенсивности диффузии, и, следовательно, от интенсивности контакта реагентов (барботаж, перемешивание и т.д.), F – поверхность контакта реагентов, Р – парциальное давление этилена, f(c) – множитель, зависящий от концентрации серной кислоты.
Так, абсорбция этилена 93%-ной кислотой протекает в 10 раз медленнее, чем при концентрации 97,5%. Однако, применение для абсорбции этилена олеума нецелесообразно, т.к. при этом снижается выход этанола из-за образования побочных продуктов – сульфосоединений и повышенного образования полимеров.
При прочих равных условиях скорость абсорбции этилена увеличивается с ростом температуры и парциального давления, однако, при температуре выше 900 С начинается интенсивное образование полимеров. Увеличение парциального давления этилена выше 2 МПа становится тоже малоэффективным.
Фактором, ускоряющим процесс абсорбции, является наличие в исходной серной кислоте этилсульфатов, которые, обладая свойствами эмульгаторов, увеличивают поверхность контакта вследствие пенообразования, и тем самым способствуют более быстрому и полному растворению этилена.
В настоящее время в промышленных установках приняты следующие условия абсорбции этилена: концентрация серной кислоты 97-98%, температура 80-850 С, парциальное давление этилена на входе в абсорбер 1-1,5МПа, содержание пропилена и высших олефинов в исходной этилен-этановой фракции <0,1%. В ходе второй стадии идет гидролиз этил — и диэтилсульфата по уравнениям:
C2 H5 OSO3 H + H2 O — C2 H5 OH + H2 SO4 ,
(C2 H5 O)2 SO2 + 2H2 O — 2 C2 H5 OH + H2 SO4
Эта стадия также обратима, для обеспечения ее протекания необходим избыток воды, и, по возможности, быстрое удаление спирта из зоны реакции, т.к. кроме основной реакции идет образование диэтилового эфира:
(C2 H5 O)2 SO2 + C2 H5 OH — C2 H5 OC2 H5 + C2 H5 OSO3 H,
(C2 H5 O)2 SO2 + H2 O — C2 H5 OC2 H5 + H2 SO4.
Главным преимуществом сернокислой гидратации по сравнению с прямой гидратацией является возможность применения неконцентрированного этилена, т.к. его концентрирование связано с большими капитальными и эксплуатационными затратами.
Однако, метод сернокислой гидратации имеет ряд недостатков. Среди них можно отметить следующие:
— применение сложных и громоздких конструкций;
— малоэффективное удаление полимеров однократным экстрагированием. При принятом методе экстрагирования в экстракт переходит 70-75% полимеров, значит, до 30% полимеров остается в разбавленной кислоте;
— концентрирование отработанной серной кислоты. Эта часть технологического процесса является самым слабым звеном во всем методе сернокислой гидратации. Во-первых, концентрировать кислоту удается лишь до 88-90%, а, во-вторых, такой процесс концентрирования из-за высокой температуры топочных газов приводит к ощутимым потерям серной кислоты от раскисления, сопровождающегося выбросом вредного SO2 в атмосферу;
— неиспользованные возможности экономии энергетических средств.
Парофазная гидратация этилена
Наиболее разработанным применительно к имеющимся промышленным установкам в настоящее время является процесс газофазной гидратации:
CH2 =CH2(г.) + H2 O(г.) = C2 H5 OH(г.) + 41868Дж/моль.
Механизм:
CH2 =CH2 + Н+ « СН3 -СН2+ ,
СН3 -СН2+ + Н2 О « СН3 -СН2 -ОН2+ ,
СН3 -СН2 -ОН2+ « СН3 -СН2 -ОН + Н+ .
Но наряду с основной реакцией идут параллельные и последовательные побочные реакции:
C2 H4 + H2 O = C2 H5 OC2 H5 ,
n(C2 H4 ) = (-CH2 -CH2 -)n .
Таким образом, процесс сложный, обратимый, несмещенный (см. таблицу), экзотермический, протекает с уменьшением объема.
Таб. Равновесный выход этанола.
Следует обратить внимание на два физико-химических фактора, которые определяют основные технологические параметры процесса. Прежде всего, это активность катализатора, которая имеет решающее значение для определения температуры процесса. Катализаторами прямой гидратации могут служить фосфорная кислота и ее соли. Чаще всего используется фосфорная кислота концентрацией 85-87% на таких носителях, как алюмосиликаты, силикагели, пемза и др.; значительная часть кислоты (до 35%) находится в свободном состоянии. Активность этого катализатора является невысокой. Только при температуре 280-300 0 С ее можно считать более или менее приемлемой для промышленных условий. При более высокой температуре в значительной мере развиваются побочные процессы: полимеризация этилена, усиленное образование эфира и т.д.
mirznanii.com
Производство этилового спирта
Производство этилового спирта
Федеральное агентство по образованию
Томский государственный университет (ТГУ)
Химический факультет
Реферат
Тема: Производство этилового спирта
Выполнила:
Солтыс Е.В.
Томск 2013
План
Введение
. Характеристика целевого продукта
. Транспортировка и хранение
. Экологическая безопасность
. Характеристика исходного сырья
. Физико-химическое обоснование основных процессов производства этилового спирта
.1 Спиртовое брожение
.2 Сернокислая гидратация этилена
. Описание технологической схемы процесса производства этилового спирта
.1 Структурная схема процесса
.2 Операторская схема процесса
. Расчет материального баланса ХТС
.1 Блок-схема
.2 Пересчет единиц
.3 Условная постоянная информация
.4 Балансовая математическая модель
.5 Соответствие переменных потокам
.6 Упорядочение переменных
.7 Материальный баланс ХТС производства этанола на 7900 кг этиленэтановой фракции
.8 Расчет основных технологических показателей процесса
.9 Поточная диаграмма
Заключение
Список используемой литературы
Введение
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным радикалом.
Этиловый спирт широко используют в различных областях промышленности и прежде всего в химической. Из него получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы. Спирт является хорошим растворителем и антисептиком. Поэтому он находит применение в медицине, парфюмерии. В больших количествах этиловый спирт идет для получения спиртоводочных изделий.
Таким образом, этиловый спирт относится к числу многотоннажных продуктов основного органического синтеза, мировое производство этилового спирта составляет свыше 2,5 млн. т/г (по объему производства занимает первое место в мире среди всех органических продуктов).
1. Характеристика целевого продукта
Этанол C2H5OH (метилкарбинол, этиловый спирт) — бесцветная подвижная жидкость с жгучим вкусом и характерным запахом, температура кипения 78,39°С, температура плавления -114,15°С, плотность 0,794 т/м3. Этанол смешивается во всех отношениях с водой, спиртами, глицерином, диэтиловым эфиром и другими органическими растворителями. С некоторыми из них (водой, бензолом, этилацетатом, хлороформом) он образует азеотропные смеси различного состава. С водой дает азеотропную смесь, содержащую 95,6% спирта и, кипящую при температуре 78,1°С. В виде такого ректификата этиловый спирт обычно и употребляют в технике. Температура самовоспламенения этанола составляет 422,8°С. С воздухом образует взрывоопасные смеси в пределах концентраций 20% (по объему). Температура вспышки 13,0°С.
А спирт содержащий только доли процента воды — абсолютным спиртом. Такой спирт получают химической обработкой в присутствии водоотнимающих средств (например, свежепрокаленного СаО). Этанол образует алкоголяты с солями кальция и магния, например: CaCl2*4C2H5OH и MgCl2*6C2H5OH.
2. Транспортировка и хранение
Этиловый спирт перевозится в железнодорожных цистернах, автоцистернах, в бочках, бутылях и во флягах автомобильным транспортом в соответствии с Правилами перевозки опасных грузов. Этиловый спирт хранят на складах в специально оборудованных и предназначенных для него металлических резервуарах в соответствии с правилами приемки, хранения, отпуска, транспортирования и учета этилового спирта. Допускается хранить этиловый спирт на складах, предназначенных для хранения огнеопасных продуктов, в упаковке изготовителя.
3. Экологическая безопасность
Этиловый спирт — сильный наркотик. Попадая в организм, он быстро всасывается в кровь и приводит организм в возбужденное состояние, при котором человеку трудно контролировать свое поведение. Употребление спирта часто является основной причиной тяжелых дорожно-транспортных аварий, несчастных случаев на производстве и бытовых преступлений. Спирт вызывает тяжелые заболевания нервной и сердечно-сосудистой систем, а также желудочно-кишечного тракта. Спирт опасен в любой концентрации (водка, настойки, вино, пиво и т.д.). Этиловый спирт, применяемый для технических целей, специально загрязняют дурно пахнущими веществами. Такой спирт называют денатуратом (для этого спирт подкрашивают, чтобы отличить его от
чистого спирта).
4. Характеристика исходного сырья
В качестве исходного сырья в производстве этилового спирта используется этилен. В настоящее время основным способом его получения является пиролиз (высокотемпературный крекинг) углеводородов. Пиролизу подвергают фракции прямой перегонки нефти, состоящие алканов, циклоалканов, аренов, природные и попутные нефтяные газы, содержащие алканы. Этилен образуется в результате реакций распада тяжелых алканов и дегидрирования низкомолекулярных алканов. Потенциальный выход этилена зависит от вида исходного сырья. Виды сырья, используемые в мировом производстве этилена, и их доля в общем балансе производства следующие:
СырьеЭтанПропанБутанБензинГазойльДоля, %36113473
Лучшим сырьем являются парафины, поскольку с повышением содержания водорода в исходных углеводородах выход алкенов возрастает.
5. Физико-химическое обоснование основных процессов производства этилового спирта
.1 Спиртовое брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала, картофеля, риса, кукурузы, источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её схему можно выразить уравнением:
C6h22O6 ? 2C2H5OH + 2CO2
В результате брожения получается раствор, содержащий не более 15 % этанола, так как в более концентрированных растворах дрожжи обычно гибнут. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
Современная промышленная технология получения спирта этилового из пищевого сырья включает следующие стадии:
Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы и т.п.
Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путем — глюкамилаза, амилосубтилин.
Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в бражке спирта.
Брагоректификация. Осуществляется на разгонных колоннах (например, «Комсомолец»).
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ) не является безводным, содержание этанола в нем до 96,6 %. В зависимости от содержания в нем посторонних примесей, его разделяют на следующие категории:
сорт
высшей очистки
базис
Экстра
Люкс
Альфа
Производительность современного спиртового завода около 30000-100000 литров безводного спирта в сутки. Этот способ сохранился и до сих пор, но он связан с большими затратами пищевого сырья и не может удовлетворить промышленность.
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
5.2 Сернокислая гидратация этилена
Сернокислый способ, предложенный А.М. Бутлеровым, получил промышленное осуществление только в послевоенные годы. Он состоит из следующих четырех стадий: 1) абсорбция этилена серной кислотой с образованием сернокислых эфиров; 2) гидролиз эфиров; 3) выделение спирта и его ректификация; 4) концентрирование серной кислоты.
Взаимодействие между этиленом и серной кислотой состоит из двух этапов: первый — физическое растворение этилена в серной кислоте и второй — гомогенное взаимодействие обоих компонентов с образованием алкилсульфатов по уравнениям:
C2h5 + h3SO4 = C2H5OSO3HH5OSO3H + C2h5 = (C2H5O)2SO2.
Поглощение (абсорбция) этилена серной кислотой — процесс обратимый, экзотермический (DH=-50232 кДж/моль), протекает с уменьшением объема.
Скорость абсорбции этилена описывается уравнением:
dG/dt = K*F*P*f(с),
где G — количество поглощаемого этилена, t — время, К — коэффициент, зависящий от интенсивности диффузии, и, следовательно, от интенсивности контакта реагентов (барботаж, перемешивание и т.д.), F — поверхность контакта реагентов, Р — парциальное давление этилена, f(c) — множитель, зависящий от концентрации серной кислоты.
Так, абсорбция этилена 93%-ной кислотой протекает в 10 раз медленнее, чем при концентрации 97,5%. Однако, применение для абсорбции этилена олеума нецелесообразно, т.к. при этом снижается выход этанола из-за образования побочных продуктов — сульфосоединений и повышенного образования полимеров.
При прочих равных условиях скорость абсорбции этилена увеличивается с ростом температуры и парциального давления, однако, при температуре выше 900С начинается интенсивное образование полимеров. Увеличение парциального давления этилена выше 2 МПа становится тоже малоэффективным.
Фактором, ускоряющим процесс абсорбции, является наличие в исходной серной кислоте этилсульфатов, которые, обладая свойствами эмульгаторов, увеличивают поверхность контакта вследствие пенообразования, и тем самым способствуют более быстрому и полному растворению этилена.
В настоящее время в промышленных установках приняты следующие условия абсорбции этилена: концентрация серной кислоты 97-98%, температура 80-850С, парциальное давление этилена на входе в абсорбер 1-1,5МПа, содержание пропилена и высших олефинов в исходной этилен-этановой фракции <0,1%. В ходе второй стадии идет гидролиз этил — и диэтилсульфата по уравнениям:
C2H5OSO3H + h3O à C2H5OH + h3SO4,
(C2H5O)2SO2 + 2h3O à 2 C2H5OH + h3SO4
Эта стадия также обратима, для обеспечения ее протекания необходим избыток воды, и, по возможности, быстрое удаление спирта из зоны реакции, т.к. кроме основной реакции идет образование диэтилового эфира:
(C2H5O)2SO2 + C2H5OH à C2H5OC2H5 + C2H5OSO3H,
(C2H5O)2SO2 + h3O à C2H5OC2H5 + h3SO4.
Главным преимуществом сернокислой гидратации по сравнению с прямой гидратацией является возможность применения неконцентрированного этилена, т.к. его концентрирование связано с большими капитальными и эксплуатационными затратами.
Однако, метод сернокислой гидратации имеет ряд недостатков. Среди них можно отметить следующие:
применение сложных и громоздких конструкций;
малоэффективное удаление полимеров однократным экстрагированием. При принятом методе экстрагирования в экстракт переходит 70-75% полимеров, значит, до 30% полимеров остается в разбавленной кислоте;
концентрирование отработанной серной кислоты. Эта часть технологического процесса является самым слабым звеном во всем методе сернокислой гидратации. Во-первых, концентрировать кислоту удается лишь до 88-90%, а, во-вторых, такой процесс концентрирования из-за высокой температуры топочных газов приводит к ощутимым потерям серной кислоты от раскисления, сопровождающегося выбросом вредного SO2 в атмосферу;
неиспользованные возможности экономии энергетических средств.
.3 Парофазная гидратация этилена
Наиболее разработанным применительно к имеющимся промышленным установкам в настоящее время является процесс газофазной гидратации:
Ch3=Ch3(г.) + h3O(г.) = C2H5OH(г.) + 41868Дж/моль.
Механизм:
Ch3=Ch3 + Н+ « СН3-СН2+,
СН3-СН2+ + Н2О « СН3-СН2-ОН2+,
СН3-СН2-ОН2+ « СН3-СН2-ОН + Н+.
Но наряду с основной реакцией идут параллельные и последовательные побочные реакции:
C2h5 + h3O = C2H5OC2H5,(C2h5) = (-Ch3-Ch3-)n.
Таким образом, процесс сложный, обратимый, несмещенный (таблица 1), экзотермический, протекает с уменьшением объема.
Таблица 1. Равновесный выход этанола.
Отношение количеств веществ: Мh3O/MC2h5Равновесный выход за один проход при давлении 8Мпа при температуре:2800С2900С0,615,48,530,818,310,15
Следует обратить внимание на два физико-химических фактора, которые определяют основные технологические параметры процесса. Прежде всего, это активность катализатора, которая имеет решающее значение для определения температуры процесса. Катализаторами прямой гидратации могут служить фосфорная кислота и ее соли. Чаще всего используется фосфорная кислота концентрацией 85-87% на таких носителях, как алюмосиликаты, силикагели, пемза и др.; значительная часть кислоты (до 35%) находится в свободном состоянии. Активность этого катализатора является невысокой. Только при температуре 280-3000С ее можно считать более или менее приемлемой для промышленных условий. При более высокой температуре в значительной мере развиваются побочные процессы: полимеризация этилена, усиленное образование эфира и т.д.
Другим отправным фактором в газофазном процессе выступает весьма низкая по сравнению с этиленом летучесть воды, которая имеет решающее значение для определения давления процесса. Последнее, при прочих равных условиях, зависит от парциального давления паров воды, т.е. тоже от температуры.
Таким образом, температура становится важнейшим параметром, определяющим не только скорость, но и общее давление процесса. Так, в соответствии со стехиометрическим уравнением реакции, для эквимолярной смеси этилена и паров воды, парциальное давление последних должно составлять примерно половину от общего давления. Однако с целью предотвращения конденсации водяного пара в самом реакторе, что приводит к разбавлению фосфорной кислоты и парализует действие катализатора, парциальное давление паров воды, а, значит, и общее давление, должно быть несколько ниже. И действительно, в промышленности применяют общее давление около 8,0МПа.
Имеются и другие пути, предотвращающие появление водяного конденсата. Во-первых, это повышение температуры. Однако, в силу экзотермичности процесса, этот путь принципиально непригоден, т.к. приводит к снижению конверсии этилена и интенсификации побочных процессов. Во-вторых, это снижение парциального давления паров водяного пара за счет повышения парциального давления этилена. Однако, этот путь тоже непригоден. Он также приводит к снижению выхода этанола, т.к. оптимальным соотношением между реагирующими компонентами является эквимолярное. Мольное соотношение, используемое в промышленности, этилен — пары воды равно 1 : 0,6-0,8.
Выбранное соотношение компонентов диктует выбор общего давления:
Робщ = РС2Н4 + РН2О + Ринерт.
Известно, что давление паров воды над 85%-ной фосфорной кислотой при температуре 2800С составляет 2,7МПа. Принимая во внимание мольное соотношение между компонентами, видно, что давление паров этилена составляет около 4,7МПа. В таком случае концентрация инертных примесей должна быть порядка 15% (Ринерт = РС2Н4*0,15/0,85). Давление больше 8МПа нежелательно т.к. происходит конденсация водяного пара.
В настоящее время процесс гидратации этилена реализуется в промышленности при следующих условиях: t = 280-3000С; Р = 8,0МПа; мольное соотношение пары воды: этилен = 0,6 : 0,8; катализатор — фосфорная кислота и фосфаты на алюмосиликате или силикагеле при содержании Н3РО4 до 35% в свободном состоянии, объемная скорость циркулирующего газа 1800-2000ч-1, что соответствует продолжительности контакта 18-20с и производительности 180-200кг этанола с 1м3 катализатора в 1 ч.
При этих условиях этилен расходуется примерно следующим образом: 95% — на образование этанола; 2-3% — этилового эфира; 1-2% — ацетальдегида; 1-2% — полимеров и др. продуктов.
В приведенных условиях гидратации максимальный выход (равновесный) за один проход может составить только 10%; практически он достигает лишь 5%, что приводит к необходимости многократной циркуляции реакционной газовой смеси через слой катализатора.
Увеличение объемной скорости является методом интенсификации рециркуляционного процесса, поэтому процесс синтеза этанола ведут с большими объемными скоростями.
Малая конверсия этилена и низкая производительность катализатора обусловили необходимость работы не с разбавленным, а с концентрированным 98-99% этиленом. Даже при таком концентрированном этилене, т.е. при содержании в нем до 2% инертных примесей, они накапливаются в рециркулирующем газе, что приводит к снижению содержания этилена. Нижний предел концентрации этилена принят сегодня 85%, что соответствует содержанию инертных примесей до 15%. Поэтому необходим отвод последних с частью рециркулирующего газа (отдувка), которая составляет 13% от подачи свежего 98%-ного этилена.
Из рециркулирующей реакционной газовой смеси необходим непрерывный отвод получаемого этанола. Практически удаление этанола производится обычным методом конденсации, при этом вода как менее летучий компонент конденсируется с большей полнотой. Это приводит к огромным затратам тепла (учитывая крупнотоннажность производства этанола) на получение водяного пара, из которого только 5% расходуется на конденсацию этанола, а остальные 95% — на конденсацию воды. Поэтому возникает острая необходимость в утилизации тепла непрореагировавшего водяного пара путем эффективного теплообмена между потоками выходящего из реактора и входящего в него газовых смесей, а также путем генерации вторичного водяного пара в котлах-утилизаторах. Относительно низкий температурный потенциал тепла (250-3000С) приводит к громоздкой системе теплообмена и теплоиспользующих аппаратов.
Однако интенсивная циркуляция реакционной газовой смеси, кратность которой (при выходе этанола около5%) достигает 20, и сравнительно невысокая теплота реакции позволяет весьма просто реализовать процесс в адиабатическом реакторе колонного типа. Выделяющаяся теплота реакции повышает температуру реагирующего газового потока лишь на 15-200С, что допустимо.
Несмотря на весьма малую летучесть фосфорной кислоты, унос ее в виде паров при такой значительной рециркуляции реакционной газовой смеси и высокой температуре достигает 0,4-0,5кг/ч с 1м3 катализатора, что может вызвать коррозию аппаратуры и ограничивает длительность нормальной работы катализатора до 500-600 часов. В связи с этим была разработана технология непрерывной подачи свободной фосфорной кислоты в реакционную газовую смесь на входе в реактор, нейтрализации ее щелочью на выходе из реактора и регенерация из полученных при нейтрализации солей. Это позволило увеличить длительность работы катализатора до 1500 часов, заметно сократить расход фосфорной кислоты и значительно уменьшить коррозию оборудования. Такой процесс можно проводить в стальной аппаратуре.
Из приведенной физико-химической характеристики процесса можно вывести основные положения, которые были приняты при разработке существующей технологической схемы.
Необходимо построить схему по принципу многократной циркуляции реакционной газовой смеси через реактор с отводом целевого продукта — этанола — конденсацией;
В качестве исходного продукта следует применять чистый этилен с минимальным содержанием инертных примесей, которые накапливаются в реакционной смеси и частично отводятся с рециркулирующей газовой смесью в виде «отдувки»;
Повышение давления процесса ограничено из-за опасности конденсации воды, снижающей активность катализатора;
Процесс необходимо проводить при эквимолярном или близком к нему соотношении этилен / водяной пар;
Необходимо наиболее полно регенерировать тепло, расходуемое на получение водяного пара;
Возможно применение адиабатического реактора простейшей конструкции;
Целесообразно подпитывать поступающую в реактор реакционную газовую смесь свежей фосфорной кислотой, необходима нейтрализация паров кислоты на выходе из реактора, включая регенерацию ее из выпавших солей.
6. Описание технологической схемы процесса производства этилового спирта
Технологические схемы синтеза этанола различаются способами получения водяного пара и системами утилизации тепла. В наиболее совершенных схемах водяной пар для синтеза получают путем рецикла воды после отделения этанола и использованием парового конденсата.
.1 Структурная схема процесса
Свежий и оборотный этилен сжимается в компрессорах (1), (2) до 8,0 Мпа, смешивается с водяным паром, поступающим обычно с ТЭЦ, подогревается в теплообменнике (4) теплом отходящей из реактора смеси и перегревается в трубчатой печи (3) до 275°С, после чего подается в реактор-гидратор (5). Перед входом в реактор в поток «вбрызгивается» фосфорная кислота для подпитки катализатора, что продлевает срок его службы (реакционная газовая смесь смешивается с подаваемой фосфорной кислотой при температуре 280-3000С).
Реактор представляет собой полую колонну высотой 10 м и диаметром 1,5 м, работающую в режиме идеального вытеснения. Для исключения влияния коррозии от фосфорной кислоты он выложен листами красной меди.
Реакционные газы содержат пары унесенной фосфорной кислоты, которая нейтрализуется гидроксидом натрия, а образующиеся соли выделяются в солеотделителе (6). Отток фосфорной кислоты составляет 0,4 — 0,5 т/час с 1 м3 катализатора.
Теплота отходящих реакционных газов регенерируется в теплообменнике (4) для нагрева входящей смеси. В холодильнике (7) происходит конденсация продуктов реакции, а в сепараторе (8) разделяются жидкие и газовые потоки. Вода, как менее летучий компонент, конденсируется с большей полнотой. Поэтому для дополнительного выделения спирта производится его отмывка водой в абсорбере (9). Непрореагировавший газ, содержащий 90 — 92% этилена, рециркулируют компрессором (2), а часть его сбрасывают, чтобы избежать накопления примесей в системе.
Отдувка составляет примерно 20% от введенного этилена и направляется на установку газоразделения для выделения этилена.
Водный конденсат после сепаратора (8) и жидкость из абсорбера (9) дросселируют, в результате чего выделяются растворенные газы, отделяемые в сепараторе низкого давления (10) и направляемые в топливную линию.
Жидкая фаза из сепаратора (10) представляет собой 15%-ный водный раствор этанола, содержащий примеси диэтилового эфира, ацетальдегида и низкомолекулярных полимеров этилена. Этот раствор подвергают ректификации в ректификационных колоннах (11) и (12). В первой отгоняют наиболее летучие диэтиловый эфир и ацетальдегид, а во второй — этиловый спирт в виде азеотропной смеси, содержащей 95% этанола и 5% воды. Обогрев колонны осуществляется острым паром. В кубе колонны (12) остается вода, которую очищают от соли в ионообменной установке (13) и возвращают на гидратацию, организуя замкнутый цикл по технологической воде. Это позволяет значительно снизить расход свежей воды, исключить сброс отработанной воды в стоки и сократить потери этанола.
При необходимости получения безводного спирта этанол-ректификат направляют в дегидратор. Расход этилена на производство 1 т этилового спирта составляет 0,7 т (теоретический расходный коэффициент 0,61 т C2h5). В структуре себестоимости спирта 30% приходится на стоимость сырья.
.2. Операторная схема процесса:
7. Расчет материального баланса ХТС
.1 Блок-схема
.2 Пересчет единиц
Доля по объему доля по массе;
h5 = 0,96*MC2h5 = 0,96*28 = 26,88 г,H6 = 0,04*MC2H6 = 0,04*30 = 1,2 г,? = mC2h5 + mC2H6 = 26,88 + 1,2 = 28,08 г,
Тогда 26,88/28,08 = 0,958 масс долей или 95,8 % масс.,
,2/28,08 = 0,042 масс долей или 4,2 % масс.
7.3 Условная постоянная информация
№Содержание информацииУсловное обозначениеЕдиница измеренияПринятые значения1.Содержание С2Н4 в этиленовой фракцииg011доля по объему0,962.Содержание С2Н5ОН в ректификатеg401доля по массе0,9453.Норма расхода параКмоль Н2О / моль С2Н40,74.Конверсия этиленаcдоля единицы0,0555.Селективностьj1доля единицы0,9556.Степень превращения конвертированного этилена в — диэтиловый эфир — ацетальдегид j2 j3доля единицы 0,035 0,017.Содержание инертов в циркуляционном газеg51идоля по объему0,168.Количество свежей этиленэтановой фракции (базис расчета)Пкг79009.Доля отдуваемого газа, выходящего из сепаратораg35идоля по объему0,15
.4 Балансовая математическая модель
Баланс по этилену по первому узлу:
N12 = П*g011/Мэтилена + N51*(1-g51и)\
Количество воды, пошедшее на образование этанола:
(N012 + N41)/N12 = K
Баланс по этилену по третьему и пятому узлам:
N12*(1-c) = N51*(1-g51и) + N501*(1-g35и)
Баланс по этанолу по четвертому узлу:
N12*c*j1*Mэтанола = G401*g401
Баланс по диэтиловому эфиру:
G402 = 0,5* N12*c*j2*Mэфира
Баланс по ацетальдегиду:
G403 = N12*c*j3*Mацетальдегида
Баланс по воде по всей схеме:
N012= G401*g401/*Mэтанола + G401*(1-g401)/Мводы + G402/ Mэфира + G403/ Mацетальдегида
Отдувка
П*(1-g011)/Мэтана + G403/Mацетальдегид = N50*g35
.5 Соответствие переменных потокам
№Наименование потокаУсловное обозначениеciРазмерностьЗначение по расчету1.Циркул. поток этиленаN51c1кмоль39882.Поток этиленаN12c2кмоль36203.Свежий поток водяного параN012c3кмоль228,034.Циркул. поток водяного параN51c4кмоль23065.ОтдувкаN501c5кмоль83,4316.Поток этанола на выходе из блока разделенияG401c6Кг92697.Поток диэтилового эфира на выходе из блока разделенияG402c7Кг253,3798.Поток ацетальдегида на выходе из блока разделенияG403c8Кг87,597
.6 Упорядочение переменных
c2 = (1 — 0,16)c1 + 7900*0,957/28 = 0,84c1 + 270
c2 — 0,84c1= 270
(c3 + c4)/c2 = 0,7
c3 + c4 — 0,7c2 = 0
c2*(1 — 0,055) = c1*(1 — 0,16) + c5*(1 — 0,15)
,945c2 — 0,84c1 — 0,85c5 = 0
c2*0,055*0,955*46 = c6*0,945
,42c2 — 0,945c6 = 0
c7 = 0,5*0,055*0,035*74*c2
,07c2 — c7 = 0
c8 = 0,055*0,01*44*c2
,0242c2 — c8 = 0
c3 = c6*0,945/46 + c6*(1 — 0,945)/18 + c7/74 + c8/44
c3 — 0,024*c6 — 0,014*c7 — 0,023*c8 = 0
*(1 — 0,96)/30 + c8/44 = 0,15*c5
,023*c8 — 0,15*c5 = — 10,5
ciСв. членc1c2c3c4c5c6c7c8-0,84 0 -0,84 0 0 0 0 01 -0,7 0,945 2,42 0,07 0,0242 0 00 1 0 0 0 0 1 00 1 0 0 0 0 0 00 0 -0,85 0 0 0 0 -0,150 0 0 -0,945 0 0 -0,024 00 0 0 0 -1 0 -0,014 00 0 0 0 0 -1 -0,023 0,023270 0 0 0 0 0 0 -10,5
.7 Материальный баланс ХТС производства этанола на 7900 кг
этиленэтановой фракции
этилена = П*0,958 = 7900*0,958 = 7568 кгводы = N012*Мводы = 228,03*18 = 4104,54 кг (приход)этана= П*0,042 = 7900*0,042 = 332 кгспирта = G401*0,945 = 9269*0,945 =8759,2 кгпарар = N51*Мводы =2306*18 = 41508 кг воды = G401 — Gспирта = 9269 — 8759,2 = 509,8 кг (расход)диэтилового эфира = G402 = 253,379 кгацетальдегида = G403= 87,597 кг
Приходрасходнаименованиекг% массНаименованиекг% масс.1.Этиленовая фракция: этилен этан 2.Водяной пар (рец.) 3. Вода 7568 332 41508 4104,54 14 0,6 77,6 7,8Этанол Вода, введенная со спиртом Водяной пар (рец.) Диэтиловый эфир Отдувка Ацетальдегид Невязка8759,2 509,8 41508 253,38 2336,1 87,597 58,49416,4 0,9 77,6 0,5 4,3 0,2 0,1Всего53512,54100Всего53512,54100
.8 Расчет основных технологических показателей процесса
Расходные коэффициенты по сырью:
gпрактэтилена = G0этилена/ Gспирта = 7568/8759,2= 0,864
gпрактводы = G0воды/ Gспирта = 4204,54/8759,2 = 0,48
gтеорэтилена = Мэтилена/ Мспирта = 28/46 = 0,609
gтеорводы = Мводы/ Мспирта = 18/46 = 0,391
Выход этанола:
h = G спирта/Gспиртастех= Gспирта/(G этилена*(Mспирта /Мэтилена)) = 8759,2/7568*(46/28)*100% = 70,4 %
Конверсия этилена:
Х = (G спирта/Mспирта +Gдиэтилового эфира/Mдиэтилового эфира *2/1)/ (G этилена/ Мэтилена) = (8759,2/46+253,379/74*2)/(7568/28)=0,728=72,8%
7.9 Поточная диаграмма
Заключение
В заключении хотелось бы сказать, что в настоящее время находится широкое применение спиртов. На многих производствах спирты применяются в качестве растворителей. В химической промышленности они используются для различных синтезов. Метиловый спирт в больших количествах «идёт» на получение формальдегида, используемого в производстве пластмасс уксусной кислоты и других органических веществ. В настоящее время разрабатывается много новых технологических процессов на основе использования метилового спирта как исходного продукта, поэтому значение его в промышленном производстве нужных народному хозяйству, веществ и материалов будет всё более возрастать.
Перспективным считается использование метилового спирта в качестве моторного топлива т.к. добавка его к бензину повышает октановое число горючей смеси и снижает образование вредных веществ в выхлопных газах.
Этиловый спирт в больших количествах идёт на производство синтетического каучука. Окислением спирта получают пищевую уксусную кислоту. Путём его дигидратации готовят диэтиловый (медицинский) эфир, с взаимодействием с хлороводородом получают хлорэтан, для местной анестезии. Спирт применяется при изготовлении многих лекарств. В парфюмерии он идёт на изготовление духов и одеколонов.
Но также спирты могут оказывать негативное воздействие на организм. Особенно ядовит метиловый спирт: 5 -10 мл спирта вызывают слепоту и сильное отравление организма, а 30 мл могут привести к смертельному исходу.
Этиловый спирт — наркотик. При приеме внутрь он вследствие высокой растворимости быстро всасывается в кровь и возбуждающе действует на организм. Под влиянием спиртного у человека ослабевает внимание, затормаживается реакция, нарушается координация, появляется развязность, грубость в поведении и т. д. Все это делает его неприятным и неприемлемым для общества. Но следствия употребления алкоголя могут быть и более глубокими. При частом потреблении появляется привыкание, пагубное пристрастие к нему, и в конце концов тяжелое заболевание — алкоголизм. Спиртом поражаются слизистые оболочки желудочно-кишечного тракта, что может вести к возникновению гастрита, язвенной болезни желудка, двенадцатиперстной кишки. Печень, где должно происходить разрушение спирта, не справляясь с нагрузкой, начинает перерождаться, в результате возникает цирроз. Проникая в головной мозг, спирт отравляюще действует на нервные клетки, что проявляется в нарушении сознания, речи, умственных способностей, в появлении психических расстройств и ведет к деградации личности.
Особенно опасен алкоголь для молодых людей, так как в растущем организме интенсивно протекают процессы обмена веществ, а они особенно чувствительны к токсическому воздействию. Поэтому у молодежи быстрее, чем у взрослых, может появиться алкоголизм.
Список использованной литературы
Общая химическая технология: Учебник для химико-технологических специальностей. Т. 2.
Важнейшие химические производства. / Мухленов И.П., Авербух А.Я., Кузнецов Д.А. и др. Под редакцией И.П. Мухленова. — М.: Высш. шк.,1984.
Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. — М.: Химия, 1981.
Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза. — М.: Химия, 1992.
Кононова Г.Н., Сафонов В.В. Учебно-методическое пособие « Производство этилового спирта прямой гидратацией этилена».
Сборник заданий курсовых и домашних работ для студентов 4 курса. В двух частях. Ч. 1./ Егорова Е.В., Игумнов М.С., Кононова Г.Н. и др. Под ред. Кононовой Г.Н., Сафонова В.В., Смирновой С.Н. — М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2002.
diplomba.ru
Этиловый спирт
С2Н5ОН представляющий собой бесцветную прозрачную жидкость с характерным запахом и жгучим вкусом, является конечным продуктом процесса брожения. В зависимости от содержания этилового спирта алкогольные напитки делят на высокоалкогольные — до 96 % спирта (этиловый спирт), крепкие — от 31 до 65 % спирта (водка, ром, коньяк), среднеалкогольные — 9—30 % спирта (виноградные Вина, ликеры, наливки), слабоалкогольные— 1,5—8 % спирта (пиво, квас). Этиловый спирт хорошо смешивается с водой в любых соотношениях, имеет температуру кипения 78,3°С, замерзания— минус 117°С, гигроскопичен.
Классификация спирта. В зависимости от исходного сырья спирт подразделяется на пищевой и технический. В свою очередь пищевой спирт может вырабатываться из:
♦ зернового сырья и картофеля;
♦ сахарной мелассы и других отходов сахарного производства;
♦ плодов.
В зависимости от степени очистки спирт подразделяется на безводный, медицинский, люкс, экстра, высшей очистки, 1-го сорта.
Этиловый спирт (этанол) — продукт перегонки сброженных углеводосодержащих продуктов с последующим концентрированием и обработкой отгона (спиртсодержащей жидкости). Этанол представляет собой бесцветную, легкоподвижную горючую жидкость плотностью при 0°С 806 кг/м3, с температурой кипения 78,3°С; он смешивается с водой в любых соотношениях, в больших дозах ядовит.
Этиловый спирт широко применяется в различных отраслях народного хозяйства. Более 150 производств используют его в качестве сырья, растворителя и горючего.
В России вырабатывается более 1/6 из мирового производства этилового спирта. Основными потребителями пищевого этилового спирта являются ликеро-водочная и винодельческая отрасли пищевой промышленности. Пищевой спирт — это высококонцентрированная смесь почти чистого этилового спирта с водой. 95%-й питьевой этиловый спирт как пищевой продукт реализуется только в районах Крайнего Севера и Сибири. В основном же он используется в качестве основного или вспомогательного сырья при изготовлении водок, ликеров, наливок, горьких и сладких настоек, виноградных и плодово-ягодных вин.
Пищевой этиловый спирт получают из растительного сырья, богатого крахмалом (картофеля, зерна злаков, отходов крахмалопаточного производства) и инулином (топинамбура и корней цикория), или из сырья, содержащего сахара (мелассы — отхода сахарного производства, сахарной свеклы, некондиционного сахара-сырца, стеблей сахарного тростника, некондиционных плодов и ягод, включая виноград, а также из отходов виноделия).
Технический спирт вырабатывают из растительного сырья с высоким содержанием клетчатки негидролизуемыми ферментами дрожжевой клетки (древесных опилок, соломы, торфа, мха), и из сульфитных щелоков (отходов целлюлозно-бумажного производства), содержащих до 1,5% сахара. Технический этиловый спирт вырабатывают также синтетическим путем — гидратацией (в присутствии катализатора) углеводорода этилена — С2Н4 + Н20 = С2Н5ОН.
Этиловый спирт из пищевого сырья и древесины получают по одному и тому принципу путем сбраживания Сахаров под действием ферментов дрожжей. Отличие состоит лишь в способах гидролиза полисахаридов сырья до сбраживаемых Сахаров: крахмал пищевого сырья гидролизуют биохимическим путем с помощью ферментов (амилаз), а целлюлозу древесины — химическим способом, воздействуя на нее минеральными кислотами. Процесс же сбраживания гексоз в том и другом случае одинаков и может быть представлен следующей схемой:
гексозы—фосфорные эфиры—гексоз-фосфотриозы—
фосфоглицериновая кислота—пировиноградная кислота—
уксусный альдегид—этиловый спирт.
В основе производства этилового спирта из клубней картофеля и зерна злаков лежат два биохимических процесса: гидролиз (осахаривание) крахмала, содержащегося в сырье, и сбраживание образующихся Сахаров в спирт и углекислый газ, и физический процесс разделения жидкостей по точкам кипения.
Осахаривание крахмала ведут с помощью амилолитических ферментов, накапливающихся в проросших зернах (солоде) или продуцируемых грибами рода Aspergillus: Asp. avamori, Asp. oryzae. Asp. niger, Asp. usamii, Asp. botatae. Фермент дрожжей сх-глюкозидаза (мальтаза) катализирует гидролиз дисахарида мальтозы до двух молекул глюкозы, а комплекс ферментов зимазы сбраживает глюкозу в этиловый спирт и углекислый газ: С6Н1206-> 2С2Н5ОН + 2С02 + 118 кДж.
Из злаковых культур для получения этилового спирта в основном используют кукурузу, ячмень, овес, рожь, пшеницу, просо. В производстве спирта применяют так называемый «зеленый солод», т. е. увлажненное до содержания 38—40% влаги и проросшее зерно ячменя, ржи, пшеницы, овса, проса, кукурузы. Обычно на спиртовых заводах применяют смесь солодов из двух или трех видов зерна. При подборе смесей стремятся к созданию наиболее полного комплекса активно осахаривающихся ферментов.
Для сбраживания осахаренного зернокартофельного сырья, называемого затором, применяют дрожжи Saccharo-myces cerevisiae расы XII, II М.
Производство спирта из крахмалистого сырья складывается из следующих основных технологических процессов:
♦ подготовки сырья — мойки, очистки от посторонних примесей;
♦ тепловой обработки (разваривания) с водой при температуре 120—150°С и давлении не менее 588 кПа (6 атм) для разрушения клеточной структуры и растворения крахмала;
♦ охлаждения разваренной массы;
♦ осахаривания крахмала под действием амилолити-ческих ферментов — а- и (З-амилаз и олиго-1,6-глюкозида-зы (декстриназы), содержащихся в солодовом молоке или чистой культуре плесневых грибов, в течение 5—10 мин при температуре 57—58°С;
♦ сбраживания мальтозы и декстринов (после превращения их в мальтозу) в этиловый спирт и углекислый газ под действием ферментов дрожжей для получения зрелой бражки, содержащей 7—10% спирта;
♦ выделения из бражки путем ее перегонки с паром в специальных колонках спирта-сырца, содержащего 88% об. этилового спирта и получаемые в процессе брожения примеси;
♦ повторной перегонки спирта-сырца на ректификационном аппарате периодического или непрерывного действия для получения ректификованного спирта крепостью 96— 96,5% об. Спирт-ректификат получают также непосредственно из бражки на непрерывно действующих брагоректи-фикационных аппаратах, где из спирта-сырца выделяют примеси.
Примеси являются вторичными и побочными продуктами спиртового брожения. Большинство их оказывает вредное воздействие на организм человека, и поэтому остаточное количество и состав примесей влияют на качество спирта-ректификата и вырабатываемых из него ликеро-водочных изделий. При общем содержании примесей в спирте-сырце 0,3—0,5% в их составе идентифицировано более 50 соединений, которые могут быть отнесены к одной из четырех групп химических веществ: альдегидам и кетонам, эфирам, высшим спиртам (сивушные масла) и кислотам.
Очистка (ректификация) спирта-сырца от примесей является обязательным условием последующего использования спирта для приготовления водок и ликеро-водочных изделий. Ректификация путем перегонки спирта-сырца основана на различных точках кипения при нагревании этилового спирта и загрязняющих его примесей. В зависимости от степени летучести эти примеси бывают головными, хвостовыми и промежуточными.
Головные примеси кипят при температуре ниже температуры кипения этилового спирта. Это альдегиды (уксусный и др.), эфиры (муравьиноэтиловый, уксуснометиловый, уксусноэтиловый и др.), метиловый спирт. К хвостовым относят примеси, кипящие при температуре выше температуры кипения этилового спирта. Это в основном сивушные масла, т. е. высшие спирты — пропиловый, изо-пропиловый, бутиловый, изобутиловый, амиловый, изоа-миловый и др. К хвостовым примесям относятся также фурфурол, ацетали и некоторые другие вещества.
Промежуточные примеси представляют собой наиболее трудноотделимую группу соединений. В зависимости от условий перегонки они могут быть и головными, и хвостовыми. В эту группу примесей входят изомасляноэтиловый, изовалерианоэтиловый, уксусноизоамиловый, изова-лерианоизоамиловый эфиры.
В некоторых случаях спирт-сырец перед ректификацией предварительно подвергают химической обработке для освобождения от примесей: раствором NaOH омыляют сложные эфиры и превращают их в соли летучих кислот; раствором КМп04 окисляют альдегиды в непредельные соединения.
В зависимости от степени очистки спирт этиловый ректификованный бывает четырех сортов: люкс — 96,3%, экстра — 96,5% об., высшей очистки — 96,2 и 1-го сорта — 96% об. Для производства алкогольных напитков используется спирт «Люкс», «Экстра» и высшей очистки. Спирт «Люкс» и «Экстра» вырабатывают из различных видов зерна (кроме бобовых культур) и смеси зерна и картофеля. Количество крахмала картофеля в смеси не должно превышать 35% при выработке спирта «Люкс» и 60% при выработке спирта «Экстра».
Спирт высшей очистки в зависимости от исходного сырья вырабатывают:
♦ из зерна, картофеля или из зерна и картофеля;
♦ из смеси зерна, картофеля, сахарной свеклы и мелассы сахара-сырца и другого сахаро- и крахмалосодержащего пищевого сырья в различных соотношениях;
♦ из мелассы.
Поскольку спирт ректификованный «Экстра» вырабатывают из кондиционного зерна, то содержание примесей в нем не должно превышать 0,07 г/дм3. В спирте высшей очистки и 1-го сорта количество примесей допускается соответственно до 0,1 и 0,15 г/дм3. Помимо крепости в ректификованном спирте всех трех сортов нормируется содержание альдегидов (соответственно не более 2, 4 и 10 мг в 1 л безводного спирта), сивушного масла (не более 3, 4 и 15 мг/дм3), эфиров (не более 25, 30 и 50 мг/дм3), свободных кислот (не более 12, 15 и 20 мг/дм3). Он должен выдерживать пробу на метиловый спирт с фуксинсернистой кислотой. Содержание фурфурола не допускается.
Этиловый спирт всех сортов должен быть бесцветным и прозрачным, без посторонних частиц. Вкус и запах должны быть характерными для этилового спирта, изготовленного из соответствующего сырья. Посторонние привкусы и запахи не допускаются.
Спирт этиловый питьевой вырабатывают крепостью 95 ±0,2% об. Запах и вкус его должны быть характерными для этилового ректификованного спирта высшей очистки, вырабатываемого из зерна и картофеля, остальные показатели качества такие же, как и для спирта этилового ректификованного высшей очистки.
Разливают спирт в чистые стеклянные бутылки емкостью 0,5 и 0,25 л. На бутылку со спиртом наклеивают этикетку установленного образца с указанием: наименование завода-изготовителя, наименование спирта, крепость в объемных процентах, емкости бутылки и номера действующего стандарта. Срок хранения питьевого спирта не ограничен.
По качеству спирт этиловый питьевой должен соответствовать требованиям, указанным в табл. 16. Из органолептических показателей в спирте определяют внешний вид, цвет, вкус и запах. Спирт питьевой должен быть прозрачной, бесцветной жидкостью с характерным вкусом и запахом
Помимо органолептических показателей качества в спирте проводят физико-химические исследования и устанавливают объемную долю этилового спирта (95,0 ± 0,2%), массовую концентрацию альдегидов (не более 4 мг/дм3), сивушного масла (не более 4 мг/дм3), эфиров (не более 30 мг/дм3), свободных кислот (не более 15 мг/дм3). Напиток должен выдерживать пробу на метиловый спирт с фуксин-сернистой кислотой и не содержать фурфурола.
Спирт этиловый пищевой получают только из пищевого сырья. Основным сырьем для производства спирта является картофель, зерно, патока.
Производство спирта состоит из следующих этапов:
подготовительного — очистка сырья от примесей, приготовление солода;
основного — разваривание крахмалистого сырья, осахаривание крахмала, сбраживание осахаренной массы, перегонка бражки и получение сырого спирта;
завершающего — ректификация (повторная перегонка с целью очистки этилового спирта от примесей).
В зависимости от содержания примесей и крепости спирт этиловый ректификованный (С2Н5ОН) выпускают сортов: Люкс, Экстра,
высшей очистки и 1-го. Спирт этиловый ректификованный представляет собой прозрачную, бесцветную жидкость без посторонних запахов и привкусов.
Спирты сортов Люкс и Экстра получают только из кондиционного зерна. Для спирта высшей очистки и 1-го сорта используют любое крахмалосодержащее пищевое сырье.
Содержание этилового спирта (крепость) выражается в объемных процентах. Под объемным процентом понимают количество миллилитров спирта в 100 мл водно-спиртового раствора при 20 «С.
Крепость спирта Люкс — 96,3% об., Экстра — 96,5, высшей очистки — 96,2, 1-го сорта — 96,0% об.
Этиловый спирт — бесцветная, легкоподвижная жидкость; удельный вес безводного спирта при 20 «С — 0;78927; температура кипения при 760 мм рт. ст. — 78,3 °С; замерзания——117 °С.
Спирт этиловый ректифицированный спирт «люкс» и «экстра»
вырабатывают из различных видов зерна, смеси и картофеля, кроме бобовых. При производстве спирта «Люкс» количество картофеля в смеси не должно превышать 35 %, спирта «Экстра» — 60 %.
Этанол
Консервант.
В РФ разрешён в качестве экстракционного и технологического растворителя в пищевых производствах согласно ТИ, максимальное остаточное количество согласно ТИ (п. 5.3.42 СанПиН 2.3.2.1293-03).
Этиловый спирт представляет собой бесцветную жидкость, смешивающуюся с водой в любых соотношениях. Пищевой спирт получают только брожением сахаросодержащих жидкостей. Этанол в РФ и большинстве других стран не считается пищевой добавкой. Он является составной частью многих пищевых продуктов, его использование в качестве консерванта не ограничено. Консервирующее действие проявляется, начиная с концентрации в несколько процентов, и связано со снижением активности воды в пищевом продукте.
Арабы использовали спирт для хранения фруктов ещё тысячу лет назад. В настоящее время этанол находит промышленное применение в хлебопечении и виноделии. Его добавляют к сокам, применяемым затем в производстве вин, и к специальным сортам вин. В домашнем хозяйстве этанол по-прежнему широко применяется при консервировании фруктов в роме и сахаре.
Похожие статьи
znaytovar.ru
Производство этилового спирта.
⇐ ПредыдущаяСтр 7 из 9Следующая ⇒
Этиловый спирт по объему производства занимает первое место среди всех других органических продуктов. С каждым годом спирт, получаемый из синтетического сырья, все более и более заменяется синтетическим.
Синтетический спирт из этилена в несколько раз дешевле пищевого и требует меньших затрат труда.
Этиловый спирт широко применяется в различных отраслях промышленности: для получения синтетического каучука, ацетальдегида, уксусной кислоты, искусственного шелка, лекарственных соединений, душистых веществ и т.д.
Этиловый спирт получают прямой гидратацией этилена:
С2Н4 + Н2О С2Н5ОН + Q (6.1.)
Помимо основной реакции, протекают побочные:
2С2Н4 + Н2О = (С2Н5)2О + Q (6.2.)
С2Н4 + Н2О = С2Н4О + Н2 — Q (6.3.)
Таким образом процесс получения этанола: сложный, обратимый, экзотермический.
Чтобы сдвинуть равновесие в сторону гидратации этилена необходимо понижение температуры и повышение давления, так как процесс идет с уменьшением числа молей.
Однако, при температуре ниже 2800С скорость гидратации очень мала, а применение давления свыше 8 МПа экономически не рентабельно.
В качестве катализатора используется фосфорная кислота, нанесенная на широкопористые носители: силикагель или алюмосиликат. Носители, обладающие широкими порами, облегчают протекание диффузии реагентов внутрь зерен пористого катализатора.
В результате обширных исследований и промышленных испытаний установлены следующие условия синтеза этанола: 1) температура 280-2900С, 2) давление 6-8 МПа, 3) концентрация этилена в циркулирующем газе 80-85%(объемн.), 4) молярное отношение воды к этилену 0,6-0,7 : 1, 5) концентрация фосфорной кислоты на поверхности катализатора не ниже 83%, 6) объемная скорость 1800-2500 ч-1.
Перечисленные условия позволяют получить водноспиртовый раствор концентрацией спирта 15-16% при конверсии этилена за один проход 4-6%. Для увеличения степени использования сырья процесс проводят по циркуляционной схеме вдали от положения равновесия с большими объемными скоростями.
Для предотвращения накапливания инертов в циркуляционном газе проводят отдувку.
Этилен смешивается с водяными парами и вся смесь направляется в теплообменник (1) и затем в печь (2), откуда парогазовая смесь при 2800С поступает в гидрататор (3), который заполнен катализатором.
Образовавшаяся в результате реакции смесь продуктов последовательно отдает теплоту в теплообменнике (1) и затем окончательно охлаждается в холодильнике (5). Полная отмывка газа от паров спирта идет в промывной колонне (6).
Непрореагировавший этилен после сжатия смешивается со свежим этиленом и вновь направляется в гидрататор.
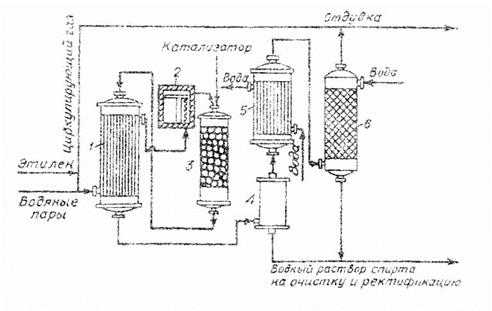
Рис.6.1. Технологическая схема производства этилового спирта прямой гидратацией этилена:
1 –трубчатый теплообменник, 2 –печь, 3 –гидрататор, 4 –сборник, 5 –холодильник, 6 –промывная колонна с насадкой.
Жидкая фаза из сборника 4 и промывной колонны 6 представляет собой 15%-ный водный раствор этанола, содержащий примеси диэтилового эфира, ацетапьдегида и низкомолекулярных полимеров этилена. Этот раствор подвергается ректификации в двух ректификационных колоннах. В первой отгоняют наиболее летучие диэтиловый эфир и ацетальдегид, а во второй – этиловый спирт в виде азеотропной смеси, содержащей 95% этанола и 5% воды. В кубе колонны остается вода, которую очищают в ионообменной установке и возвращают на гидратацию, организуя замкнутый рецикл по технологической воде. Это позволяет значительно снизить расход свежей воды, исключить сброс отработанной воды в стоки и сократить потери этанола.
Глава 7.
Производство метанола.
Метанол по значению и объемам производства является одним из важнейших многотоннажных продуктов, выпускаемых современной химической промышленностью.
Области применения: для получения пластических масс, синтетических волокон, синтетического каучука, в качестве растворителя, для микробиологического синтеза и т.д.
Метанол впервые был обнаружен Р. Бойлем в 1661 году в продуктах сухой перегонки древесины (отсюда название метанола – древесный спирт). В чистом виде выделен в 18344 году Ж. Дюма и Э. Пелиго, установившими его формулу.
Промышленное производство метанола из водорода и оксида угдерода (II) впервые было осуществлено в 1923 году и с тех пор непрерывно совершенствуется.
В нашей стране производство метанола впервые организовано в 1934 году в объеме 30 т в сутки на Новомосковском химическом комбинате из водяного газа газификацией кокса.
В качестве сырья для получения метанола могут использоваться: природный газ, синтез-газ производства ацетилена, газы нефтепереработки, твердое топливо.
Твердое топливо сохраняет в качестве сырья определенное значение. Разработка процесса газификации угля с целью получения синтез-газа, содержащего Н2, СО, СО2, может изменить структуру сырьевой базы производства метанола, и неудобный для транспортировки уголь будет превращен в удобный для хранения, транспортировки и использования метанол.
Синтез метанола основан на обратимых реакциях, описываемых уравнениями:
СО + 2Н2 СН3ОН; ΔH = -90,8 кДж (7.4.)
СО2 +3Н2 СН3ОН + Н2О; ΔH = -49,6 кДж (7.5.)
Реакции (5.4.) и (5.5.) – обратимы, экзотермичны и протекают с уменьшением объема.
С термодинамической точки зрения для смещения равновесия в сторону образования метанола необходимо проводить процесс при низких температурах и высоком давлении. Однако, для увеличения скорости реакции необходимо повышение температуры. При этом выбирая температурный режим, следует учитывать образование побочных продуктов: метана, высших спиртов, кетонов и эфиров.
Приведем некоторые побочные реакции:
СО + 3Н2 = СН4 + Н2О (7.6.)
2СО + 4Н2 = (СН3)2О + Н2О (7.7.)
4СО + 8Н2 = С4Н9ОН + 3Н2О (7.8.)
2СО = СО2 + С (7.9.)
т.е. процесс получения метанола является сложным.
Побочные реакции обуславливают бесполезный расход синтез-газа и удорожают очистку метанола.
Применяемый для синтеза метанола катализатор должен обладать высокой селективностью, т.е. максимально ускорять образование метанола при одновременном подавлении побочных реакций. Для синтеза метанола предложено много катализаторов. Лучшими оказались катализаторы, основными компонентами которых являются оксид цинка или медь.
Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие катализаторы – необратимо. Необходима также тщательная очистка газа от карбонила железа, который образуется в результате взаимодействия оксида углерода с железом аппаратуры. На катализаторе карбонил железа разлагается с выделением элементного железа, что способствует образованию метана.
Процесс получения метанола осуществляется либо на цинк-хромовом катализаторе при давлении 30 МПа, либо на низкотемпературном медьсодержащем катализаторе при давлении 5 МПа.
Цинк-хромовый катализатор работает в области температур 370-3900С, медьсодержащий – 220-2800С.
Таким образом, процесс получения метанола является гетерогенно-каталитическим. Лимитирующая стадия – адсорбция водорода на поверхности катализатора.
Для смещения равновесия реакции вправо процесс проводят с избытком водорода, при следующем соотношении исходных компонентов- Н2: СО= 2,15-2,30. Кроме того, водород ускоряет процесс, обладая высокой теплопроводностью, позволяет проводить процесс в узком температурном интервале, гидрирует продукты уплотнения на катализаторе, чем повышает срок его службы.
С возрастанием объемной скорости газа выход метанола падает. Такая закономерность основана на том, что с увеличением объемной скорости уменьшается время контакта газа с катализатором и, следовательно, концентрация метанола в газе, выходящем из реактора.
С увеличением объемной скорости подачи сырья содержание метанола в газе снижается, однако за счет большего объема газа, проходящего в единицу времени через тот же объем катализатора, производительность последнего увеличивается. На практике процесс синтеза метанола осуществляют при объемных скоростях 20 000-40 000 ч-1. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержится только –4% метанола.
С целью возможно более полной переработки синтез-газа необходимо его возвращение в цикл после выделения метанола и воды.
При циркуляции в синтез-газе накапливаются инертные примеси, что приводит к снижению давления в системе и повлечет за собой снижение выхода и скорости процесса. Поэтому концентрацию инертных примесей регулируют частичной отдувкой циркуляционного газа. Отдувка проводится с таким расчетом, чтобы количество инертов, поступающих со свежем синтез-газом, было равно количеству инертов, удаляемых с отдувкой.
Читайте также:
lektsia.com
Производство — этиловый спирт — Большая Энциклопедия Нефти и Газа, статья, страница 1
Производство — этиловый спирт
Cтраница 1
Производство этилового спирта при помощи дрожжей основано на давно устоявшейся технологии ( см. также гл, 3), Для получения топливного спирта необходимо осуществить ряд процессов ( рис. 2.5): подготовить сырье, провести брожение, отгонку и очистку, обезвоживание если предполагается использовать продукт в смеси с нефтью), денатурацию и организовать хране1 — ние. На каждой стадии есть свои узкие места, о которых надо всегда помнить, поскольку это прямо определяет саму возможность использования процесса сбраживания для получения жидкого топлива, его энергобаланс и экономичность. [1]
Производство этилового спирта из этилена растет с каждым годом и в настоящее время достигло больших масштабов. Синтетический спирт значительно дешевле спирта, полученного из пищевого сырья. [2]
Производство этилового спирта является наиболее многотоннажным среди производства других спиртов. По производству этилового спирта Советский Союз занимает первое место в мире. [3]
Производство этилового спирта из коксового газа имеет большие преимущества по сравнению с производством этого продукта из пищевого сырья. [4]
Производство этилового спирта из этилена растет с каждым годом и в настоящее время достигло больших масштабов. Синтетический спирт значительно дешевле спирта, полученного из пищевого сырья. [5]
Производство этилового спирта путем сернокислотной гидратации началось лишь после 1930 г. В Советском Союзе исследования в области промышленного применения этого способа производились М. А. Далиным с сотрудниками, и в 1936 г. в Баку была построена первая установка для производства этилового спирта из этилена нефтезаводских газов. [6]
Производство этилового спирта путем прямой гидратации этилена, полученного при пиролизе этана, должно быть предусмотрено дальнейшим развитием химической промышленности в Грозном. [7]
Для производства этилового спирта наиболее широко используется сахарный тростник. В Бразилии чистый этанол и смесь этанола с бензином являются широко распространенным видом топлива. Такое биотопливо легко хранить и транспортировать, оно обладает высокой теплотворной способностью, более полно сгорает в двигателе. При сгорании такого топлива атмосфера загрязняется гораздо меньше, чем при сжигании обычного топлива. Бразилия, приступившая к использованию этанола в качестве автомобильного топлива в 70 — е гг., обладает лучшей в мире технологией его производства. К числу перспективных методов биоконверсии относится способ получения моторного топлива ( метилового эфира) из семян рапса. Моторное топливо на основе рапса, обладая характеристиками, близкими к дизельному топливу, практически не дает выбросов вредных веществ. В Чехии производится около 1 млн т биодизельного топлива в год. В США разработан способ производства спирта из кукурузы, в Италии ведутся работы над разработкой способа рентабельного производства спирта из сорго. Около 200 автобусов в Стокгольме уже работают на спирте. [8]
Для производства этилового спирта методом прямой гидратации требуется этиленовая фракция приблизительно следующего состава: этилена 97 % объемн. [9]
Для производства этилового спирта используют также остатки свеклосахарного производства, так называемую мелассу, или патоку, содержащую тростниковый сахар. [10]
Для производства этилового спирта используют также остатки свеклосахарного производства, так называемую мелассу, или патоку, содержащую тростниковый сахар. [11]
Для производства этилового спирта используется крахмалсо-цержащее сырье — различные виды зерна и картофель. В некоторых случаях спиртовые заводы, перерабатывающие зерно-картофельное сырье, используют для производства спирта сахарную свеклу, картофельную мезгу, мелассу, отходы виноделия, некондиционные фрукты. [12]
Позже производство этилового спирта сернокислотной гидратацией этилена коксовых газов было начато на севере Франции. [13]
Для производства этилового спирта используется крахмалсо-держащее сырье — различные виды зерна и картофель. В некоторых случаях спиртовые заводы, перерабатывающие зерно-картофельное сырье, используют для производства спирта сахарную свеклу, картофельную мезгу, мелассу, отходы виноделия, некондиционные фрукты. [14]
Для производства этилового спирта наиболее широко используется сахарный тростник. В Бразилии чистый этанол и смесь этанола с бензином являются широко распространенным видом топлива. Такое биотопливо легко хранить и транспортировать, оно обладает высокой теплотворной способностью, более полно сгорает в двигателе. При сгорании такого топлива атмосфера загрязняется гораздо меньше, чем при сжигании обычного топлива. Бразилия, приступившая к использованию этанола в качестве автомобильного топлива в 70 — е гг., обладает лучшей в мире технологией его производства. К числу перспективных методов биоконверсии относится способ получения моторного топлива ( метилового эфира) из семян рапса. Моторное топливо на основе рапса, обладая характеристиками, близкими к дизельному топливу, практически не дает выбросов вредных веществ. В Чехии производится около 1 млн т биодизельного топлива в год. В США разработан способ производства спирта из кукурузы, в Италии ведутся работы над разработкой способа рентабельного производства спирта из сорго. Около 200 автобусов в Стокгольме уже работают на спирте. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Технология производства этилового спирта | миниспиртзавод, спиртзаводы
Производство спирта как в домашних, так и в промышленных условиях происходит в несколько этапов. Если некоторые алкогольные напитки являются прямым результатом сбраживания конкретных сахаросодержащих продуктов, то для получения чистого этилового спирта и крепкого алкоголя (свыше 40%) необходима перегонка и очистка первоначального сырья.
Например, путем перегонки вина получают коньяк, ром готовится из сахарного тростника, шотландский виски из пива, приготовленного без участия хмеля. Что же касается чистого 96% этанола, здесь сырье имеет лишь количественное значение: разные продукты дают разный объем спирта на выходе.
Первый этап связан с подготовкой сырья, называемого также брагой. Это жидкая масса из продуктов, которые содержат сахар или крахмал. То есть зерновые и бобовые культуры, картофель, фрукты и ягоды, свекла, собственно, сахар.
Поскольку в спиртовом брожении участвуют простейшие сахара, а крахмал – это полимер, необходимо его расщепление до состояния глюкозы. Обычно для этого используют ферменты, содержащиеся в солоде (пророщенных и высушенных зернах злаковых культур). При активном химическом воздействии молекулы крахмала гидролизуются, и продукт становится пригодным для дальнейшего сбраживания. Фрукты, тростник, свекла, сахар в таких процедурах не нуждаются.
Механизм получения спирта основан на реакции спиртового брожения, то есть распаде сахаров в конечном итоге на этиловый спирт и углекислый газ. Проистекает реакция при воздействии специальных дрожжевых микроорганизмов, которые в большом количестве содержатся не только в дрожжах, но и под кожицей плодов и ягод, а также легко распространяются в окружающем пространстве по воздуху.
Бактерии выделяют ферменты – энзимы, которые провоцируют распад глюкозы. Выделяемая при реакции энергия поглощается самими микроорганизмами и используется для их жизнедеятельности.
Этот процесс называется сбраживанием. Полученная спиртосодержащая масса далее отправляется на перегонку. Стоит отметить, что для производства спирта рекомендуется использовать продукты с максимальным содержанием углеводов. Выход спирта после перегонки сахара будет существенно выше, чем при перегонке яблочной браги.
Механизм перегонки основан на том, что спирт и вода имеют разную температуру кипения. Если вода при нормальных условиях закипает при температуре в 100 градусов, то этиловому спирту нужно для этого 78°С.
Следует помнить, что, помимо воды и спирта, брага содержит массу примесей. Легкие начинают закипать при температуре в 68°С, а тяжелые при 85°С. Именно поэтому при перегонке браги важно добиваться такой температуры, при которой спирт уже кипит, а сивушные масла еще нет.
Выделенный пар конденсируется и собирается в отдельную посуду. Полученный продукт характеризуется содержанием спирта около 70% и называется в народе самогоном. Как правило, этот напиток содержит большое количество примесей, ухудшающих его вкус и качество, поэтому он нуждается в дополнительной очистке.
Исторически сложилось множество способов очистки спирта-сырца. Фильтрация через активированный древесный уголь, обладающий способностью поглощать примеси. Коагуляция с помощью яичного белка или молока, которые мгновенно реагируют с сивушными маслами и уходят на дно в виде твердого остатка. Выморозка: вода вместе с сивушными маслами замерзает быстрее спирта, после чего льдинки выбрасываются.
spirt-zavod.biz
