Краткое описание технологической схемы производства аммиака
Из предыдущего ясно, что для достижения высокой производительности аппарата процесс синтеза аммиака следует вести, не стремясь к получению равновесных выходов. Напротив, надо пропускать газ с такой объемной скоростью, при которой выходящая из аппарата газовая смесь далека от состояния равновесия и содержание аммиака в ней невелико. Поэтому необходимо, выделив аммиак из газа, вновь направить азотоводородную смесь на синтез, что может быть осуществлено двумя приёмами. Можно соединить последовательно ряд агрегатов для синтеза аммиака, пропуская газ через все агрегаты (схема с открытой цепью). Каждый агрегат состоит из колонны синтеза, холодильника (в котором газ охлаждается и конденсируется аммиак) и газоотделителя для разделения газа и жидкого аммиака. Можно проводить процесс в одном агрегате, направляя азотоводородную смесь после выделения аммиака и добавки к ней соответствующего количества свежей смеси обратно в колонну синтеза. Такой циклический процесс благодаря своим преимуществам, прежде всего компактности и простоте регулирования, применяется в настоящее время почти на всех установках.
Первой стадией процесса является сжатие азотоводородной смеси до давления, под которым осуществляется процесс синтеза аммиака. В настоящее время в производстве синтетического аммиака применяются давления от 100 до 1000 ат. Расход энергии на сжатие смеси незначительно возрастает с повышением давления, так как работа сжатия приблизительно пропорциональна логарифму отношения давлений.
Сжатый газ после компрессора проходит через фильтр, где очищается от масла.
Второй стадией процесса в ряде способов синтеза аммиака является дополнительная очистка азотоводородной смеси от ядов: окиси углерода, кислорода и водяных паров. Напомним, что смесь, полученная описанными выше способами, содержит эти примеси в количествах, измеряемых тысячными или сотыми долями процента. Дополнительная очистка производится каталитическим способом.
Она осуществляется различными методами, например путем гидрирования:
СО + ЗН3 = СН4 + Н2О
О2+2Н2 = 2Н2О
Эти реакции идут при повышенном давлении и температуре 300—350° в присутствии специального катализатора. При последующем охлаждении газа большая часть водяных паров, образовавшихся в так называемой колонне предкатализа, конденсируется и удаляется.
Хотя метан не является ядом для катализатора синтеза аммиака, но повышение его содержания в газе понижает парциальное давление реагирующих веществ и, следовательно, производительность. Поэтому каталитический способ очистки применяется лишь для удаления незначительных количеств окиси углерода и кислорода. Содержание окиси углерода и водорода в газовой смеси, поступающей в колонну предкатализа, очень мало. Поэтому процесс не может протекать автотермично и необходим постоянный подвод тепла для поддержания в аппарате требуемой температуры. Процесс можно провести автотермично, если выбрать такие условия для предкатализа, при которых частично реагирует и азотоводородная смесь. Сжатая и очищенная азотоводородная смесь направляется далее вместе с циркуляционным газом в колонны синтеза аммиака.
Следующей операцией является выделение из газа аммиака путем конденсации. Температура, до которой нужно охладить газ, чтобы сконденсировать аммиак, зависит от давления.
Количество аммиака, остающегося в газе при данной температуре конденсации, обратно пропорционально общему давлению, что позволяет, применяя для синтеза аммиака давление 750—1000 ат, достигать удаления 80—90% аммиака из газа охлаждением его в водяных холодильниках. При меньших давлениях газ приходится охлаждать дополнительно в аммиачных холодильниках до температуры от 0° до —55° (в зависимости от давления). В аммиачном холодильнике используется производимый на установке жидкий аммиак, который после испарения направляется в газообразном виде в перерабатывающие цехи.
Освобожденная в той или иной степени от аммиака азотоводородная смесь после добавления к ней свежего газа возвращается в колонну синтеза. Для циркуляции газов применяются в большинстве случаев циркуляционные насосы, компенсирующие падение давления в системе (перепад давления измеряется 10—20 ат). В системах высокого давления иногда взамен циркуляционных насосов применяются инжекторы. Свежий газ подводится к инжектору под давлением, превышающим давление циркулирующего газа я а 10 — 15 ат.
Регулирование состава газовой смеси
Азотоводородная
смесь содержит не участвующие в реакции
примеси (аргон и др.). Их содержание
в свежей смеси зависит от метода ее
получения. Если эти примеси тем или иным
путем не выводятся из цикла, то при
циркуляции газовой смеси через систему
синтеза аммиака инертные примеси
накапливаются, режим нарушается и
производительность колонны падает.
Например, по лабораторным данным при
объемной скорости 30 000 час»
Инертные примеси частично растворяются в аммиаке; однако этого в большинстве случаев недостаточно и необходимо также выпускать часть циркулирующей смеси из цикла. При установившемся процессе количество инертных примесей, которое выводится из цикла, равняется количеству инертных газов, поступающему в цикл со свежим газом. Количество азотоводородной смеси, которое должно быть выведено из цикла при производстве 1 т аммиака (без учета растворения инертных газов в жидком аммиаке), составляет:
Для удаления инертных газов иногда прибегают также к промыванию газа растворителями.
Смена катализатора
Катализатор в результате реакции не изменяется химически, но практически он “стареет” в процессе работы, активность его понижается и в конце концов приходится его заменять. В большинстве технических процессов на весовую единицу катализатора за срок его службы получаются тысячи весовых единиц продукта.
Явление “старения” может быть объяснено действием ядов и изменением поверхности катализатора. Так, например, восстановленное металлическое железо является активным катализатором для реакции синтеза аммиака. Однако по прошествии незначительного срока работы при 400 — 500° его активность быстро падает. Это явление можно поставить в связь с изменениями, наблюдаемыми рентгенографическими методами и показывающими, что в процессе работы произошли оплавление поверхности и рост крупных кристаллов.
“Старение” катализатора неизбежно, но длительность службы его е большой степени зависит от режима эксплуатации. Так, для катализатора с развитой поверхностью очень вреден нагрев его выше определенной температуры, приводящий обыкновенно к значительному понижению активности.
При хорошей очистке азотоводородной смеси и при соблюдении технологического режима смена катализатора производится в зависимости от системы синтеза через один-два года.
studfiles.net
Современный процесс производства аммиака.
Современный процесс получения аммиака основан на его синтезе из азота и водорода при температурах 380 — 450 0C и давлении 250 атм с использованием железного катализатора:
N2 (г.) + 3h3 (г.) = 2Nh4 (г.)
Азот получают из воздуха. Водород получают восстановлением воды (пара) с помощью метана из природного газа либо из лигроина. Лигроин (нафта) представляет собой жидкую смесь алифатических углеводородов, которая получается при переработке сырой нефти (см. гл. 18).
Работа современного аммиачного завода очень сложна. На рис. 7.2 показана упрощенная схема действия аммиачного завода, работающего на природном газе. Эта схема действия включает восемь стадий.
1-я стадия. Удаление серы из природного газа. Это необходимо, поскольку сера представляет собой каталитический яд (см. разд. 9.2).
2-я стадия. Получение водорода восстановлением пара при 750 0C и давлении 30 атм с помощью никелевого катализатора:
Ch5 (г.) + h3O (г.) = СО (г.) + ЗН 2 (г.)
3-я стадия. Впуск воздуха и сгорание части водорода в кислороде вводимого воздуха:
2h3 (г.) + O2 (г.) = 2h3O (г.) В результате получается смесь водяного пара, моноксида углерода и азота. Водяной пар восстанавливается с образованием водорода, как на 2-й стадии.
4-я стадия. Окисление моноксида углерода, образующегося на стадиях 2 и 3, до диоксида углерода по следующей реакции «сдвига»: СО (г.) + h3O (г.) = CO2 (г.) + h3 (г.)
Этот процесс проводится в двух «реакторах сдвига». В первом из них используется катализатор из оксида железа и процесс проводится при температуре порядка 400 0C Во втором используется медный катализатор и процесс проводится при температуре 220°С.
5-я стадия. Вымывание диоксида углерода из газовой смеси при помощи буферного щелочного раствора карбоната калия или раствора какого-либо амина, например этаноламина Nh3Ch3Ch3OH. Диоксид углерода в конце концов сжижают и используют для производства мочевины, либо выпускают в атмосферу.
6-я стадия. После 4-й стадии в газовой смеси остается еще около 0,3% моноксида углерода. Поскольку он может отравлять железный катализатор во время синтеза аммиака (на 8-й стадии), моноксид углерода удаляют путем конверсии водородом в метан на никелевом катализаторе при температуре 325°С.
7-я стадия. Газовую смесь, которая теперь содержит приблизительно 74% водорода и 25% азота, подвергают сжатию; при этом ее давление возрастает от 25-30 атм до 200 атм. Поскольку это приводит к повышению температуры смеси, ее сразу же после сжатия охлаждают.
8-я стадия. Газ из компрессора поступает теперь в «цикл синтеза аммиака». Схема, приведенная на рис. 7.2, дает упрощенное представление об этой стадии. Сначала газовая смесь попадает в каталитический конвертер, в котором используется железный катализатор и поддерживается температура 380-450°С. Газовая смесь, выходящая из этого конвертера, содержит не более 15% аммиака. Затем аммиак сжижают и направляют в приемный бункер, а непрореагировавшие газы возвращают в конвертер.
Оглавление:
www.himikatus.ru
2)Изобразить схематично все типы химических реакторов, которые используются на различных стадиях производства аммиака с обоснованием их использования.
На стадии очистки природного газа от серосодержащих соединений используют однослойный реактор с неподвижным слоем зернистого поглотителя. На кобальто-молибденовом катализаторе происходит гидрирование серосодержащих соединений до сероводорода. Полученный сероводород поглощается в однослойном абсорбере с неподвижным слоем ZnS.
Трубчатая печь представляет собой реактор для конверсии природного газа и воды, аппарат состоит из труб, в которых находится катализатор. Такое строение позволяет эффективно обогревать газовую смесь.
Для проведения второй ступени конверсии природного газа используется адиабатический реактор, благодаря чему теплота подаётся внутренним теплообменом, повышая температуру газовой смеси.
Дополнительная конверсия СО проходит а реакторе с адиабатическими слоями катализатора с охлаждением между ними для увеличения степени превращения при понижении температуры.
Очистка от СО происходит при метанировании водородом в однослойном реакторе, так как не происходитсильный адиабатический разогрев при этом процессе.
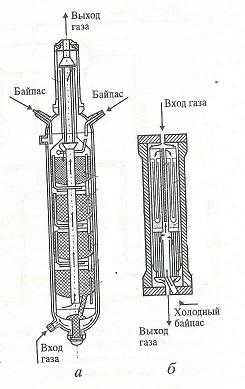
Синтез аммиака должен проходить при отводе тепла, для достижения оптимальной температуры процесса, это обеспечивается в многослойном реакторе с промежуточным теплообменом (а) или в трубчатом реакторе с охлаждением (б).
3)Составить структурную схему производства аммиака с указанием основных аппаратов.
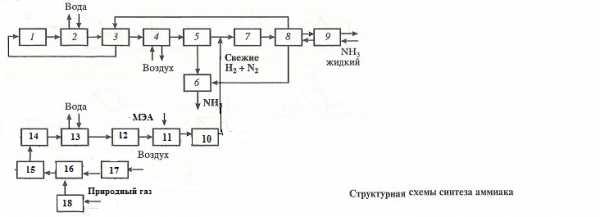
1 – колонна (реактор) синтеза NH3 , 2, 3, 13 – теплообменники, 4 – воздушный холодильник, 5 – сепаратор, 6 – сборник аммиака, 7 – циркуляционный компрессор, 8 – конденсационная колонна, 9 – испаритель, 10 – реактор метанирования СО, 11 – абсорбер, 12 – реактор конверсии СО с медьсодержащим катализатором, 14 – реактор с железохромовым катализатором, 15 – шахтный конвертор, 16 –трубчатая печь, 17 – компрессор, 18 – реактор очистки природного газа от серосодержащих соединений.
4) Привести технологическую схему отдельной стадии процесса (по указанию преподавателя). Синтез аммиака3
Свежая азотоводородная смесь (далее – АВС), сжатая во второй ступени центробежного компрессора до давления 30-32 МПа, после охлаждения в воздушном холодильнике поступает в нижнюю часть конденсацинной колонны 8 для очистки от остаточных количеств воды и диоксида углерода. Очистку осуществляют барботажем газа через слой сконденсировавшегося жидкого аммиака.
Пройдя слой жидкого аммиака, свежая АВС насыщается аммиаков до 3-5% и смешивается с циркуляционным газом. Смесь свежего и циркуляционного газов проходит по трубам теплообменника конденсационной колонны и направляется в межтрубное пространство выносного теплообменника 4, где нагревается до температуры не выше 195°С за счет тепла газа, выходящего из колонны синтеза. Из выносного теплообменника циркуляционный газ поступает в колонну синтеза 2, проходя снизу вверх по кольцевой щели между корпусом колонны и кожухом насадки, а затем в межтрубное пространство внутреннего теплообменника, размещенного вверху в горловине корпуса колонны. В теплообменнике газ нагревается до 400-440°С за счет тепла газа, выходящего из катализаторной коробки, последовательно проходит четыре слоя катализатора, на котором осуществляется синтез аммиака. Температурный режим перед каждой полкой поддерживают подачей газа между полками. Газ отбирают из потока перед колонной с температурой до 190°С.
Пройдя четвертый, нижний слой катализатора, азотоводородоаммиачная смесь с содержанием аммиака около 15% и температурой 500-515°С по центральной трубе поднимается вверх, входит в трубки внутреннего теплообменника, охлаждаясь до температуры 330°С, и выходит из колонны синтеза. Далее газовая смесь проходит трубное пространство подогревателя питательной воды 3, охлаждаясь до температуры 215°С. После прохождения трубного пространства выносного теплообменника 4, она охлаждается входящим циркуляционным газом до 65°С. С 65°С до 40 °С газ охлаждается в аппаратах воздушного охлаждения 5 (узел первичной конденсации), где из газа конденсируется часть аммиака. Сконденсировавшийся аммиак отделяется в сепараторе 15, а газовая смесь, содержащая 10-12% аммиака, поступает в азотоводородный компрессор, где сжимается еще раз до 30-32 МПа.
Циркуляционный газ с температурой 50°С поступает в систему вторичной конденсации, состоящую из конденсационной колонны 8 и испарителей жидкого аммиака 9. Газ подается в конденсационную колонну сверху, проходит межтрубное пространство теплообменника, охлаждаясь до 18°С газом, идущим по трубам. Далее газ поступает в испаритель жидкого аммиака, где, проходя по U-образным трубкам высокого давления, охлаждается до -5°С за счет кипения аммиака при температуре -10°С в межтрубном пространстве испарителя. Газообразный аммиак из межтрубного пространства испарителя направляется в холодильную установку для сжижения аммиака и возврата в испарители.
Из трубного пространства испарителя смесь охлажденного циркуляционного газа и сконденсировавшегося аммиака поступает в сепарационную часть конденсационной колонны, где происходит отделение жидкого аммиака от газа. Здесь же свежий газ смешивается с циркуляционным. Далее газовая смесь проходит корзину, заполненную полуфарфоровыми кольцами, где отделяется от капель жидкого аммиака, поднимается по трубкам теплообменника конденсационной колонны и направляется в выносной теплообменник, а затем – в колонну синтеза аммиака. Так циркуляционный цикл замыкается.
Жидкий аммиак после первичного сепаратора с температурой 40°С, пройдя магнитные фильтры 7, очищается от катализаторной пыли, дросселируется до давления 2 МПа и поступает в сборник жидкого аммиака 13, куда также под давлением 2 МПа поступает аммиак из конденсационной колонны. За счет дросселирования жидкого аммиака с высокого давления до давления 2 МПа происходит выделение растворенных в жидком аммиаке газов: водорода, азота, аргона и метана. Эти газы содержат около 16% аммиака. Утилизация аммиака из этих газов производится путем его конденсации в испарителе 12 на линии газов при температуре от -20 до -25°С.
Из испарителя газы и сконденсировавшийся аммиак поступают в сепаратор 15, там жидкий аммиак отделяется и подается в сборник жидкого аммиака 13. Для поддержания в циркуляционном газе содержания инертов в пределах 14-18% производят постоянный отбор части газа после первичной конденсации. Количество продувочных газов зависит от содержания инертных примесей в свежем газе, давления в системе синтеза, активности катализатора и колеблется в пределах 3-8 тыс. куб. м. Аммиак из продувочных газов выделяется пи температуре от -25 до -30°С в конденсационной колонне 10 и испарителе 11. Смесь газов и продувочных газов после выделения аммиака, аргона, водорода и гелия используют как топливный газ, для чего она направляется на сжигание и блок конвекции метана.
Основной аппарат на стадии синтеза аммиака – колонна синтеза аммиака. В колонне смесь подогревается до температуры начала реакции и проходит через слой катализатора при соблюдении необходимого температурного режима. Учитывая сложное устройство колонны и тяжелые условия работы (высокие давления и температура, содержание в среде водорода), конструктивно колонну делят на два самостоятельных элемента: корпус и детали высокого давления, рассчитанные на полное давление процесса, и внутреннюю часть (насадку), рассчитанную только на перепад давлений газового потока между входом и выходом из колонны.
В различных конструкциях вопросы отвода тепла из зоны катализа решают по-разному: тепло отводят или температуру снижают скачкообразно после каждого слоя катализатора.
При загрузке катализатором колонн синтеза необходимо решить противоречие, связанное с выбором оптимального размера зерна катализатора. При применении крупных зерен катализатор используется не полностью, использование мелкого зерна способствует высокому гидравлическому сопротивлению. Чтобы сгладить эти противоречия в крупнотоннажных производствах проводят дифференцированную загрузку катализатора, изменяя в определенном порядке диаметр его зерен по высоте колонны.
На стадии синтеза аммиака используется пусковой подогреватель с огневым обогревом. Он служит для подогрева АВС в период пуска и восстановления катализатора в колонне синтеза, а также нагрева газа при нарушениях автотермического режима в колонне синтеза. АВС нагревается за счет тепла, выделяемого при сгорании природного газа в горелках. Так как подогреватель соединен с колонной синтеза горячим трубопроводом, на котором отсутствует отключающая арматура, то подогреватель находится в течение всего периода работы колонны синтеза под давлением. Пусковой подогреватель представляет собой вертикальный аппарат, состоящий из корпуса низкого давления и змеевиков высокого давления. Аппарат футерован огнеупорным материалом, материал змеевиков принят из нержавеющей стали.
В схеме также имеется подогреватель воды, предназначенный для подогрева питательной воды за счет тепла реакции синтеза аммиака. В подогревателе воды трубные доски жестко связаны с корпусом, а прямые теплообменные трубки имеют участок, позволяющий компенсировать разность температурных удлинений корпуса и трубок. На прямых участках труб устанавливают перегородки для увеличения эффективности теплопередачи. На компенсирующих участках установка перегородок не требуется, так как на этих участках обеспечивается необходимая скорость потока. В центре устанавливают сердечник из труб с креплением его к одной трубной доске. Такая конструкция обеспечивает надежную работу теплообменника в части герметичности заделки труб при разности температур трубок и корпуса до 100°С.
Для предварительного подогрева газа, поступающего в колонну синтеза аммиака, установлен выносной теплообменник. Он вертикальный, состоит из корпуса высокого давления и насадки. Насадка представляет собой теплообменник кожухотрубчатого типа.
Для охлаждения АВС, выходящей из выносного теплообменника, и конденсации аммиака установлен блок аппаратов воздушного охлаждения. Блок состоит из шести аппаратов, каждый аппарат – из трех секций. Воздух нагнетается двумя осевыми вентиляторами, установленными под каждым аппаратом.
Сепаратор жидкого аммиака предназначен для сепарации аммиака, сконденсировавшегося в блоке аппаратов воздушного охлаждения. Аппарат горизонтального типа имеет большую поверхность сепарации, окончательная очистка от капель жидкого аммиака осуществляется в сепарирующих пакетах из металлических сеток.
Циркуляция газовой смеси в агрегате синтеза аммиака осуществляется с помощью специального компрессионного колеса, размещенного в последнем корпусе компрессора АВС.
Конденсационная колонна предназначена для рекуперации холода и сепарации аммиака, состоит из корпуса высокого давления и насадки. В сепарационную часть конденсационной колонны осуществлен подвод свежего газа в слой жидкого аммиака для удаления следов углекислоты и влаги.
Испаритель жидкого аммиака предназначен для охлаждения циркуляционного газа и конденсации аммиака. Аппарат горизонтальный с U-образными трубками. Внутри аппарата расположено сепарирующее устройство в виде сетчатых элементов.
studfiles.net
Тема №7: Производство аммиака.
Перечислите основные способы фиксации азота.
Под фиксацией азота понимаются реакции в ходе которых молекулярный азот образует различные соединения— например, реакция образования аммиака при взаимодействии азота с водородом.
Интересы ученых-биологов сфокусированы на конкретных научных направлениях, из которых можно выделить следующие:
1) поиск новых микробно-растительных азотфиксирующих сообществ и определение их роли в глобальной азотфиксирующей системе планеты;
2) исследование молекулярных механизмов взаимоотношения растений и азотфиксирующих микроорганизмов;
3) исследование физических и физико-химических основ явления азотфиксации;
4) изучение генетики азотфиксации и создание генноинженерным путем азотфиксирующих растений;
5) разработка комплекса агробиологических технологий с целью повышения продуктивности азотфиксации в растениеводстве.
Как изменилась структура сырьевой базы по мере развития азотной промышленности? Какой вид природного сырья находил практическое применение вначале для получения технологического сырья?
В чем преимущество природного газа перед другими видами природного сырья?
Преимущество природного газа(СН4):
Горение метана сопровождается незначительным выделением загрязняющих веществ, как твердых пылевых, так и газообразных: окисей азота, серы и углерода.
Метан может служить промежуточным топливом при постепенном переходе на такие альтернативные источники электроэнергии, как ветер, солнечная энергия, гидроэлектрическая энергия, энергия приливов и геотермальные источники энергии.
Метан широко распространен и доступен в большинстве городов и населенных пунктов, в непосредственной близости от конечных потребителей электроэнергии. Это значит, что для таких электростанций проще подобрать место, и они не требуют протяженных линий высоковольтных передач.
Электростанции смешанного типа, работающие на метане, достаточно эффективны.
Постоянное снабжение метаном можно организовать с помощью подземных газопроводов, экономя на энергопотреблении поездов и грузовиков, доставляющих горючее от перерабатывающего завода на электростанцию.
Электростанции, работающие на метане, можно переоборудовать для использования водорода в качестве топлива, когда водород будет доступен в достаточных количествах по приемлемым ценам.
Составьте химическую и функциональную схемы получения технологического газа для синтеза аммиака из природного газа.
Химическая схема:
Функциональная схема:
Функциональная схема синтеза аммиака: А – синтез Nh4; Б – выделение Nh4; В – компрессия и рециркуляция
Почему необходима очистка природного газа от сернистых соединений? Как и при каких условиях она осуществляется?
Очистка природного газа от серосодержащих соединений адсорбцией сероводорода, который мешает дальнейшим превращениям:
h3S + ZnO = ZnS + Н20
Конверсия метана с водяным паром. И природный газ (СН4), и вода (Н2О) являются сырьем для получения одного из компонентов для синтеза аммиака – водорода Н2. В этом превращении протекают одновременно две реакции:
СН4 + Н2О = СО + ЗН2;
СО + Н2О = СО2 + Н2.
Конверсия оксида углерода с водяным паром (в предыдущем процессе оксид углерода СО не полностью превращается в СО2 из-за равновесных ограничений):
СО + Н2О = СО2 + Н2.
После этого процесса достигается максимально возможное извлечение водорода из исходного сырья – метана СН4 и воды Н2О.
Проанализируйте химическую и функциональную схемы сероочистки.
Какими соображениями руководствуются при выборе технологического режима основных стадий паровоздушной конверсии природного газа?
Какие катализаторы применяют на стадии конверсии метана и оксида углерода? Какие примеси в газе вызывают отравления катализаторов? Каков срок их службы?
Все реакции протекают с участием катализаторов и при высоких температурах. При осуществлении процесса конвекции СН4 проводят очистку природного газа от соединений серы, которые являются каталитическими ядами, а также очистку азотоводородной смеси от оксидов углерода.
Конверсию метана осуществляют при температуре 800-900 °С на никелевом катализаторе.
Что собой представляют отходящие газы агрегатов синтеза аммиака? Как осуществляется их очистка?
Конвертированный газ, получаемый после конверсии метана, содержит 20-40% оксида углерода.
Для увеличения выхода водорода, газ после конверсии метана восстанавливают водяным паром.
Какие методы нашли практическое применение для очистки конвертированного газа от диоксида углерода? Перечислите их достоинства и недостатки.
Напишите химические реакции, лежащие в основе моноэтаноламиновой очистки. Что является побочным продуктом процесса и какое практическое применение он находит?
Абсорбция диоксида углерода – удаление СО2, полученного при получении водорода. Его поглощают раствором моноэтаноламина:
СО2 + 2RNh3 + Н2О = (RNh4)2CО3.
Обоснуйте выбор технологического режима на стадиях абсорбции CO2 и регенерации растворителя в процессе моноэтаноламиновой очистки технологического газа.
МЭА очистка – низкая стоимость, стабильность процесса, легко регенерируется, высокая поглотительная способность. При очистке газа 17-21% раствором МЭА идет 2 реакции:
2NOCH2CH2NH2+CO2+H2O=(RNH3)2CO3;
(RNH3)2CO3+CO2+H2O=2RNH3HCO3.
Какие методы очистки от оксида углерода применяют в современных технологических установках производства синтез-газа?
Очистка газа от оксида углерода СО. После конверсии СО небольшое количество СО остается, и он мешает дальнейшим превращениям. Освобождаются от него, превращая в метан:
СО + ЗН2= СН4+ Н2О.
Как осуществляется тонкая очистка конвертированного газа от оксидов углерода?
Селективными являются железо-хромовый и медьсодержащий катализаторы: первый обеспечивает достаточную скорость реакции при температуре 450-500 °С, второй активно работает при 250-300°С. Остаточная концентрация СО составляет 0,3-0,5%.
После очистки газа от оксидов углерода он поступает на синтез аммиака.
Назовите важнейшие области применения аммиака.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с). Внутрь (только в разведении) для индукции рвоты; также, в составе нашатырно-анисовых капель — в качестве муколитического (отхаркивающего) средства. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода — продукт (Nh4*h3O), представляющий собой газообразный аммиак NН3, растворенный в воде.
Составьте функциональную схему синтеза аммиака.
Агрегат синтеза аммиака (технологическая схема).

Каковы основные физико-химические особенности реакции синтеза аммиака из азота и водорода, влияющие на выбор технологического режима процесса? Учитывая эти особенности, обоснуйте выбор давления, температурного режима процесса, тип технологической схемы.
Какими соображениями руководствуются при выборе объемной скорости газа в колоннах синтеза аммиака?
Объясните механизм гетерогенно-каталитического процесса синтеза аммиака. Какими стадиями он может быть описан?
Какие катализаторы применяют при синтезе аммиака?
При синтезе аммиака из простых веществ — азота и водорода — используют в качестве катализатора используют пористое железо с примесями Al2O3 и K2O
Какие методы выделения аммиака из циркуляционного газа применяют в установках среднего давления?
Циркуляционный газ при температуре 50°С поступает в систему вторичной конденсации, включающую конденсационную колонну и испарители жидкого аммиака. В конденсационной колонне газ охлаждается до 18°С и в испарителя за счет кипения аммиака в межтрубном пространстве до — 5°С. Из трубного пространства испарителей смесь охлажденного циркуляционного газа и сконденсировавшегося аммиака поступает в сепарационную часть конденсационной колонны, где происходит отделение жидкого аммиака от газа и смешение свежей азотоводородной смеси с циркуляционным газом. Далее газовая смесь проходит корзину с фарфоровыми кольцами Рашига, где отделяется от капель жидкого аммиака, поднимается по трубкам теплообменника и направляется в выносной теплообменник, а затем в колонну синтеза.
Что собой представляют продувочные и танковые газы? Какое применение они находят?
Объясните устройство колонны синтеза. Проанализируйте режим ее работы.
Принципиальная технологическая схема синтеза аммиака в агрегате мощность 1360 т/сут на отечественном оборудовании.
Свежая азотоводородная смесь после очистки метанированием сжимается в центробежном компрессоре до давления 32 Мпа и после охлаждения в воздушном холодильнике поступает в нижнюю часть конденсационной колонны для очистки от остаточных примесей СО3, Н2О и следов масла. Свежий газ барботирует через слой сконденсировавшегося жидкого аммиака, освобождается при этом от водяных паров и следов СО2. и масла, насыщается аммиаком до 3-5% и смешивается с циркуляционным газом. Полученная смесь проходит по трубкам теплообменника конденсационной колонны и направляется в межтрубное пространство выносного теплообменника, где нагревается до 185-1950°С за счет теплоты газа, выходящего из колонны синтеза. Затем циркуляционный газ поступает в колонны синтеза.
Сформулируйте основные требования к колоннам синтеза аммиака.
Какие технологические мероприятия способствуют охране окружающей среды в производстве аммиака?
Крупнотоннажное производство аммиака характеризуют следующие выбросы в окружающую среду:
1) газовые, содержащие в своем составе аммиак, оксиды азота и углерода и другие примеси
2) сточные воды, состоящие из конденсата, продуктов промывки реакторов и систем охлаждения;
3) низко потенциальную теплоту.
Относительная концентрация токсичных примесей производства аммиака в виде оксида углерода и оксидов азота в отходящих газах невысока, но когда происходит восстановление оксидов азота до элементного азота, для устранения даже незначительных выбросов разрабатываются специальные мероприятия. Полное исключение токсичных выбросов возможно при использовании каталитической очистки в присутствии газа-восстановителя.
studfiles.net
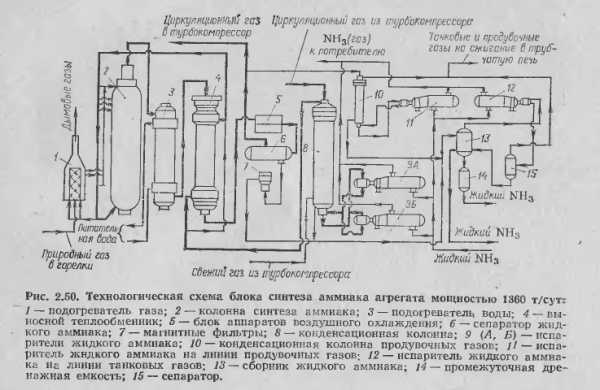
Производство аммиака мощностью 1360 т/сут
Проектируемая колонна конденсации входит в состав технологической схемы производства аммиака. На основании проведенного анализа состояния вопроса выбрана технологическая схема синтеза аммиака мощностью 1360 т/сут на отечественном оборудовании.
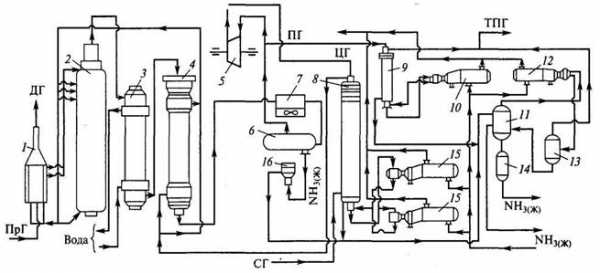 Технологическая схема производства аммиака мощностью 1360 т/сут
Технологическая схема производства аммиака мощностью 1360 т/сут1 – подогреватель газа, 2 – колонна синтеза аммиака, 3 – подогреватель воды, 4 – выносной теплообменник; 5 – циркуляционное колесо компрессора; 6 – сепаратор жидкого аммиака; 7 – блок аппаратов воздушного охлаждения; 8 – конденсационная колонна; 9 – конденсационная колонна продувочных газов; 10 – испаритель жидкого аммиака на линии продувочных газов, 11 – сборник жидкого аммиака, 12 – испаритель жидкого аммиака на линии танковых газов; 13 – сепаратор; 14 – промежуточная дренажная емкость; 15 – испарители жидкого аммиака; 16 – магнитный фильтр
Свежая азотоводородная смесь после очистки метанированием сжимается в центробежном компрессоре до давления 32 МПа и после охлаждения в воздушном холодильнике (на схеме не показан) поступает в нижнюю часть конденсационной колонны 8 для очистки от остаточных примесей СО2, Н2О и следов масла. Свежий газ барботирует через слой сконденсировавшегося жидкого аммиака, освобождается при этом от водяных паров и следов СО2 и масла, насыщается аммиаком до 3–5% и смешивается с циркуляционным газом. Полученная смесь проходит по трубкам теплообменника конденсационной колонны и направляется в межтрубное пространство выносного теплообменника 4, где нагревается до 185 –195 °С за счет теплоты газа, выходящего из колонны синтеза. Затем циркуляционный газ поступает в колонну синтеза 2.
В колонне синтеза газ проходит снизу вверх по кольцевой щели между корпусом колонны и кожухом насадки и поступает в межтрубное пространство внутреннего теплообменника, размещенного в горловине корпуса колонны синтеза. В теплообменнике циркуляционный газ нагревается до температуры начала реакции 400–440 °С за счет теплоты конвертированного газа и затем последовательно проходит четыре слоя катализатора, в результате чего концентрация аммиака в газе повышается до 15%. Пройдя через центральную трубу, при температуре 500–515 °С азотоводородоаммиачная смесь направляется во внутренний теплообменник, где охлаждается до 330°С. Дальнейшее охлаждение газовой смеси до 130 °С осуществляется в трубном пространстве подогревателя питательной воды 3, в трубном пространстве выносного теплообменника 4 до 65 °С за счет холодного циркулирующего газа, идущего по межтрубному пространству, и затем в аппаратах воздушного охлаждения 7 до 40 °С, при этом часть аммиака конденсируется. Жидкий аммиак, сконденсировавшийся при охлаждении, отделяется в сепараторе 6, а затем смесь, содержащая 10–12% NH3, идет на циркуляционное колесо компрессора 5 азотоводородной смеси, где сжимается до 32 МПа.
Циркуляционный газ при температуре 50 °C поступает в систему вторичной конденсации, включающую конденсационную колонну 8 и испарители жидкого аммиака 15. В конденсационной колонне газ охлаждается до 18 °С и в испарителях за счет кипения аммиака в межтрубном пространстве до –5 °С. Из трубного пространства испарителей смесь охлажденного циркуляционного газа и сконденсировавшегося аммиака поступает в сепарационную часть конденсационной колонны, где происходит отделение жидкого аммиака от газа и смешение свежей азотоводородной смеси с циркуляционным газом. Далее газовая смесь проходит корзину с фарфоровыми кольцами Рашига, где отделяется от капель жидкого аммиака, поднимается по трубкам теплообменника и направляется в выносной теплообменник 4, а затем в колонну синтеза 2.
Жидкий аммиак из первичного сепаратора проходит магнитный фильтр 16, где из него выделяется катализаторная пыль, и смешивается с жидким аммиаком из конденсационной колонны 8. Затем его дросселируют до давления 4 МПа и отводят в сборник жидкого аммиака 11.
В результате дросселирования жидкого аммиака до 4 МПа происходит выделение растворенных в нем газов Н2, N2, O2, СН4. Эти газы, называемые танковыми, содержат 16–18% NH3. Поэтому танковые газы направляют в испаритель 12 с целью утилизации аммиака путем его конденсации при –25 °С. Из испарителя танковые газы и сконденсировавшийся аммиак поступают в сепаратор 13 для отделения жидкого аммиака, направляемого в сборник жидкого аммиака 11.
Для поддержания в циркуляционном газе постоянного содержания инертных газов, не превышающего 10%, производится продувка газа после первичной конденсации аммиака (после сепаратора 6).
Продувочные газы содержат 8–9% NH3, который выделяется при температуре 25–30 °C в конденсационной колонне 9 и испарителе 10 продувочных газов. Смесь танковых и продувочных газов после выделения аммиака используют как топливный газ.
vector-study.ru
Констпект урока на тему Производство аммиака
Аммиа́к — Nh4, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Плотность аммиака почти вдвое меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007[1]. Растворимость Nh4 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуяион аммония Nh5+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
infourok.ru
Производство аммиака: краткая характеристика
Муниципальное образовательное учреждение
Новосафоновская средняя общеобразовательная школа
Производство аммиака: краткая характеристика
Прокопьевский район 2006
Содержание
Введение
1.Способы получения аммиака
2. Современный процесс получения аммиака
Список использованной литературы
Введение
Общей экономической задачей каждого химического предприятия является получение химических веществ высокого качества и в достаточном количестве, чтобы их реализация приносила прибыль. С этим связано требование, чтобы все ресурсы использовались как можно более эффективно. Однако этого можно достичь лишь в том случае, если максимально эффективен сам химический процесс. В химической промышленности вместо понятия «реагенты» гораздо чаще используются термины «исходные материалы», «сырьевые материалы» или просто сырьё», иногда — «руда». Чтобы какой-либо процесс был экономически оправдан, необходимо достичь оптимального выхода целевого продукта из сырьевых материалов. Оптимальный выход не обязательно совпадает с теоретическим выходом или даже с максимально достижимым выходом. Получение максимально достижимого выхода может, например, потребовать слишком большого расхода какого-либо дорогостоящего исходного материала, или же слишком длительного проведения процесса, или же создаются экстремальные условия (очень высокие температуры или давления), чреватые опасными аварийными ситуациями и т.п., — всё это может сделать максимально достижимый выход экономически невыгодным.
Фактический выход каждого конкретного химического процесса может зависеть от целого ряда факторов, главные из них — температура, давление, присутствие катализатора, чистота исходных материалов, эффективность извлечения конечного продукта. Промышленное производство веществ подразумевает отличное знание теоретических закономерностей протекания химических реакций (энергетика химических реакций, химическая кинетика и катализ, химическое равновесие).
Все перечисленные ниже факторы важны, в особенности, если речь идёт о таких многотоннажных производствах, таких, как, например, производство аммиака.
Проектировщики химических предприятий создают сверхмощные установки по производству аммиака. Так, например, созданы установки, производящие 1000-1200 тонн аммиака в сутки. В настоящее время во всём мире ежегодно производится около 5 млн. тонн аммиака.
1. Способы получения аммиака
аммиак цианамидный процесс десульфуратор
Первым промышленным процессом, который использовался для получения аммиака, был цианамидный процесс. При нагревании извести СаО и углерода получали карбид кальция СаС2. Затем карбид нагревали в атмосфере азота и получали цианамид кальция СаСN2; далее аммиак получали гидролизом цианамида:
СаСN2(тв) + 3Н2О = 2NН3↑ + СаСО3(тв)
Этот процесс требовал больших затрат энергии и экономически был невыгоден.
В 1908 г. Немецкий химик Ф. Габер обнаружил, что аммиак можно получать из водорода и атмосферного азота на железном катализаторе. Первый завод по производству аммиака этим методом использовал водород, который получали электролизом воды. В последствии водород стали получать из воды путём восстановления коксом. Такой способ получения водорода намного экономичнее. После открытия Габера стремительно стало расти производство аммиака, это неудивительно, поскольку огромные количества аммиака необходимы для получения азот содержащих удобрений. На изготовление их используется приблизительно 80% всего получаемого в мире аммиака. Вместе с азотсодержащими удобрениями в почву вносится в растворимой форме азот, в котором нуждается большинство растений. Остальные ≈20% производимого аммиака используются для получения полимеров, взрывчатых веществ, красителей и других продуктов.
Современный процесс получения аммиак основан на его синтезе из азота и водорода с использованием специального катализатора:
N2 + 3Н2 ↔ 2NН3 ↑ + 45,9 кДж (1)
Поскольку данная реакция обратимая, возникает вопрос: при каких температурах и давления выгоднее всего добиваться максимального выхода
продукта? Так как реакция экзотермическая, то исходя из принципа Ле Шателье ясно, что чем ниже температура процесса, тем больше равновесие будет сдвигаться в сторону образования аммиака, и можно предположить, что следует максимально понижать температуру. Но в действительности всё обстоит сложнее: при низких температурах реакция практически не идёт, поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости — высокая температура, на практике процесс проводят при температуре ≈ 400 – 500 оС.
Но даже при такой высокой температуре для достижения достаточной скорости реакции требуется присутствие специального катализатора. В качестве катализатора используется губчатое железо, активированное оксидами калия и алюминия.
Из уравнения реакции видно, что общее число молей уменьшается от 4 до 2. Согласно принципу Ле Шателье в таком случае процесс выгодно проводить, повышая давление. Но этот вывод лишь качественный, анна практике нужно точно знать, насколько увеличится выход NН3 (на 10% или всего на 0,1%) при увеличение давления. В таблице 1 количественно показано влияние температуры и давления на выход аммиака (процентное содержание аммиака в равновесной смеси) по реакции.
Из этой таблицы видно, что повышение температуры при любом давлении заметно снижает содержание аммиака в газовой смеси, однако при температурах ниже 500 оС скорость реакции очень мала, поэтому на практике процесс обычно проводят при температуре 450 оС.
Таблица 1
Что касается давления, то здесь используется давления порядка 300 – 100 атм, но чаще всего «среднее» давление ≈ 250 атм. Хотя при этих условиях только около 20% исходных веществ превращается в аммиак, однако в результате использования циркуляционной технологической схемы (введение непрореагировавших Н2 и N2 вновь в реакцию) суммарная степень превращения исходных веществ в аммиак является очень высокой.
2. Современный процесс получения аммиака
Работа современного аммиачного завода очень сложна. Это утверждение кажется удивительным, если «ориентироваться» только лишь на достаточно просто выглядящее уравнение реакции (1), являющееся основой синтеза аммиака. Однако утверждение о сложности промышленного синтеза аммиака не покажется чрезмерным уже после первого ознакомления со схемой действия аммиачного завода, работающего на природном газе (рис.1). Первая стадия в процессе синтеза аммиака включает десульфуратор. Десульфуратор — техническое устройство по удалению серы из природного газа. Это совершенно необходимая стадия, поскольку сера представляет собой каталитический яд и «отравляет» никелевый катализатор на последующей стадии получения водорода.
Вторая стадия промышленного синтеза аммиака предполагает конверсию метана (промышленное получение водорода). Конверсия метана — это обратимая реакция, протекающая при 700 – 800 оС и давлении 30 – 40 атм с помощью никелевого катализатора при смешивании метана с парами воды:
СН4 + Н2О ↔ СО + 3Н2 (2)
Образовавшийся по данной реакции водород, казалось бы, уже можно использовать для синтеза аммиака по реакции (1) — для этого необходимо запустить в реактор воздух содержащий азот. Так и поступают на стадии (3), однако на этой стадии происходят другие процессы.
Происходит частичное сгорание водорода в кислороде воздуха:
2Н2 + О2 = Н2О(пар)
В результате на этой стадии получается смесь водяного пара, оксида углерода (II) и азота. Водяной пар, в свою очередь, восстанавливается снова с образованием водорода, как на второй стадии по торой стадии по им образом, после первых трёх стадий имеется смесь водорода, азота и «нежелательного» оксида углерода (
mirznanii.com
