Сульфат алюминия, характеристика, свойства и получение, химические реакции
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия
Физические свойства сульфата алюминия
Получение сульфата алюминия
Химические свойства сульфата алюминия
Химические реакции сульфата алюминия
Применение и использование сульфата алюминия
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Сульфат алюминия – неорганическое химическое соединение, соль серной кислоты и алюминия.
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Гигроскопичен.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.) алюминий сернокислый (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные гексагональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | сладковато-терпкий |
| Запах | без запаха |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. ) ) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2710 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см | 2,710 |
| Температура разложения, °C | 770 |
| Температура плавления, °C | 770 |
| Молярная масса, г/моль | 342,15 |
| Гигроскопичность | гигроскопичен |
| Растворимость в воде (25 oС), г/100 г | 38,5 |
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
- 1. взаимодействия сульфата меди и алюминия:
3CuSO4 + 2Al → 3Cu + Al2(SO4)3.
- 2. взаимодействия оксида алюминия и гидросульфата калия:
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
Химические свойства сульфата алюминия аналогичны свойствам сульфатов других металлов. Однако, сульфат алюминия не реагирует с кислотами. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4.
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия:
Al2(SO4)3 + 6KOH → 2Al(OH)3 + 3K2SO4.
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития:
Al2(SO4)3 + 6LiOH → 2Al(OH)3 + 3Li2SO4.
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
Al2(SO4)3 + 3Ba(NO3)2 → 3BaSO4 + 2Al(NO3)3.
В результате реакции образуются сульфат бария и нитрат алюминия.
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
Al2(SO4)3 + 3Pb(NO3)2 → 3PbSO4 + 2Al(NO3)3.
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия:
2Na3PO4 + Al2(SO4)3 → 2AlPO4 + 3Na2SO4.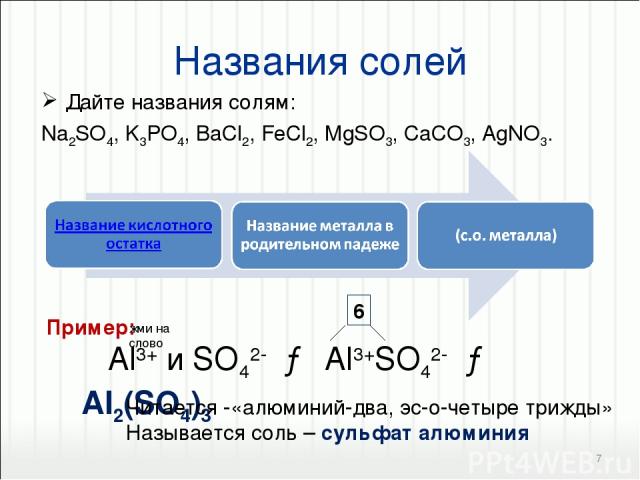
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия:
2K3PO4 + Al2(SO4)3 → 2AlPO4 + 3K2SO4.
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
3Ca(HCO3)2 + Al2(SO4)3 → 2Al(OH)3 + 3CaSO4 + 6CO2.
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2SO4.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
11. реакция термического разложения сульфата алюминия:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2 (t = 770-860°C).
В результате реакции образуются оксид алюминия, оксид серы (IV) и кислород.
12. реакция термического разложения октадекагидрата сульфата алюминия:
Al2(SO4)3•18H2O → Al2(SO4)3 + 18H2O (t = 420 °C).
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфат алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата алюминия
реакции
Коэффициент востребованности 4 474
Сульфат алюминия от ООО «ХИМСТАР» с доставкой по РФ и СНГ!
Сернокислый алюминий — это самый распространенный коагулянт, применяемый для очистки воды от коллоидных частиц (наиболее мелких размеров). Это свойство сульфата алюминия связано с легкостью его получения и невысокой стоимостью.
Это свойство сульфата алюминия связано с легкостью его получения и невысокой стоимостью.
Сернокислый алюминий — это сложное неорганическое вещество.
Al₂(SO₄)₃ очень гигроскопична. Отличается быстрой растворимостью в воде. Вещество плавится при температуре +700 °C, плотность его равняется 1,62–2,67 г/см³.
Способы получения сульфата алюминия.
Соль выпускают 3 сортов. Продукт высшего сорта востребован в пищевой и фармацевтической промышленности, а соль 1 и 2 сорта подходит для технических целей. Сернокислый алюминий получают несколькими способами:
Соль высшего сорта получают в результате реакции замещения между гидроксидом алюминия и серной кислотой высокой концентрации. В результате этого процесса алюминий, отличающийся большей активностью, занимает место водорода в составе кислоты. По окончании реакции получают 1 молекулу соли сульфата алюминия и 6 молекул воды. Полученный коагулянт имеет высокий процент чистоты с минимальной долей примесей. Получить соль технического качества можно в результате обработки серной кислотой бокситов или глиноземов. Этот метод также основан на реакции по замене молекул водорода алюминием. В результате метода получают соль 1–2 сорта. Высвобожденный водород поднимается в атмосферу. Этот метод является промежуточным процессом для получения чистого алюминия из бокситов. Еще один способ — это получить коагулянт из оксида, обработанного серной кислотой.
Этот метод также основан на реакции по замене молекул водорода алюминием. В результате метода получают соль 1–2 сорта. Высвобожденный водород поднимается в атмосферу. Этот метод является промежуточным процессом для получения чистого алюминия из бокситов. Еще один способ — это получить коагулянт из оксида, обработанного серной кислотой.
Применение:
Очистка промышленных и питьевых вод.
Очищение сточных вод и обезвоживание осадка.
Также используется в сельском хозяйстве, при производстве бумаги, в нефтехимической, текстильной и горной отраслях промышленности, при изготовлении косметической продукции и пр.
Применение сульфата алюминия в очистке водопроводной воды.
Полученное из глиноземов или бокситов вещество применяют как сильный коагулянт для очистки воды от коллоидных частиц. Данные частицы обладают отрицательным электрическим зарядом. К коллоидным частицам присоединяются ионы из окружающего их раствора с положительным зарядом. Это создает на их поверхности двойной электрический слой. В результате коллоидные частицы начинают отталкиваться друг от друга. У них небольшой удельный вес, и они находятся во взвешенном состоянии.
В результате коллоидные частицы начинают отталкиваться друг от друга. У них небольшой удельный вес, и они находятся во взвешенном состоянии.
Коагулянт (в данном случае — это сульфат алюминия) несет на себе положительный ион. Он сжимает двойной электрический слой и нейтрализует его. Частицы получают дестабилизированный вид. Они окружают коагулянт при установлении контакта с ним. Если смесь в этот момент быстро перемешать, то химическое вещество получит однородную дисперсию. Это позволит увеличить максимальный контакт между частицами.
Если перемешивать смесь несколько минут, то примеси коагулируют в более крупные хлопья. Крупные частицы, увеличиваясь в размерах и приобретая больший вес, начинают осаждаться под действием силы тяжести.
Очищенная вода теоретически должна быть чистой, без любых примесей. Но на практике коагулянт содержится в очищенной воде. Чем жестче вода, тем выше его концентрация. Это связано с тем, что в жесткой воде есть большое содержание гидроксида кальция и карбоната натрия, вступающих в реакцию с сульфатом алюминия и осаждающих алюминий в виде нерастворимого студенистого осадка гидроксида алюминия. Для измерения концентрации коагулирующего вещества в воде применяют концентратомеры, или солемеры. Хотя на самом деле концентратомерами называют приборы, определяющие концентрацию кислот и щелочей. Солемеры устанавливают для определения концентрации растворов солей.
Для измерения концентрации коагулирующего вещества в воде применяют концентратомеры, или солемеры. Хотя на самом деле концентратомерами называют приборы, определяющие концентрацию кислот и щелочей. Солемеры устанавливают для определения концентрации растворов солей.
Применение в пищевой и фармацевтической промышленности.
Сульфат алюминия известен как алюминиевые квасцы, или добавка E 520.
В пищевом производстве E 520 относится к стабилизаторам. Его получают из природных руд: боксита, алунита, глиноземов. Они подвергаются реакции с серной кислотой высокой концентрации при температурах +100…+250 °C. По окончании процесса получают соль с высоким коэффициентом чистоты.
Свойства стабилизатора:
- порошок или пластинки белого цвета с серым, розовым или голубоватым оттенком;
- без запаха;
- отличается хорошей растворимостью в воде, плохо взаимодействует со спиртом;
- концентрация — не меньше 99,5%.
- вкус добавки — сладковатый и терпкий
- очень гигроскопичное вещество, выветривается на воздухе.

Добавка E 520 отпускается в таре с дополнительными вставками, защищающими содержимое от влаги.
Сульфат алюминия применяют в рыбоперерабатывающей отрасли для сохранения товарного вида рыбы и предупреждения распада волокон. Стабилизатор используется при консервировании плодов и овощей. Добавка используется в кондитерской промышленности в производстве засахаренных и глазированных в сахаре фруктов.
Но основное применение добавки E 520 – для очистки питьевых и сточных вод. Вещество взаимодействует с примесями, которые выпадают в осадок. Он оседает на дно емкостей или водоемов. Вода пропускается поточным методом через систему специальных фильтров, где очищается и осветляется, после чего становится пригодной для питья и применения в производстве.
Другие области применения.
Сульфат алюминия также используется:
- в косметической промышленности, входит в составы декоративной косметики;
- при производстве бытовой химии — в составе антиперспирантов;
- как компонент обезболивающих средств от укусов насекомых;
- в сельском хозяйстве для обработки почв – входит в состав ядов и удобрений для борьбы с вредителями;
- в текстильном производстве входит в состав красителей;
- является компонентом нерастворимых пигментов в печатном деле.

Вещество применяется как гидроизолятор в бетонных конструкциях. Сульфат алюминия используется в производстве огнетушителей.
Им обрабатывают шерстяные ткани для удерживания красящих пигментов. Процесс называется протрава шерстяных волокон. В водном растворе образуется дисперсная гидроокись алюминия, которая поглощается и хорошо удерживается волокнами шерсти. Протравленные волокна приобретают способность поглощать красители за счет адсорбированной ими гидроокиси алюминия.
Исследование процесса выщелачивания алюминия из каолиновых глин Ангренского месторождения
Приведены результаты исследований по вовлечению каолиновых глин Ангренского месторождения в процессе получения сульфата алюминия – эффективного коагулянта. Показано, что прокалка каолиновых глин при температуре 650ОС в течение 2 часов позволяет повысить степень извлечения алюминия до 96,1%.
Максимальная степень извлечения алюминия при концентрации серной кислоты 60% составляет 97,1%, степень извлечения железа при этом 82,5%.
При повышении нормы серной кислоты с 50% до 125% степени извлечения алюминия и железа возрастают и достигают значений 78,2-99,8% и 84,6-88,8%. С повышением концентрации серной кислоты с 50% до 55% и 60% степень извлечения железа снижается с 83,5% до 82,5% при норме кислоты 100%, алюминия возрастает с 75,7 до 97,1%.
ABSTRACT
The results of research on the involvement of caolin clays of Angren deposit in the process of obtaining aluminum sulfate — an effective coagulant are presented. It is shown that calcination of caolin clays at 650° C for 2 hours makes it possible to increase degree of aluminum recovery to 96.1%.
The maximum degree of extraction of aluminum at concentration of sulfuric acid 60% is 97.1%, the degree of iron recovery is 82.5%.
With an increase in the sulfuric acid rate from 50% to 125%, the aluminum and iron recovery rates increase and reach 78.2-99.8% and 84.6-88.8%. With an increase concentration of sulfuric acid from 50% to 55% and 60%, the degree of recovery iron decreases from 83. 5% to 82.5% with an acid rate of 100%, aluminum increases from 75.7 to 97.1%.
5% to 82.5% with an acid rate of 100%, aluminum increases from 75.7 to 97.1%.
Ключевые слова: алюмосиликат, каолин, алюминий, сульфат алюминия, прокалка, серная кислота, выщелачивание, степень извлечения, химический состав.
Keywords: aluminosilicate, caolin, aluminum, aluminum sulphate, calcination, sulfuric acid, leaching, degree of extraction, chemical contents.
Алюмосиликаты, т.е. каолинитовые, монтмориллонитовые глины, алуниты и другие минералы являются очень ценным сырьем в производстве огнеупоров, керамики и используются для получения бумаги, сульфата алюминия, глинозема и др. химических веществ.
Из алюмосиликатов большое народнохозяйственное значение имеют каолины, алуниты, нефелины, бокситы, монтмориллониты. Они используются в алюминиевом производстве, из них изготавливают фарфор, керамзит, глиняную посуду, сувениры, силикатные кирпичи, бентопорошки и др.
Каолины относиться к группе мономинеральных глин. Глины отличаются от каолинов более высокой дисперсностью частиц каолинита, большей пластичностью, способностью спекаться при высоких температурах и содержат более 50% минерала каолинита – Al 2Si2O5(OH)4. В глинах преобладают частицы менее 2 мкм, в каолинах – менее 5 мкм.
Глины отличаются от каолинов более высокой дисперсностью частиц каолинита, большей пластичностью, способностью спекаться при высоких температурах и содержат более 50% минерала каолинита – Al 2Si2O5(OH)4. В глинах преобладают частицы менее 2 мкм, в каолинах – менее 5 мкм.
В Узбекистане разведано 2 крупных месторождения каолина – Ангренское в Ташкентской и Альянс – в Самаркандской областях [2, 5].
Однако, каолинитовые глины из-за низкого содержания алюминия (Al2O3 = 13-25%), высокого содержания железа (Fe2O3 = 1,5-6,0% иногда до 12%) и оксида кремния (30-80%) в настоящее время не перерабатываются. На окраинах города Ангрен имеется более 0,45 миллиарда тонн серых вторичных каолинов, состава Al2O3 = 19-25%; Fe2O3 = 1,5-4,5%; SiО2 = 40-58% и др.
Сырьевые ресурсы алюминия разнообразны, имеют свойственный только им состав, отличаются кристаллической структурой вследствие чего отличаются по выходу основного вещества при кислотно-щелочной переработке.
Кислотные методы переработки алюминийсодержащего сырья предусматривают стадию предварительного обжига для перевода алюмосиликатов в более растворимую в кислотах форму.
Интерес к азотнокислотному вскрытию алюминийсодержащего сырья связан с легкостью регенерации кислоты путем термического гидролиза. При вскрытии непрокаленного аргиллита и боксита 40% кислотой степень извлечения не превышает 35-54%, соответственно. Использование предварительного обжига при температуре 650-7500С в течение 3 часа позволяет повысить степень извлечения алюминия до 81,6 и 98,32% соответственно [1].
Степень извлечения оксида алюминия из владимирских каолинов 20%-ной Н2SO4, не превышает 2-3% [6]. С увеличением температуры обжига образуется высокоактивный метакаолинит, легко разлагаемый серной кислотой по реакции:Al2O3 · 2SiO2 + 3H2SO4 = Al2(SO4)3 + 2SiO2+ 3H2O (1)
Степень извлечения оксида алюминия в раствор в результате этого резко повышается до 90%. С увеличением температуры обжига до 8500С и особенно до 9000С извлечение алюминия в раствор снижается, что объясняется образованием у-Al2O3 и муллита, труднорастворимых в серной кислоте [4]. Кремнезем в растворах Н2SO4 растворяется незначительно, и его содержание в сульфатном растворе невелико (0,1-0,2 г/дм
С увеличением температуры обжига до 8500С и особенно до 9000С извлечение алюминия в раствор снижается, что объясняется образованием у-Al2O3 и муллита, труднорастворимых в серной кислоте [4]. Кремнезем в растворах Н2SO4 растворяется незначительно, и его содержание в сульфатном растворе невелико (0,1-0,2 г/дм
Сульфат алюминия являются наиболее эффективным и широко применяемым коагулянтом, который находит широкое применение в промышленности при очистке производственных и сбросных вод, водоподготовке, в целлюлозно-бумажной промышленности, дублении кожи, крашении тканей [3]. Однако, несмотря на наличие мощной сырьевой базы для производства коагулянтов на основе солей алюминия они в Республике не производятся и завозятся в большем количестве из-за рубежа.
Поэтому исследования, направленные на переработку имеющихся каолиновых глин, на получение коагулянта – сульфата алюминия являются актуальными.
С целью переработки каолиновых глин Ангренского месторождения на сульфат алюминия изучено влияние продолжительности процесса термообработки каолиновых глин, нормы и концентрации серной кислоты, температуры, продолжительности процесса разложения каолина растворами серной кислоты на степень извлечения оксида алюминия в раствор.
Для исследований использовали каолиновые глины Ангренского месторождения, содержащие (масс. %): Al2O3 = 21,73; Fe2O3 = 1,68; SiO2 = 65,2; TiO2 = 0,4; СаО = 0,4; MgO = 0,65; R2O = 0,8; SO3 = 0,6; п.п.п. = 8,5.
На рисунке 1 приведены данные влияние продолжительности прокалки при температуре 650ОС на степень извлечения оксидов алюминия и железа в раствор 60%-ной серной кислоты при ее норме 100%.
Из рисунка видно, что с увеличением продолжительности прокалки с 30 мин до 300 мин степень извлечения алюминия повышается с 56,5% до 96,1%, при этом степень извлечения железа составляет 81,8%. Повышение продолжительности прокалки свыше 1 часа практически не влияет на степень извлечения оксидов алюминия и железа.
Дальнейшие исследования были направлены на изучения влияния технологических параметров на степень извлечения оксидов алюминия и железа из прокаленных каолиновых глин Ангренского месторождения.
Влияние концентрации серной кислоты изучали при 100%-ной норме, температуре 800С и продолжительности процесса 1 час. Полученные результаты приведены в таблице 1.
Из таблицы видно, что максимальная степень извлечения оксида алюминия отмечается при концентрации серной кислоты 60%. При этом степень извлечения алюминия составляет 97,1%, а железа 82,5%.
Рисунок 1. Влияние продолжительности процесса прокалки на степень извлечения: 1 – Al2O3, 2 – Fe2O3
Таблица 1.
Влияние концентрации серной кислоты на степень извлечения алюминия из прокаленного каолина
|
Концентрация H2SO4, % |
Степень извлечения, % |
|
|
Al2O3 |
Fe2O3 |
|
|
20 |
5,1 |
51,1 |
|
30 |
30,3 |
65,4 |
|
40 |
54,8 |
76,3 |
|
50 |
78,4 |
83,6 |
|
60 |
97,1 |
82,5 |
|
70 |
85,2 |
67,2 |
|
80 |
69,0 |
48,3 |
|
90 |
47,6 |
27,8 |
В таблице 2 приведены данные влияния нормы серной кислоты на степень извлечения оксидов алюминия и железа при концентрации кислоты 50, 55 и 60%, температуре 800С и продолжительности процесса 1 час.
Таблица 2.
Влияние нормы и концентрации серной кислоты на степень извлечения оксида алюминия из прокаленного каолина
|
Норма H2SO4, % |
Степень извлечения, % |
|
|
Al2O3 |
Fe2O3 |
|
|
H2SO4— 50% |
||
|
50 |
36,4 |
33,6 |
|
75 |
59,5 |
63,6 |
|
100 |
75,7 |
83,5 |
|
125 |
78,2 |
88,8 |
|
H2SO4— 55% |
||
|
50 |
40,7 |
30,3 |
|
75 |
67,1 |
62,7 |
|
100 |
89,4 |
83,1 |
|
125 |
92,8 |
87,4 |
|
H2SO4— 60% |
||
|
50 |
43,6 |
28,2 |
|
75 |
71,8 |
61,8 |
|
100 |
97,1 |
82,5 |
|
125 |
99,8 |
84,6 |
Из таблицы 2 видно, что с повышением нормы серной кислоты степени извлечения оксидов алюминия и железа возрастают и достигают значений 78,2-99,8 % и 84,6-88,8%, соответственно. Однако, с повышением концентрации серной кислоты с 50% до 60% степень извлечения окислов железа в раствор снижается. Так, при норме серной кислоты 100% степень извлечения оксида алюминия повышается с 75,7 до 97,1%, тогда как степень извлечения оксида железа снижается с 83,5 до 82,5%.
Однако, с повышением концентрации серной кислоты с 50% до 60% степень извлечения окислов железа в раствор снижается. Так, при норме серной кислоты 100% степень извлечения оксида алюминия повышается с 75,7 до 97,1%, тогда как степень извлечения оксида железа снижается с 83,5 до 82,5%.
Приведенные исследования показали возможность переработки каолинов Ангренского месторождения сернокислотным методом. Для этого необходимо каолиновые глины прокалить при температуре 650-700ОС в течение не менее 1 часа, а выщелачивание осуществлять серной кислотой с концентрацией 60% при норме кислоты не менее 100% из расчете на оксиды металлов. При этом степень извлечения алюминия составляет 97,1%, железа 82,5%.
Список литературы:
1. Вайтнер В.В., Калиниченко И.И. Выщелачивание аргиллита азотной кислотой // Журнал «Вестник УГТУ-УПИ», № 3 (23), 2003. – С. 185-191.
2. Геология и полезные ископаемые Республики Узбекистан / Т.Н. Долимов, Т.Ш. Шаякубов и др. Редкол.:
Редкол.:
Т.Ш. Шаякубов. – Т.: Университет, 1998. – С. 602-603.
3. Запольский А.К, Баран А.А. Коагулянты и флокулянты в процессах очистки воды: Свойства. Получения. Применения. – Л.: Химия, 1987. – 208 с.
4. Лайнер Ю.А. Комплексная переработка алюминийсодержащего сырья кислотным способами. – М.: Наука, 1982. – С. 72.
5. Пак А.И., Чиж Л.М. «Первичные и вторичные каолины Западного Узбекистана». В кн.: Генезис и ресурсы каолинов и огнеупорных глин. – М.: Наука, 1990. – С. 94-96.
6. Петров В.П. Условия образования каолинов и их свойства //Каолины. – М.: Наука, 1974. – 152 с.
{2-}$ ионов, в то время как другие утверждают, что сульфат алюминия будет реагировать с водой с образованием гидроксида алюминия и серной кислоты.
Я даже провел мини-лабораторию, поместив сульфат алюминия в воду, и иногда выпадал осадок (предположительно гидроксид алюминия), а иногда его не было.
Что происходит на самом деле?
- кислотно-щелочной
- механизм реакции
- экспериментальная химия
$\endgroup$
$\begingroup$ 9\circ C}$
Вы заявили, что использовали $12\\mathrm g$ в $100\\mathrm{mL}$, поэтому кажется, что они полностью растворились. Однако в этой ситуации, поскольку он не растворяется в очень большом количестве воды, он не диссоциирует и не образует гидроксид алюминия. Сульфат алюминия можно использовать в очистке воды в небольших количествах, потому что он заставляет примеси группироваться в более крупные частицы, а затем легче оседать на дно контейнера (или отфильтровываться). Твердое вещество, которое вы иногда видите, — это примеси воды, которые сгруппировались и выглядят как осадок. Если вы используете более чистую воду, вы увидите меньше этих нечистых твердых частиц или, возможно, ничего, если вода достаточно чистая (например, если это дистиллированная вода).
Однако в этой ситуации, поскольку он не растворяется в очень большом количестве воды, он не диссоциирует и не образует гидроксид алюминия. Сульфат алюминия можно использовать в очистке воды в небольших количествах, потому что он заставляет примеси группироваться в более крупные частицы, а затем легче оседать на дно контейнера (или отфильтровываться). Твердое вещество, которое вы иногда видите, — это примеси воды, которые сгруппировались и выглядят как осадок. Если вы используете более чистую воду, вы увидите меньше этих нечистых твердых частиц или, возможно, ничего, если вода достаточно чистая (например, если это дистиллированная вода).
$\endgroup$
9
$\begingroup$
Я предполагаю, что вы измеряете 12 мл в колбе. Это очень необычно, потому что сульфат находится в твердой форме, поэтому лучше всего взвесить образец на весах, чтобы определить компонент растворимости, который нужно удерживать в объеме воды.
Предполагается, что плотность квасцов в негидратированной форме составляет 2,572 г на мл, следовательно, у вас есть 32,064 г безводной формы. Растворимость в воде от 31 до 36 г на 100 мл. Вы добавляете в 100 мл воды в лабораторных аналитических условиях. Следовательно, вы приближаетесь слишком близко к спискам растворимости при комнатной температуре.
Другим эффектом, который следует учитывать, является резкое увеличение удельного веса. Объем воды в растворе уменьшится, чтобы компенсировать конечный удельный вес 1,33. Это насытит раствор и выпадет в осадок, чтобы приспособиться к удельному весу и нормальной растворимости раствора при температуре.
Эта таблица поможет вам оценить, как соотношение веса сульфата и объема воды влияет на удельную плотность раствора сульфата алюминия: Ind. Eng. хим. , 1945, 37 (10), 1016–1018
$\endgroup$
$\begingroup$
Сульфат алюминия диссоциирует в воде с образованием ионов. Это правда. Однако большинство катионов с двойным и тройным положительным зарядом очень прочно связывают воду. Сильный положительный заряд делает атомы водорода ассоциированной молекулы воды кислыми, поэтому она легко диссоциирует на катион водорода и гидроксидную группу, связанную с ионом алюминия. Полученная структура может ассоциироваться с другим ионом алюминия, в конечном итоге образуя большую сеть гидроксида алюминия.
Это правда. Однако большинство катионов с двойным и тройным положительным зарядом очень прочно связывают воду. Сильный положительный заряд делает атомы водорода ассоциированной молекулы воды кислыми, поэтому она легко диссоциирует на катион водорода и гидроксидную группу, связанную с ионом алюминия. Полученная структура может ассоциироваться с другим ионом алюминия, в конечном итоге образуя большую сеть гидроксида алюминия.
Тем не менее, эта тема избегается в школьной химии для удобства, потому что химия большая, нелогичная и не подчиняется простым правилам.
В целом можно с уверенностью предположить, что по крайней мере некоторый гидролиз происходит для сульфата алюминия, если только не используется сильнокислый раствор. Гидролиз может быть завершен, по крайней мере, для части сульфата алюминия до тех пор, пока не образуется достаточное количество свободной кислоты, чтобы остановить дальнейший гидролиз.
$\endgroup$
Твой ответ
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Применение сульфата алюминия _Arax Chemistry Алюминий
Использование сульфата алюминия
- arax_writer
Применение сульфата алюминия
Использование сульфата алюминия: Сульфат алюминия является широко используемым промышленным химикатом.
Он известен как квасцы для фильтров. Соединение алюминия, серы и кислорода часто представляет собой сухие кристаллы, порошкообразное вещество, которое при намокании становится слизистым и негорючим.
Раствор Al2O3, также известный как «квасцы», использовался с древних египетских времен, когда он помогал процессу окрашивания.
Сульфат алюминия, используемый для различных целей: очистка воды,
окрашивание тканей, регулировка уровня pH, особенно основной почвы, производство бумаги, медицинское применение, дубление кожи, огнетушители, пищевая промышленность, косметическая промышленность и т. д.
сельское хозяйство чрезвычайно кислый, поэтому он используется для балансировки рН почвы.

При контакте с водой сульфат алюминия образует гидроксид алюминия и сильно разбавленный раствор серной кислоты, который изменяет почву кислота ил.
Некоторые кислотолюбивые растения (такие как черника, азалии, рододендроны, гортензии, кизил, падуб, гардении, камелии ,.) приспособлены для выращивания на кислых почвах — даже при низком уровне pH 4,5.
Если вы хотите их выращивать, pH почвы должен быть ниже 6. Некоторые виды цветов, такие как гортензии, являются индикаторами pH, а это означает, что вы можете использовать сульфат алюминия, чтобы получить великолепные гортензии разных цветов.
Крашение тканей
Сульфат алюминия используется в качестве закрепителя и протравы при окрашивании и печати на одежде. Морилка — это вещество, которое помогает красителю придать привлекательный вид ткани или бумаге. При растворении в большом количестве воды с нейтральным или слабощелочным рН соединение образует липкое вещество, гидроксид алюминия. Таким образом, при использовании этого липкого вещества цвет ткани сохраняется после стирки.
Таким образом, при использовании этого липкого вещества цвет ткани сохраняется после стирки.
Косметическая промышленность
Сульфат алюминия вызывает ощущение стягивания или покалывания кожи. Он также сближает или сужает ткани тела, которые эффективно останавливают кровоток.
Сульфат алюминия может также уменьшать или удалять неприятные запахи и защищать от образования таких запахов на коже.
Так что он использовался в дезодорантах.
Огнетушитель
Некоторые пожары нельзя потушить водой, обратите внимание на возгорание масла , если вы попытаетесь потушить огонь водой, вы сделаете его хуже. Таким образом, вы должны использовать пену, чтобы избавиться от него. Пенная смесь образуется при использовании бикарбоната натрия и сульфата алюминия, смешанных с водой.
Пищевая промышленность
Квасцы используются для различных целей в пищевых продуктах, которые мы едим, и обычно считаются безопасными при использовании в соответствии с надлежащей производственной практикой. Он растворим в воде и в основном используется в качестве загустителя и эмульгатора . Он иногда используется в человеческой пищевой промышленности в качестве укрепляющего агента, где он принимает номер Е 520, и в кормах для животных в качестве бактерицида.
Он растворим в воде и в основном используется в качестве загустителя и эмульгатора . Он иногда используется в человеческой пищевой промышленности в качестве укрепляющего агента, где он принимает номер Е 520, и в кормах для животных в качестве бактерицида.
Использование сульфата алюминия при дублении кожи
Сульфат алюминия также мог использоваться в процессе дубления для изготовления изделий из кожи . В процессе дубления сульфат алюминия смешивают с хлоридом натрия, мукой и другой солью, называемой карбонатом натрия, и натирают шкуры. Смесь остается на коже в течение 24 часов, после чего ее удаляют. Весь процесс повторяется несколько раз. Смесь, содержащая сульфат алюминия, предотвращает гниение шкур.
Производство бумаги
В прошлом сульфат алюминия (использование сульфата алюминия) использовался в для изготовления бумаги , хотя синтетические вещества в основном заменили ее. Сульфат алюминия помог увеличить размер бумаги. В этом процессе сульфат алюминия смешивали с канифольным мылом, чтобы изменить впитывающую способность бумаги. Это изменяет впитывающие свойства бумаги. Использование сульфата алюминия означает, что бумага была изготовлена в кислых условиях. Использование синтетических проклеивающих веществ позволяет производить бескислотную бумагу. Бескислотная бумага не разрушается так быстро, как бумага, проклеенная кислотой.
Сульфат алюминия помог увеличить размер бумаги. В этом процессе сульфат алюминия смешивали с канифольным мылом, чтобы изменить впитывающую способность бумаги. Это изменяет впитывающие свойства бумаги. Использование сульфата алюминия означает, что бумага была изготовлена в кислых условиях. Использование синтетических проклеивающих веществ позволяет производить бескислотную бумагу. Бескислотная бумага не разрушается так быстро, как бумага, проклеенная кислотой.
Медицинское применение
Используется в качестве коагулянта при лечении мелких порезов и ссадин, а также в производстве кровоостанавливающих карандашей. Сульфат алюминия содержится в материалах, используемых в фармацевтической промышленности. Например, он используется при приготовлении ушных капель из ацетата алюминия.
Использование сульфата алюминия при очистке воды
Сульфат алюминия известен благодаря этому качеству. Муниципальные поставщики воды, такие как ваша местная компания водоснабжения, используют квасцы для очистки воды для потребления человеком. Кроме того, технологическая вода (непитьевая вода) также может быть обработана этим химическим веществом для очистки, когда бактерии/отложения могут вызвать неблагоприятный эффект.
Кроме того, технологическая вода (непитьевая вода) также может быть обработана этим химическим веществом для очистки, когда бактерии/отложения могут вызвать неблагоприятный эффект.
При добавлении в воду сульфат алюминия вызывает слипание микроскопических примесей в более крупные частицы. Затем эти комки оседают на дно контейнера и могут быть отфильтрованы. Это делает воду более безопасной для питья. По тому же принципу квасцы также иногда используются в плавательных бассейнах для уменьшения мутности воды
ARAX CHEMISTRY является крупным производителем хлопьев каустической соды , сульфата алюминия и меди Sulfate , который предлагает свою продукцию высокого качества.
Сульфат алюминия — Exir Chemicals
Химическое название: Сульфат алюминия
Синонимы с сульфатом алюминия: белые квасцы, сульфат алюминия, кексовые квасцы, фильтровальные квасцы, квасцы бумажного производства
Другое название: белые квасцы
Классы продукции: 1. Промышленный алюминий сульфат 2. Лабораторный сульфат алюминия
Промышленный алюминий сульфат 2. Лабораторный сульфат алюминия
Химическая формула: Al 2 (SO 4 ) 3 , Al 2 O 12 S 3
Чистота: 17%
Внешний вид: Этот продукт в форме гранул, кристаллов или порошков, кислых в водных растворах с PH.
Растворимость в воде: Хорошо растворяется в воде.
Сульфат алюминия представляет собой водорастворимую соль алюминия, которая является вторым наиболее широко используемым соединением алюминия после оксида алюминия. Он имеет молярную массу 342,15 г/моль.
Производство сульфата алюминия
Сульфат алюминия обычно получают в результате ряда кислотных и термических реакций. Метод производства сульфата алюминия был установлен к середине 60-х годов за счет использования боксита или глиноземной почвы, но после этого предприятия по производству сульфата алюминия использовали в качестве материала тригидрат алюминия, полученный в результате обработки бокситов. Для этого растворяют боксит в концентрированном растворе едкого натра, чтобы образовался алюминат натрия. Затем, нейтрализуя его с помощью химического процесса Байера, тригидрат алюминия осаждается в резервуарах. Другим сырьем является серная кислота, которую доставляют туда и обратно специальными цистернами.
Для этого растворяют боксит в концентрированном растворе едкого натра, чтобы образовался алюминат натрия. Затем, нейтрализуя его с помощью химического процесса Байера, тригидрат алюминия осаждается в резервуарах. Другим сырьем является серная кислота, которую доставляют туда и обратно специальными цистернами.
Другим сырьем является серная кислота, которую перевозят специальными цистернами и сбрасывают в цистерны. Затем образуется реакция между водой, серной кислотой и тригидратом алюминия при высокой температуре и вода из смеси испаряется. Сульфат алюминия получают по следующей экзометрической реакции:
2Al(OH) 3 + 3H 2 SO 4 + 8H 2 O → Al 2 (SO 9 9 1 ) 4 2 O ΔfH = -156 кДж моль -1
На последней стадии после реакции получают сульфат алюминия в виде жидких или твердых квасцов. Если он жидкий, то его перекачивают в баки для разбавления водой. Затем жидкий сульфат алюминия фильтруется и с помощью экстракционного оборудования перекачивается в резервуары для хранения. Но если сульфат алюминия твердый, его переносят на специальные лотки и охлаждают вентиляторами. Далее лотки передаются на полки цистерн и оттуда в растворную секцию и сбрасываются в бункер. Частицы сульфата алюминия сначала измельчаются крупными дробилками, затем мелкими, а затем просеиваются. Крупные частицы, не прошедшие через сито, возвращаются на стадию дробления, а порошок сульфата алюминия, пройдя через сито, поступает на участок упаковки и маркируется как основной продукт.
Затем жидкий сульфат алюминия фильтруется и с помощью экстракционного оборудования перекачивается в резервуары для хранения. Но если сульфат алюминия твердый, его переносят на специальные лотки и охлаждают вентиляторами. Далее лотки передаются на полки цистерн и оттуда в растворную секцию и сбрасываются в бункер. Частицы сульфата алюминия сначала измельчаются крупными дробилками, затем мелкими, а затем просеиваются. Крупные частицы, не прошедшие через сито, возвращаются на стадию дробления, а порошок сульфата алюминия, пройдя через сито, поступает на участок упаковки и маркируется как основной продукт.
Aluminum sulfate types:
1: Aluminum sulfate granules:
2: Aluminum sulfate powders:
3: Aluminum sulfate crystals:
Сульфат алюминия Области применения:
Использование сульфата алюминия в очистке воды и сточных вод
Наибольшее промышленное применение сульфата алюминия приходится на процесс очистки воды. Сульфат алюминия широко используется в этом секторе, поскольку очистка питьевой воды и сточных вод является неотъемлемой частью современной инфраструктуры. В процессе очистки воды сульфат алюминия вызывает коагуляцию частиц и их объединение в более крупные частицы. Эти крупные частицы легко оседают на дне очистного пруда или отделяются от воды в процессе фильтрации. Этот процесс называется свертыванием или коагуляцией. Исследования показывают, что сульфат алюминия, который используется для очистки питьевой воды, является основным источником газообразного сероводорода в канализационных системах. Использование коагулянтов на основе алюминия может привести к незначительному повышению уровня алюминия в очищаемой воде, но с учетом количества используемых коагулянтов вреда здоровью потребителей этот уровень не наносит. Однако неправильное использование сульфата алюминия может привести к загрязнению воды. В некоторых случаях флокулянты на основе сульфата алюминия также используются для коагуляции частиц и, таким образом, для придания прозрачности воде в бассейне.
Сульфат алюминия широко используется в этом секторе, поскольку очистка питьевой воды и сточных вод является неотъемлемой частью современной инфраструктуры. В процессе очистки воды сульфат алюминия вызывает коагуляцию частиц и их объединение в более крупные частицы. Эти крупные частицы легко оседают на дне очистного пруда или отделяются от воды в процессе фильтрации. Этот процесс называется свертыванием или коагуляцией. Исследования показывают, что сульфат алюминия, который используется для очистки питьевой воды, является основным источником газообразного сероводорода в канализационных системах. Использование коагулянтов на основе алюминия может привести к незначительному повышению уровня алюминия в очищаемой воде, но с учетом количества используемых коагулянтов вреда здоровью потребителей этот уровень не наносит. Однако неправильное использование сульфата алюминия может привести к загрязнению воды. В некоторых случаях флокулянты на основе сульфата алюминия также используются для коагуляции частиц и, таким образом, для придания прозрачности воде в бассейне.
Использование сульфата алюминия в красильной промышленности
Когда сульфат алюминия в значительной степени растворяется в нейтральной или слабощелочной воде, гелеобразное вещество, подобное гидроксиду алюминия, осаждается на дне контейнера. При окрашивании и печати на одежде нанесение желатина помогает стабилизировать цвет волокон одежды за счет нерастворимых пигментов. Сульфат алюминия используется в качестве стабилизатора в процессе окрашивания. Стабилизатор — это материал, который помогает печатать и печатать на бумаге и ткани. Сульфат алюминия При смешивании с водой он образует гелеобразный гидроксид алюминия, который способствует окрашиванию, способствуя абсорбции красителя волокнами. Сульфат аммония также стабилизирует цвет тканей, растворяя красители в воде. Сульфат алюминия используется с 2000 г. до н.э.
Использование сульфата алюминия в сельском хозяйстве
В некоторых случаях сульфат алюминия используется для снижения pH садов и сельскохозяйственных угодий. Это связано с гидролизом сульфата алюминия и образованием осажденного гидроксида алюминия и разбавленного раствора серной кислоты. Некоторые цветоводы Idrisia или Hortansia используют кислую природу сульфата алюминия для изменения цвета цветка, так как на цвет цветка этого растения сильно влияет pH почвы.
Это связано с гидролизом сульфата алюминия и образованием осажденного гидроксида алюминия и разбавленного раствора серной кислоты. Некоторые цветоводы Idrisia или Hortansia используют кислую природу сульфата алюминия для изменения цвета цветка, так как на цвет цветка этого растения сильно влияет pH почвы.
Сульфат алюминия в косметической индустрии здоровья
Сульфат алюминия также известен как квасцы алюминия. Квасцы представляют собой дважды сульфатированные соли общей формулы AM (SO 4 ) 2 ·12HO 2 . Формула А представляет собой одновалентный катион, такой как калий или аммоний, а М представляет собой ион трехвалентного металла, такого как алюминий. Сульфат алюминия-калия и другая форма квасцов, сульфат алюминия-аммония, являются одними из наиболее часто используемых антиперспирантов. Благодаря антибактериальным свойствам сульфата алюминия этот материал используется в производстве некоторых антипотовых материалов. Сульфат квасцов также используется во многих странах для лечения передозировок. Сульфат алюминия используется в качестве стягивающего агента в ручках, блокирующих кровь, для предотвращения кровотечения из небольших разрезов.
Сульфат алюминия используется в качестве стягивающего агента в ручках, блокирующих кровь, для предотвращения кровотечения из небольших разрезов.
Применение сульфата алюминия в других отраслях промышленности включает:
Сульфат алюминия используется в строительной отрасли в качестве гидроизоляционного агента для бетона. Еще одно использование сульфата алюминия — в качестве пенообразователя в пене для пожаротушения. Сульфат алюминия-калия обычно используется в дрожжевых порошках. Сульфат алюминия также используется для контроля роста водорослей в прудах, озерах и водотоках. Сульфат алюминия также используется в производстве кожи, сельскохозяйственных удобрений, мыла, фармацевтических препаратов и химических катализаторов.
Опасности при работе с сульфатом алюминия
При проглатывании или вдыхании сульфата алюминия: опасно вдыхать алюминий при кашле и одышке. При вдыхании сульфата алюминия немедленно покиньте загрязненный участок и дышите свежим воздухом.
Сульфат алюминия может вызывать раздражение глаз, кожи или кожи, зуд, покраснение и боль. При попадании сульфата алюминия на кожу или в глаза промойте место контакта водой в течение 15 минут. При попадании сульфата алюминия на кожу снять загрязненную одежду и промыть кожу водой.
Прием пищи или проглатывание сульфата алюминия может вызвать сильное раздражение желудка и кишечника. У человека, употребляющего сульфат алюминия, может развиться диарея, рвота и тошнота. Если вы съели или проглотили сульфат алюминия, выпейте стакан молока, а затем вырвите.
Хранение
Сульфат алюминия мало подвержен коррозии из-за низкого pH, а также низкого содержания кислоты в продукте. Поэтому рекомендуется, чтобы трубы, соединения и все емкости, примыкающие к раствору сульфата алюминия, были изготовлены из пластика, стеклопластика, стали. Нержавеющая сталь или другие прочные материалы.
Сульфат алюминия следует хранить в прохладном, сухом месте в контейнере с двойными стенками и не смешивать с другими материалами.


